伪狂犬病毒FJ 2012株感染湖羊肾脏的转录组谱特征及对FoxO通路的影响
彭瑶顺, 李方瑾, 徐佳汇, 戰 婷, 王全溪,2, 周伦江
(1.福建农林大学动物科学学院(蜂学学院),福建 福州 350002;2.福建省兽医中药与动物保健重点实验室(福建农林大学),福建 福州 350002;3.福建省农业科学院畜牧兽医研究所,福建 福州 350013)
伪狂犬病是伪狂犬病毒(Pseudorabiesvirus, PRV)感染多宿主的一种急性传染病,宿主包括猪、牛、羊等经济动物及一些野生动物[1].我国羊伪狂犬病毒感染最早报道于20世纪50年代,近年来由于猪的流动性增加,以及羊的养殖规模逐渐扩大,羊感染PRV的报道也逐年增多[2].羊感染PRV主要为口吐白沫,皮肤局部痒,体温升高,最后严重者死亡,剖检病理变化常见于肺出血明显,脑实质水肿出血,肾脏表面有出血点[3].但是有关羊感染PRV的致病机制研究鲜有报道.
基于RNA-seq的高通量测序主要应用于筛选差异基因、预测新转录本及基因功能分析等方面,有助于从分子水平研究病毒入侵宿主以及宿主的防御机制[4,5].Fan et al[6,7]基于转录组数据对感染了PRV的大鼠脑、肺、脾脏等组织进行分析,结果表明,miR-122-5p具有调控NOD2-RIP2信号通路的功能,从而抑制该信号通路调控的促炎反应,为伪狂犬病毒逃避宿主免疫应答的研究提供依据.
湖羊属于绵羊,在南方如江浙一带饲养相对较多[8].肾脏是PRV侵害湖羊的器官之一.PRV感染如何导致肾脏病变,通过何种途径对其进行调控尚未明了.本试验基于PRV FJ 2012株,以湖羊为模式动物,借助RNA-seq技术,对PRV人工感染湖羊的肾脏转录组进行分析,了解伪狂犬病毒感染羊的致病机制.
1 材料与方法
1.1 动物及分组
5月龄湖羊8头,均购买自闽侯某大型养殖场,并经PCR检测确认PRV抗原阴性和ELISA检测抗体阴性.PRV FJ 2012株由福建省农业科学院畜牧兽医研究所保存并提供.动物使用全价料进行适应性饲养,随后将湖羊随机且平均分成空白对照组和PRV攻毒组.PRV攻毒组(5头)颈部皮下注射病毒悬液1 mL·只-1(TCID50=103mL),空白对照组每头样本注射灭菌生理盐水1 mL.攻毒后7 d内每日进行临床观察,对有呼吸困难、共济失调等临床症状的湖羊进行解剖,采集肾脏,保存于已装有RNAhold的5 mL离心管,随后转入-80 ℃冻存.
1.2 总RNA的提取
肾组织总RNA提取按照RNeasy Plus Mini Kit(QIAGEN)说明书进行,使用Nanodrop 2000测定样品RNA浓度和光密度值D,并使用1%琼脂糖变性凝胶电泳检测RNA质量,符合质量的RNA送至北京诺禾致源基因公司进行转录组测序分析.
1.3 样品质量测序评估分析
使用Illumina公司的第二代测序技术,获取了送检样品的原始数据.由于在测序过程中伴随着核酸片段的打断以及接头等过程,所以序列数据参差不齐.因此,需要对获得的数据进行筛选.该过程包含:剔除带接头的reads、含有N的reads以及Q≤20的低质量reads[9].同时,对去杂质后的干净数据进行Q20、Q30和GC含量计算.使用CASAVA处理获取的原始数据并用于后续分析[8].
1.4 差异表达基因分析
根据基因长度计算每个基因的FPKM,并计算映射到该基因的读数.FPKM指每百万碱基对测序的转录本序列片段的每千碱基片段的预期数量,是当前最常用的检测评估方法,以|Log2(FoldChange)|>0,P<0.05为差异表达基因[8].
两组之间的差异表达使用DESeq2软件(1.16.1)进行分析.Benjamini和Hochberg调整P值,P<0.05的基因即为差异表达基因.对差异检验的P-value作多重假设检验校正,通过控制伪发现率(false discovery rate, FDR)决定P-value的域值[8].
1.5 GO和KEGG富集分析
GO (gene ontology)富集分析主要通过ClusterProfiler (3.4.4)软件对所有筛选的差异表达基因进行生物功能分析.将阈值定为P≤0.05,对符合要求的GO term进行差异富集.通过Cluster Profiler (3.4.4)软件将差异表达基因富集到不同的KEGG通路,分析生物体内的各种信号通路.通路显著性富集分析以KEGG pathway为单位,应用超几何检验,找出与整个基因组相比较后差异表达基因中显著性富集的pathway[8].
1.6 差异基因的qPCR检测结果
为了验证转录组数据,本试验着重对FOXO通路的差异表达基因进行了qPCR验证.首先在NCBI中查找基因序列(STAT3:XM_015098787.2,FoxO3:NM_001267889.1,BCL6:XM_012097363.3,ATG8:XM_012175401.3,IL6:NM_001009392.1,SGK2:XM_004014577.4,PEPCK:XM_027977017.1,ACTROGIN:XM_004011657.4,IRS:XM_015093559.2,β-肌动蛋白:X00182.1),并采用Primer 15.0设计特异性引物(表1).将PRV感染后所采集的羊肾脏进行总RNA提取,反转录为cDNA,作为qPCR模板.反应条件为:94 ℃ 30 s,94 ℃ 5 s+60 ℃ 30 s,40个循环.β-肌动蛋白基因作为参考基因,使用-ΔΔCt法计算差异表达基因的log2(fold change).

表1 qPCR引物的序列Table 1 Sequences of qPCR primers
2 结果与分析
2.1 总RNA质量检测结果分析
PRV FJ 2012株人工感染湖羊,体温最高达42.5 ℃,皮肤瘙痒,神经症状和口吐白沫.感染后第5天共死亡4只,剖检采集肾脏.感染后第7天,剖检感染组和对照组所有羊,采集肾脏.提取所有样品总RNA送生物公司测序.对照组和人工感染组肾脏的8个样本,通过转录组测序质量分析结果表明(表2),共获得测序长度为43 776 562~48 202 572个原始片段(raw reads),各样本有效片段(clean reads)最低可达到6.4G,Q30(测序错误率小于0.1%)均在93.64%以上,GC含量均在47.95%以上,证明数据可靠,可以进行后续的生物学分析.
2.2 差异表达基因的筛选
通过对转录组测序中筛选到的有效数据进行分析,发现PRV FJ 2012株感染湖羊与空白对照组湖羊的肾脏有2 679个差异表达基因,其中1 269个基因下调,1 410个基因上调(图1),表明伪狂犬病毒感染湖羊肾脏,激活肾脏启动大量的基因应答.

图1 PRV感染湖羊肾脏中差异表达基因筛选结果Fig.1 Screening of differentially expressed genes in Hu sheep kidney infected with PRV
2.3 GO富集分析
将筛选到的差异表达基因进行GO富集分析,GO分为3个主要功能类别,即生物过程、细胞组分和分子功能.选取富集基因数大于2个的GO条目,按照富集显著性P-value值,筛选到显著富集的前10个GO条目(图2).在生物过程方面,显著富集的GO Term主要是蛋白折叠、GPI锚定代谢过程、蛋白质脂质化功能;在细胞组分方面,显著富集的GO Term主要是细胞核、染色质、细胞外间隙等;在分子功能方面,显著富集的GO Term主要是未折叠蛋白结合、热休克蛋白结合、序列特异性DNA结合等.

图2 差异表达基因的GO富集分析结果Fig.2 GO enrichment analysis of differentially expressed genes
2.4 KEGG通路分析
为了对差异表达基因进行KEGG通路分析,使用在线分析软件DAVID将基因的ID号比对到KEGG数据库,富集出病毒感染后差异表达的基因可能参与的通路.通过对攻毒组与空白组富集到的DEGs分析表明,富集到的差异通路有316条,其中差异显著的通路有7条(P<0.05)(图3).包括FoxO信号通路,真核生物核糖体生物发生,TNF信号通路,沙门氏菌感染,IL-17信号通路,甘氨酸、丝氨酸和苏氨酸代谢,AGE-RAGE信号通路在糖尿病并发症中的作用(AGE-RAGE signaling pathway in diabeticcomplications)等信号通路.

图3 差异表达基因的KEGG富集结果Fig.3 KEGG pathway enrichment analysis of differentially expressed genes
2.5 qPCR验证肾脏中FOXO信号通路DGEs的mRNA表达结果
为了验证转录组数据,本试验选择FOXO3通路,验证了STAT3、IL-6、FOXO3、BCL6、ATG8、IRS、SGK2、ATROGIN、PEPCK等DEGs.攻毒组与空白对照组相比STAT3、IL-6、FOXO3、BCL6、ATG8等基因的mRNA水平上调,IRS、SGK2、ATROGIN、PEPCK的mRNA水平下调,qPCR结果与转录组测序数据结果一致(表3).可见,转录组的数据可靠,PRV感染湖羊肾脏调控了肾脏中FOXO3通路的多个基因表达.
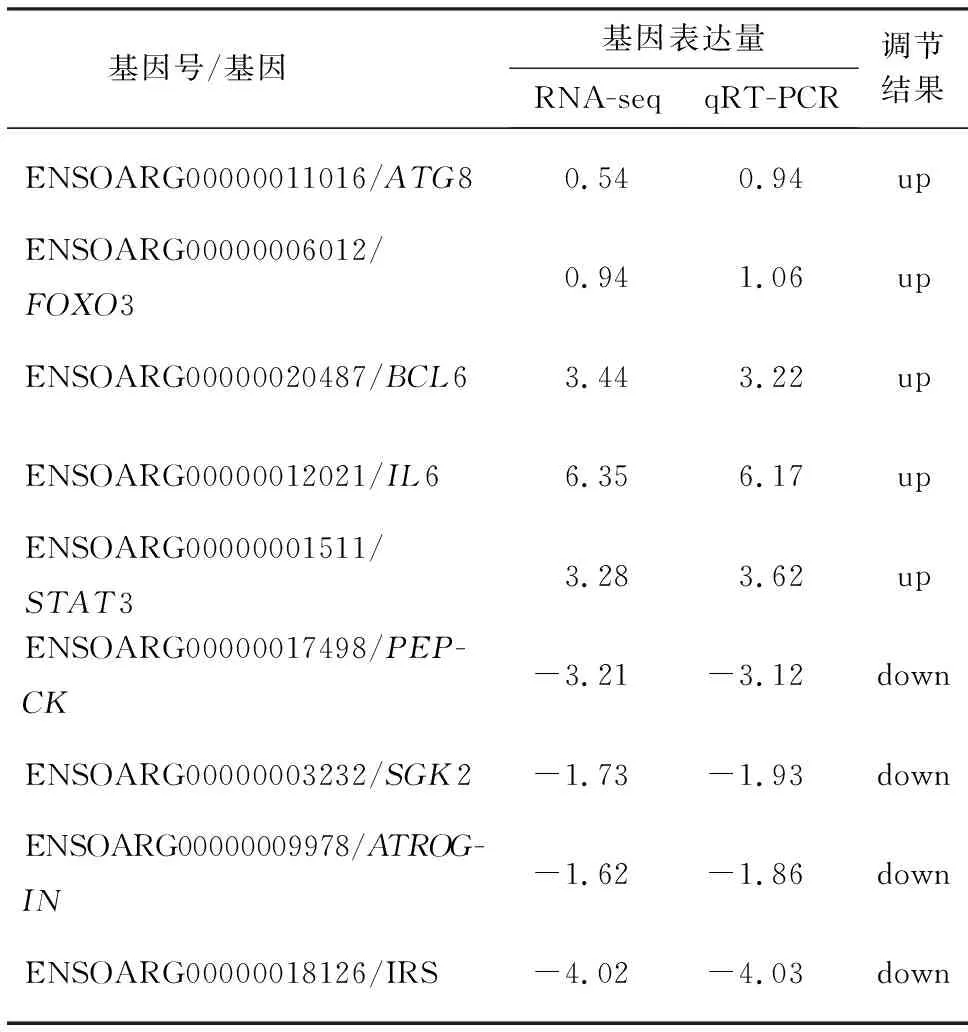
表3 qPCR验证肾脏中差异表达基因mRNA的表达结果Table 3 Validation of mRNA expressions of differentially expressed genes in Hu sheep kidney by qPCR
3 讨论
RNA-seq技术作为新一代的测序技术,主要应用于检测差异基因、预测新转录本以及基因功能分析等方面.RNA-seq技术有助于从转录组水平研究病毒入侵宿主以及宿主的分子机制.有研究表明[5],PRRSV感染猪肺泡巨噬细胞后,与IL-15产生相关的5个基因(IFNb1、IL-15、IRF1、JAK2和STAT1)均上调,这部分解释了PRRSV感染后导致的高炎症反应.龚小程等[10]利用RNA-seq技术研究CSFVShimen株与宿主细胞的相互作用,研究表明双细胞系差异基因主要集中在NF-κB相关的通路,低NF-κB活性的细胞对流感病毒具有抵抗性,推测CSFV感染过程中NF-κB通路的活化会影响病毒的侵染.Jin et al[11]通过RNA-seq技术研究表明,PRV感染细胞后长链非编码RNA的沉默LncA02830可显著上调IRF3、干扰素β和MX1的转录水平,抑制PRV-Ⅱ的复制.因此,合理使用RNA-seq技术有助于深入了解病毒的致病机理.
本试验对伪狂犬病毒感染湖羊肾脏进行RNA-seq测序共筛选到2 679个DEGs,这些DEGs参与29个生物学功能,主要涉及生物代谢、信号传导、细胞周期等相关基因网络.在分子功能方面的GO功能富集中发现,未折叠蛋白结合显著增多,对KEGG通路分析发现PERK蛋白表达上升,这表明PRV感染湖羊肾脏引起内质网应激.自噬相关蛋白基因表达上调(ATG8,ATG12),推测伪狂犬病毒导致内质网应激后进一步诱导细胞产生自噬,这可能与病毒的复制有关.
已有研究表明[12],PRV与细胞自噬存在关联,伪狂犬病毒感染早期(0~6 h)促进细胞自噬,后期通过激活PI3K/AKT/mTORC1途径抑制自噬来增加感染性病毒粒子的数量.同时,揭示了伪狂犬病毒被膜蛋白US3抑制LC3-Ⅰ转变为成熟LC3-Ⅱ的过程.通过伪狂犬病毒侵染PK-15的试验表明[15],Beclin1抑制bcl-2与bcl-xl相结合,再将Neuro-2a细胞人工感染伪狂犬病毒,确认了PRV通过经典的Beclin-1-ATG7-ATG5途径诱导Neuro-2a细胞自噬,促进病毒在体外的复制.
FOXO是转录因子叉头框蛋白O.FOXO功能广泛,参与细胞的自噬、凋亡、新城代谢等过程[13].FOXO受到上游蛋白AKT的调控,活化的AKT磷酸化FOXO,然后转运到细胞质中,从而失去转录调控功能[14].通过对FOXO信号通路分析表明,伪狂犬病毒感染湖羊肾脏会导致IL-6、STAT3、FOXO3、ATG8等基因的mRNA上调.研究显示,细胞质中STAT3通过隔离EIF2AK2以及与其他自噬相关信号分子如FOXO1和FOXO3相互作用,结构性地抑制自噬.张晓芹通过免疫组织化学和qPCR两种方法检测结肠癌组织中的STAT3和IL-6表达水平,发现两者呈现出明显的正相关,IL-6-STAT3与结肠癌发展有关[15].VZV在细胞复制过程中,激活STAT3-BNIP3调节细胞自噬促进VZV复制[16,17].本试验通过分析湖羊感染伪狂犬病毒的肾脏转录组数据,发现了与已知伪狂犬病毒诱导的自噬不同的通路,即IL-6-STAT3-FOXO3-ATG8信号通路与PRV导致的细胞自噬可能存在关联.

