抗食品腐败真菌的乳酸菌筛选、复配及混合发酵工艺优化
杜莹瑞,李市场,冯腾柱,张亚娟,陈 妍,龚明贵
(河南科技大学食品与生物工程学院,河南洛阳 471023)
在食品工业中,真菌污染及其毒素是造成经济损失、危害消费者健康的重要原因[1]。真菌及毒素大部分具有高毒及致癌性,极易在各类食品中存在,严重影响食品的安全和消费者健康[2]。食品腐败真菌在市场上大多采用食品添加剂进行食品防腐,而添加剂属于化学物品且大多都是国家禁止使用的[3]。因此,对抗食品腐败真菌混合菌的筛选及发酵工艺的优化是迫切需要的。
乳酸菌和丙酸杆菌单独发酵的发酵液具有一定的抗真菌活性[4-7],但活性较低。目前有许多报道乳酸菌和丙酸杆菌抗真菌活性的研究与应用,包括菌株筛选方法的优化与创新,发酵产物中抗真菌成分的前体物质的添加以及整个发酵过程的优化等。如Garnier等[8]通过模拟奶酪的方法对奶酪中具有抗真菌活性的菌株进行筛选,文中介绍了24孔板法对干酪中乳杆菌的筛选及测定其抗真菌活性,结果发现不同乳酸菌对真菌抑制的种类和效果有所差异。实验所用的几种干酪乳杆菌的含菌培养物均显示出抗真菌活性,但抑制的真菌种类和抑制效果不尽相同。;并且Valerio等[9]通过添加乳酸菌抗真菌代谢物中苯乳酸的前体物质苯丙氨酸提高了乳酸菌的抗真菌活性,文中采用96孔板进行微孔稀释试验测定抗真菌活性,结果表明,乳酸菌显示的抗真菌活性可以通过向生长培养基中加入苯丙酮酸来改善和优化,并且它是存在几种以协同方式起作用的代谢物的结果;Zhang等[10]通过Lactobacillus buchneri和Lactobacillus diolivorans在酸面团中共同发酵产生丙酸来达到抗真菌效果,文中使用琼脂孔扩散评估乳杆菌发酵的酸面团的抗真菌活性,以期可以通过添加酸面团来代替化学品的使用。因此,本文从多株乳酸菌和丙酸杆菌菌株中筛选出抗食品腐败真菌活性较高菌株[11-12],通过一系列方法筛选抗食品腐败真菌菌株最佳组合[13],从混合菌发酵角度出发,优化混合菌发酵条件以最大限度提升植物乳杆菌L9和费氏丙酸杆菌D5菌株组合的抗真菌效果,解决单菌抗真菌活性低、减少市场食品浪费问题[14-16]。
1 材料与方法
1.1 材料与仪器
费氏丙酸杆菌(Propionibacterium freudenreichii)D4、D5和乳酸乳球菌(Lactococcus lactis) L1~L6、L8、L9菌株、沃纳利葡萄球菌(Staphylococcus warneri)L7 由上海市华东师范大学微生物实验室保藏;植物乳杆菌(Lactobacillus plantarum) MRE3013、MRE3014、MRE3035菌株 从罗非鱼肠道中分离得到,由中国海洋大学食品学院赠予;费氏丙酸杆菌(Propionibacterium freudenreichiiATCC 9614) D1、D2 美国ATCC菌种保藏中心;指示菌 面包腐败真菌(黑曲霉、黄曲霉、桔青霉、枝孢霉、交链孢霉);MRS培养基、SLB培养基、ME培养基、MESP培养基、TGYE培养基 北京奥博星生物技术有限责任公司;PDA培养基 国药集团化学试剂有限公司;M17培养基 北京陆桥技术股份有限公司;WFH培养基 20%高筋小麦粉(w/v)在室温下于磁力搅拌器中1200 r/min搅拌4 h,于冷冻离心机中离心(4000 r/min,10 min,4 ℃)获得上清液,每升上清液中加入葡萄糖、麦芽糖、蔗糖和果糖各15 g,以及10 g酵母浸粉和7 g琼脂,pH6.8±0.1,106 ℃,灭菌20 min;脱脂乳粉培养基 40 g/L脱脂乳粉,pH7.0±0.1,115 ℃,灭菌30 min。
HCB-900V超净工作台 青岛海尔生物医疗股份有限公司;CR22N大容量高速冷冻离心机 Hitachi Koki Holdings Co., Ltd;9203A电热恒温鼓风干燥箱上海跃进医疗器械厂;Synergy HT酶标仪BioTek Instruments,Inc.;T18 ULTRA-URRAX均质机 艾卡(广州)仪器设备有限公司;IKA lab dancer漩涡振荡器 艾卡(广州)仪器设备有限公司;DELTA 320 pH计 梅特勒-托利多国际有限公司。
1.2 实验方法
1.2.1 单一抗真菌性强的菌株筛选 首先从L1-L9、D1、D2、D4、D5、MRE3013、MRE3014和MRE303516株菌株中筛选出抗真菌性较强的单一菌株,再进行筛选较强抗真菌性的菌株组合。
将各株乳酸菌和丙酸杆菌分别接种到 MRS和SLB液体培养基中,置于30 ℃的恒温摇床中,以180 r/min转速进行培养2 d,制备种子液。配制MRS琼脂培养基于24孔板中,用10 μL规格的一次性接种环沾取各菌株的种子液,在琼脂平板中进行接种,在无菌层流空气将其吹干后,放置在厌氧产气袋中,在30 ℃培养箱中培养48 h[17-19]。制备指示霉菌孢子悬液,并用血球计数板计数[20]孢子悬液的孢子浓度,并将孢子悬液用无菌水稀释到1×105个孢子/mL,4 ℃冰箱保藏备用。配制软琼脂,高压蒸汽灭菌后在55 ℃水浴锅中保温备用。将1×105个孢子/mL的5种霉菌孢子悬液分别用软琼脂10倍稀释,振荡摇匀,制备含1×104个孢子/mL霉菌孢子的软琼脂[21]。将5 mL 1×104个孢子/mL的5种软琼脂分别加入到培养48 h的各菌株MRS琼脂平板中进行覆盖。待软琼脂凝固后,将平板放入28 ℃的培养箱中有氧培养,观察记录各孔霉菌的生长情况。
1.2.2 24孔板法筛选复合菌株协同抗真菌组合 将各株抗真菌乳酸菌和丙酸杆菌分别接种到 MRS 肉汤和SLB培养基中,在30 ℃条件下分别培养24和48 h制备种子培养液。将种子培养液离心(5000×g,10 min,4 ℃),并用无菌生理盐水重悬振荡进行洗涤,洗涤2次后重悬于十分之一体积的生理盐水中,将菌悬液稀释,取样测定OD600,缓慢加入生理盐水稀释,直到稀释到OD600=0.5,两个菌大小形态相似,所以对应的OD600也几乎一样,以此为比例进行稀释。记录这个稀释浓度,在超净台里以同样浓度稀释,两个菌都是稀释到OD600=0.5制备菌悬液。
将制备好的菌悬液各50 μL加入到含乳酸菌和丙酸杆菌混菌琼脂培养基的24孔板中,设计阴性对照(加入菌悬液100 μL)和阳性对照组(加入无菌生理盐水100 μL),然后加入用 1 mL融化的小麦粉水解物(WFH)琼脂培养基(45 ℃水浴锅保温),与之前加入的菌液摇晃混合混匀,待琼脂凝固后置于 30 ℃培养箱中培养18 h[22]。 培养18 h后,在24孔板各孔中覆盖100 μL 含104个指示真菌孢子/mL 的软琼脂,28 ℃培养,每24 h观察乳酸菌/丙酸杆菌组合对指示霉菌的抑制情况并记录[23]。
1.2.3 分级抑菌浓度(Fractional inhibitory concentration,FIC)法进一步筛选复合菌协同抗真菌组合 制备1.2.2步骤中筛选得到的菌株的OD600=0.5的菌悬液进一步筛选复合菌协同抗真菌作用。将菌液用无菌的生理盐水进行10倍梯度稀释,乳酸菌稀释为10、10-1、10-2、10-3倍原浓度的菌悬液,10、10-1、10-2、10-3、10-4倍原浓度的菌悬液。24孔板为4×6排列的小孔,除了最后一纵列作为空白对照(100μL无菌生理盐水)外,剩下4×5格。将4种梯度浓度的乳酸菌菌悬液从上到下每行浓度依次递减加入,每孔50 μL;将5种梯度浓度的丙酸杆菌菌悬液从左到右丙酸菌每行浓度依次递减加入,每孔50 μL,然后加入用1 mL融化的小麦粉水解物(WFH)琼脂培养基(45℃水浴锅保温),与之前加入的菌液摇晃混合混匀,待琼脂凝固后置于30 ℃培养箱中培养18 h。然后在24孔板各孔中覆盖100 μL 含104个指示真菌孢子/mL的软琼脂,28 ℃培养,每24 h观察乳酸菌/丙酸杆菌组合对指示霉菌的抑制情况并记录。
1.2.4 混合菌株发酵工艺优化 在上述的试验中,筛选出了植物乳杆菌L9和费氏丙酸杆菌D5作为后续混合发酵中的抗真菌菌株组合。因此,我们将对其发酵工艺进行优化,确定最佳发酵培养基和发酵条件,以提高协同抗真菌能力[24]。
1.2.4.1 Plackett-Burman试验 研究发现有12个因素对植物乳杆菌L9和费氏丙酸杆菌D5有影响,它们分别是葡萄糖(A)、碳酸钙(B)、酵母浸粉(C)、酪蛋白胨(D)、磷酸氢二钾(E)、硫酸镁(F)、硫酸锰(G)、氯化钠(H)、接种比(D5:L9)(J)、培养温度(K)、乙酸钠(L)、柠檬酸铵(M)[25]。通过Plackett-Burman试验对以上12个因素进行研究,每个因素分别选取两个水平:低水平“-1”和高水平“+1”,响应值为发酵液上清液的抗真菌活性。表1列出了因素的编码及水平,X1~X12分别编码了12个因素。
Plackett-Burman试验设计表如表1所示,按照设计表中的顺序配制培养基、调整接种量和发酵温度,发酵4d后做96孔板试验,用酶标仪测定[26]并计算发酵液上清液的抗真菌活性,在表中最右列列出,96孔板操作和抗真菌活性计算公式如下:

表1 Plackett-Burmen实验设计水平范围Table 1 Range of different factors investigated of Plackett-Burman design
将制得的无细胞上清液加入到96孔板的孔中,每孔添加量为100 μL;将无菌的ME肉汤以每孔100 μL的量加入到后续的孔中,对无细胞上清液进行连续的2倍浓度梯度稀释,获得一系列的无细胞上清液稀释液(至少3个平行对照),以不含无细胞上清液的ME肉汤作为阴性对照;然后在稀释液中加入100 μL 含1×104个孢子/mL的霉菌孢子ME肉汤(阳性对照加入无霉菌孢子肉汤),放入28 ℃的恒温恒湿(80% RH)培养箱中培养48 h。
霉菌生长受无细胞上清液抑制的程度通过测定96孔板中霉菌在620 nm波长处的吸光度确定。细胞上清液的抗真菌活性以AU为单位定量,其表示为霉菌生长抑制率为50%的情况下,对应的无细胞上清液的浓度的倒数。其中生长抑制率(Ifungal)的计算公式为:

其中,Ifungal为对霉菌的生长抑制率;At为实验组孔中霉菌的吸光度;Apc为阳性对照(无霉菌生长)孔的吸光度;Anc为阴性对照孔中霉菌的吸光度。
通过线性插值法确定Ifungal=50%时无细胞上清液的浓度(IC50),公式如下:
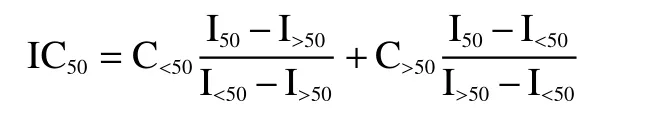
其中IC50为无细胞上清液在Ifungal=50%时的浓度;C<50为无细胞上清液在Ifungal<50%孔中的浓度;C>50为无细胞上清液在Ifungal>50%孔中的浓度;I>50为无细胞上清液在Ifungal>50%孔中的生长抑制率;I<50为无细胞上清液在Ifungal<50%孔中的生长抑制率;I50=50%。
于是抗真菌活性(Aantifungal)的计算公式为:

1.2.4.2 最陡爬坡试验 影响植物乳杆菌L9和费氏丙酸杆菌D5菌株发酵液抗真菌活性的三个关键因素为酵母浸粉(C)、葡萄糖(A)、碳酸钙(B);最终得到三个主要因素的回归方程:抗真菌活性(AU)=-26.7+0.834A-0.518B+0.268C,从回归方程中可以看出,葡萄糖(A)和酵母浸粉(C)对抗真菌活性有正效应,碳酸钙(B)则对其有负效应。以发酵液上清液的抗真菌活性作为响应值,对3个关键因素进行最陡爬坡试验,试验设计如表2所示。
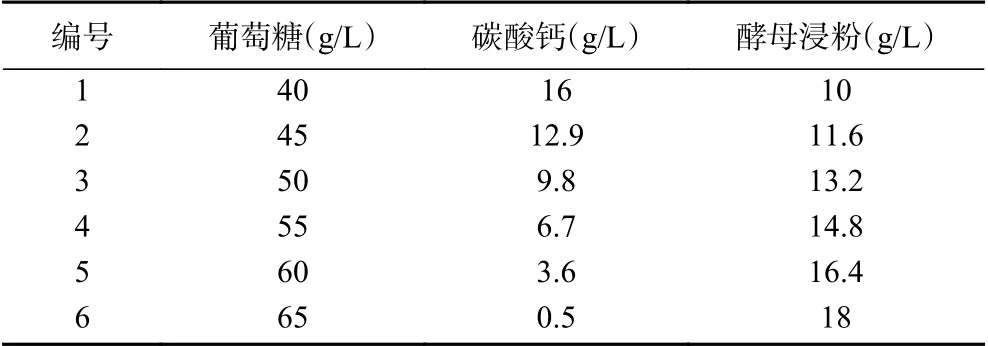
表2 最陡爬坡试验设计Table 2 Design of the steepest climbing test
1.3 数据处理
各项数据均平行三次,用Word和Graphpadprism8作图,通过Minitab 18软件进行分析,得到试验方差分析表比较组间差异的显著性,通过Design Expert 12软件对数据进行多元回归拟合,对得到的回归模型进行方差分析。
2 结果与分析
2.1 单菌菌株对5种霉菌的抗真菌效果
测定单菌菌株对5种霉菌的抗真菌效果,在24孔板中用双层琼脂覆盖法评估了单菌菌株对5种霉菌指示菌的抗真菌效果,而桔青霉、黄曲霉是前期所试验面包中污染霉菌出现频率最高的两种霉菌,因此筛选主要对这两种菌抑制效果较强的抗真菌菌株。经研究发现有6株菌株对桔青霉、黄曲霉的抑制效果比较明显,其中L7为沃纳利葡萄球菌,L8、L9为乳酸乳球菌,3103、3014、3035为植物乳杆菌。从图1可以看出,L9菌株和3103菌株对桔青霉、黄曲霉的抑制效果最强,其次为3035菌株、L8菌株、L7菌株和3014菌株。所有菌株对5种霉菌的抗真菌效果如表1所示。鉴于L7是不属于《可用于食品的菌种名单》的菌种,所以后续试验中不再对它的抗真菌活性进行进一步研究。
从图1和表3中可以看出,在15株抗真菌菌株中,编号为L8、L9的乳酸乳球菌和编号为3103、3014、3035的植物乳杆菌这5株菌株对面包中污染霉菌出现频率最高的两种霉菌桔青霉和黄曲霉有较强的抗真菌效果;丙酸杆菌属菌株对霉菌的抑制效果要整体强于乳酸菌组。但乳酸菌中也有个别对5种霉菌抑制能力较强的菌株,如L1、L9、3013和3035菌株。而且霉菌对于抗真菌菌株的敏感性也有差异,在PDA平板中加入不同添加量的发酵液后,枝孢霉和链格孢霉在较低的发酵液添加量下被抑制,在96孔板试验下,也是在较低的浓度下被抑制,而黑曲霉、黄曲霉和桔青霉在稍高的发酵液添加量下才被抑制。因此得出黑曲霉、黄曲霉和桔青霉的生长不容易被抗真菌菌株所抑制,而枝孢霉和交链孢霉的生长较易被抑制。

图 1 6株菌株对桔青霉Q05(A)和黄曲霉Y03(B)的抑制效果Fig.1 Inhibitory effects of 6 strains on Penicillium citrinum Q05 (A) and Aspergillus flavus Y03 (B)

表3 各抗真菌菌株对5种霉菌的抑制效果Table 3 Inhibitory activity of antifungal strains against 5 kinds of molds
2.2 复合菌协同作用对真菌的影响
由前期实验表明,选择黄曲霉作为指示菌。对所有乳酸菌和丙酸杆菌悬液进行处理,取样测定OD600值,加生理盐水稀释,直到稀释到OD600=0.5,两个菌大小形态相似,所以对应的OD600也几乎一样,以此为比例进行组合,在所有的组合中有7组结果相对较好,如图2所示。所有乳酸菌和丙酸杆菌菌株组合的测定结果如表4所示。
从图2和表4中可以看出,乳酸菌中植物乳杆菌L9、3014、3035在与丙酸杆菌中D1和D5组合培养后表现出抗真菌活性的增加,表现出了抗真菌活性的协同作用。而植物乳杆菌L9、3014、3035在第一个结果中已被筛选出为单一抗真菌较强菌株,又与丙酸杆菌进行组合也被筛选出为抗真菌性较强组合,证明猜想正确。

图 2 乳酸菌和丙酸杆菌组合对黄曲霉Y03的抑制效果Fig.2 Inhibitory effect of Lactobacillus and Propionibacterium combination on Aspergillus flavus Y03

表4 乳酸菌和丙酸杆菌的组合对黄曲霉Y03的抑制效果Table 4 Inhibitory effect of Lactobacillus and Propionibacterium combination on Aspergillus flavus Y03

图 3 FIC法测定抗真菌活性Fig.3 Antifungal activity assayed by FIC method
2.3 FIC法探究复合菌抗真菌组合的协同作用
从上个结果中发现植物乳杆菌L9、3014和3035菌株与费氏丙酸杆菌D1和D5有较强的抗真菌活性,于是在本实验中用FIC方法对这3×2种组合的协同抗真菌活性进行了进一步的探究,其结果如图3所示。
从图3中可以发现,在植物乳杆菌L9与费氏丙酸杆菌D1和D5的组合中,其抗真菌活性与两种菌的浓度表现出正相关关系。而在植物乳杆菌3014和3035与费氏丙酸杆菌D1的组合中,10-2浓度的植物乳杆菌有着最佳的抗真菌效果,而过高的植物乳杆菌细胞浓度减弱了其对黄曲霉Y03的抑制作用,这可能是费氏丙酸杆菌D1与植物乳杆菌之间在过高浓度有相互抗衡作用, 但在费氏丙酸杆菌D1的抗真菌效果上看,最高的细胞浓度取得了最佳的抗真菌效果。费氏丙酸杆菌D5与植物乳杆菌3014和3035的组合的抗真菌效果并不理想,所有细胞浓度的抗真菌效果大致相当。
因此,在对比这3×2种植物乳杆菌和费氏丙酸杆菌混合培养所展现的协同抗真菌作用后,最终确定植物乳杆菌L9和费氏丙酸杆菌D5作为后续混合发酵中的抗真菌菌株组合。
2.4 Plackett-Burman试验结果
本文通过用Plackett-Burmen试验设计从12个考察因素中快速、有效地筛选出显著因子,各因素的编码和水平见表1,试验设计及结果见表5,表中的1~23分别代表23组试验,按照试验设计进行试验,每组三次平行样[27]。
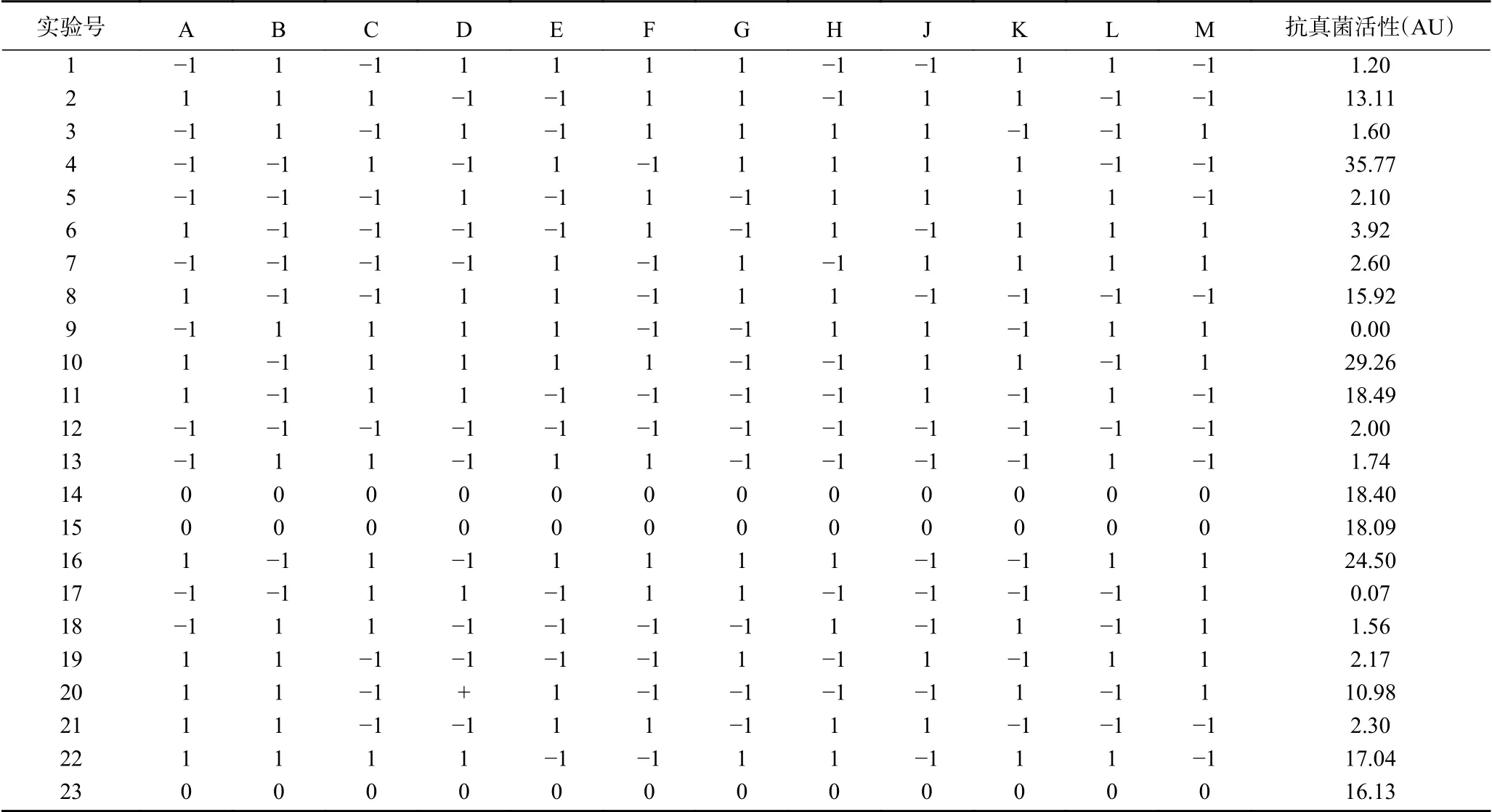
表5 Plackett-Burman试验设计和结果Table 5 Plackett-Burman experimental design and results
Plackett-Burman试验的方差分析表如表6所示,从表6中可以看出模型P值为0.03<0.05,表明多元回归模型对结果的影响显著。葡萄糖在模型中P值为0.014<0.05、碳酸钙在模型中P值为0.02<0.05,酵母浸粉的P值为0.009<0.01,表示这三个因素的水平变化对植物乳杆菌L9和费氏丙酸杆菌D5菌株发酵液抗真菌活性有显著的影响,其他因素不显著。

表6 Plackett-Burman试验的方差分析Table 6 Analysis of variance in Plackett-Burman design
12个因素的帕累托图如图4所示,12个因素的标准化效应值按照大小依次从上到下排列,当标准化效应值大于2.262时即为显著[28]。从图4中可以看出,标准化效应值大于2.26的三个因素依次分别为酵母浸粉(C)、葡萄糖(A)和碳酸钙(B),表明这三个因素对植物乳杆菌L9和费氏丙酸杆菌D5菌株发酵液抗真菌活性的影响最大。对标准化效应值最小的酪蛋白胨、氯化钠和硫酸镁3个存在与否对发酵液抗真菌活性影响较小的培养基成分进行舍弃,最终得到的用于进行下一步爬坡试验的发酵培养基配方为:葡萄糖40 g/L,碳酸钙16 g/L,酵母浸粉 10 g/L,磷酸氢二钾 0.25 g/L,硫酸锰 0.1 g/L,乙酸钠 5 g/L,柠檬酸铵 2 g/L。接种比例为5:1(D5:L9)、发酵温度为37 ℃。
2.5 最陡爬坡试验结果
如表2和图5所示最陡爬坡试验的6个梯度条件及其发酵液的抗真菌活性结果。从中可以看出,随着葡萄糖和酵母浸粉含量的增加,碳酸钙含量的减少,发酵液抗真菌活性呈现先增后减趋势,在编号为4的实验组条件下(葡萄糖55 g/L、碳酸钙6.7 g/L和酵母浸粉14.8 g/L)出现最大值,其发酵液抗真菌活性达到最大,为47.07 AU。因此,得到优化后的三个关键影响因素的最佳比例为葡萄糖55 g/L、碳酸钙6.7 g/L和酵母浸粉14.8 g/L。
3 结论
本文以导致面包发霉的典型真菌(黑曲霉、黄曲霉、桔青霉、枝孢霉、交链孢霉)为指示菌[29],筛选出了5株对面包中污染霉菌出现频率最高的两种霉菌桔青霉和黄曲霉抑制效果比较明显的单菌菌株,分别是编号为L8、L9的乳酸乳球菌,编号为3103、3014、3035的植物乳杆菌,并筛选出一组发酵液具有明显抗真菌作用的复合菌株组合植物乳杆菌 L9 和费氏丙酸杆菌 D5,对其发酵工艺进行优化,选出对最终抗真菌活性影响最大的三个因素依次分别为酵母浸粉、葡萄糖和碳酸钙,发酵培养基优化配方为葡萄糖55 g/L,碳酸钙6.7 g/L,酵母浸粉14.8 g/L,磷酸氢二钾 0.25 g/L,硫酸锰 0.1 g/L,乙酸钠 5.0 g/L,柠檬酸铵 2.0 g/L,接种比例为5:1(D5:L9),发酵温度为37 ℃,抗真菌活性可达47.07 AU。本论文首次对乳酸菌和丙酸杆菌协同抗真菌效果进行研究,结果表明复合菌发酵液抗真菌效果明显,可在食品制作中加入复合菌发酵液替代部分水,抑制食品中腐败霉菌的生长,延长食品保质期。

