百香果皮总黄酮的复合酶辅助超声波提取工艺优化及其抗氧化活性分析
张小梅 ,王 聪,靳晓琳,侯旖旎,郑丽萍
(1.郑州工程技术学院化工食品学院,河南郑州 450053;2.河南牧业经济学院,河南郑州 450046)
百香果(Passiflora edulis),又称为西番莲、鸡蛋果,是一种热带亚热带特色水果,原产于巴西,二十世纪初引入我国,广泛种植于广西、四川、台湾等地[1-3]。百香果皮,重量约为单果质量的一半,但在果肉加工过程中,大量果皮作为废料被丢弃或少量用作饲料,造成资源的极大浪费。国内的百香果研究侧重于它的采后品质与保鲜技术研究[3-5],随着对百香果深加工利用的不断重视,百香果皮深加工的相关研究也相继出现,如从百香果皮中提取果胶[6]、多糖[7]、酚类[8],制备超微果皮粉[9]、果脯[10]等。研究表明,从植物中提取的黄酮类化合物具有较高的药用价值,如抗癌[11]、抗氧化[12]、抗焦虑[13]、抗炎[14]等作用。因此,植物类黄酮的提取也引起了众多学者的重视。而百香果皮中活性成分的有效提取,将为百香果的深加工利用[15]提供了一条有效途径。
目前,关于百香果皮总黄酮的提取研究方法已有相关报道,如超声辅助乙醇提取法[16],逆流提取法[17]提取其黄酮,也有采用联合法进行提取,如余启明等[18]通过对比实验说明:微波预处理-超声波提取法得到百香果皮提取物的黄酮得率和体外抗氧化活性都要比单独用超声和浸提法优越;酶解提取法由于能破坏植物细胞的纤维素、半纤维素和果胶等物质结构,使得总黄酮更容易释放而被众多学者广泛应用于提取黄酮上。研究表明,复合酶的效果好于单一酶,如徐玉霞等[19]研究了单一酶和复合酶对海红果中总黄酮提取率的影响,试验表明使用酶法提取黄酮要优于传统的有机溶剂萃取法,且复合酶的效果好于单一酶,当纤维素酶与果胶酶质量之比为2:1时效果最好。但是有关复合酶辅助超声波法对百香果皮中黄酮提取的研究还鲜见报道。
因此,本文将复合酶解提取技术和超声波提取技术相结合,应用响应面设计方案,并对百香果皮中提取的总黄酮进行体外抗氧化实验,测定了DPPH自由基和羟自由基清除能力,以期为百香果皮中黄酮的进一步研究提供参考。
1 材料与方法
1.1 材料与仪器
百香果(新鲜、完整无破损) 购自广西赣南;芦丁标准品(HPLC≥98%) 上海贤鼎生物科技有限公司;纤维素酶(50000 U/g)、果胶酶(60000 U/g)食品级,浙江一诺生物科技有限公司;1,1-二苯基-2-苦肼基(DPPH) 上海易恩化学技术有限公司;硝酸铝、亚硝酸钠、水杨酸、过氧化氢 分析纯,天津市科密欧化学试剂有限公司;氢氧化钠、硫酸亚铁 分析纯,天津市风船化学试剂科技有限公司;无水乙醇、抗坏血酸、95%乙醇、柠檬酸、柠檬酸钠 分析纯,天津市通凯化学试剂有限公司。
400A多功能粉碎机 永康市红太阳机电有限公司;FA2204B电子天平 上海精科天美科学仪器有限公司;L530离心机 上海卢湘仪离心机仪器有限公司;SHZ-82回旋式水浴恒温振荡器 金坛市水北科普实验仪器厂;KQ-600KDE高功率数控超声波清洗仪 昆山市超声仪器有限公司;TU-1810紫外可见分光光度计 北京普析通用仪器设备有限责任公司。
1.2 实验方法
1.2.1 百香果皮预处理 去掉百香果果肉,将果皮洗净,在50 ℃的烘箱中烘烤24 h取出,用粉碎机将其粉碎,过80目筛,装入自封袋低温保存并备用。
1.2.2 百香果皮黄酮提取工艺 参考张丽静等[20]的方法,并作修改。取1.00 g样品于50 mL离心管中,按照设定的料液比添加所需浓度的乙醇溶液,放入超声波清洗仪在240 W的功率下超声一定的时间,再加入不同质量的复合酶、采用pH为4.6的柠檬酸-柠檬酸钠缓冲溶液调节体系的pH,摇匀后,在50 ℃的水浴振荡器中酶解一定时间。离心机的转速设置为8000 r/min,离心5 min;取上清液用体积分数为60%乙醇溶液定容至50 mL得黄酮粗提取液。
1.2.3 百香果皮黄酮得率的测定
1.2.3.1 芦丁标准溶液的配制 参考王洪彪[21]的方法,并作修改。称取0.2000 g芦丁标准品于烧杯中,用60%的乙醇超声波溶解后,全部转移至100 mL容量瓶中并定容,配制为2 mg/mL的溶液,吸取5 mL溶液于50 mL的容量瓶中,定容即为0.2 mg/mL的芦丁标准溶液。分别吸取0.00、0.50、1.00、2.00、3.00、4.00 mL 0.2 mg/mL标准溶液于6只10 mL容量瓶中,加入0.3 mL 5% NaNO2,摇匀,静置6 min;再加入0.3 mL 10% Al(NO3)3,摇匀,静置6 min;最后,加入4 mL 4% NaOH,用60%乙醇定容后,静置15 min;即得到0.00、0.01、0.02、0.04、0.06、0.08 mg/mL芦丁标准溶液,在400~600 nm处紫外光谱扫描,于508 nm处测吸光值。
1.2.3.2 百香果皮中黄酮得率的测定 取1.00 mL 1.2.2中制备的黄酮粗提取液于10 mL容量瓶中,按照1.2.3.1绘制标准曲线的方法进行显色反应后于508 nm处测定其吸光值。根据标准曲线方程计算黄酮浓度,参照公式(1)得到黄酮得率。
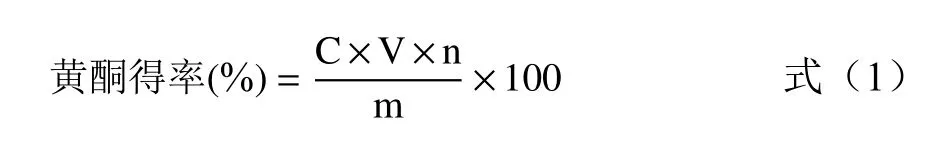
式中:C为样品中黄酮浓度,mg/mL;V为黄酮粗提取液的体积,50 mL;n为稀释倍数,10;m为百香果皮粉末的质量,mg。
1.2.4 单因素实验
1.2.4.1 酶解时间对百香果皮黄酮得率的影响 称取1.00 g预处理后的百香果皮粉末置于50 mL离心管中,固定超声功率240 W、复合酶(纤维素酶和果胶酶复配比为2:1(g/g))用量4%、酶解温度50 ℃、液料比25:1 mL/g,超声时间45 min,改变酶解时间(15、30、45、60、75、90 min)研究其对百香果皮黄酮得率的影响。
1.2.4.2 复合酶的添加量对百香果皮黄酮得率的影响 在1.2.4.1的基础上,固定酶解时间45 min,改变复合酶的用量(1%、2%、3%、4%、5%、6%)研究其对百香果皮黄酮得率的影响。
1.2.4.3 乙醇体积分数对百香果皮黄酮得率的影响
在1.2.4.2的基础上,固定复合酶的添加量4%,改变不同体积分数的乙醇溶液(40%、50%、60%、70%、80%)研究其对百香果皮黄酮得率的影响。
1.2.4.4 料液比对百香果皮黄酮得率的影响 在1.2.4.3的基础上,固定60%的乙醇溶液,改变液料比(15:1、20:1、25:1、30:1、35:1、40:1 mL/g)研究其对百香果皮黄酮得率的影响。
1.2.4.5 超声时间对百香果皮黄酮得率的影响 在1.2.4.4的基础上,固定液料比25:1 mL/g,改变超声时间(25、35、45、55、65 min)研究其对百香果皮黄酮得率的影响。
1.2.5 响应面试验设计 根据Box-Behnken试验设计原理,综合单因素实验结果,选取影响复合酶辅助超声法提取百香果皮黄酮得率的主要因素复合酶添加量(A)、酶解时间(B)、料液比(C)和超声时间(D)作为自变量,以黄酮得率为响应值,利用软件Design-Expert.V8.0.6.1设计四因素三水平的优化试验。因素及水平编码见表1。
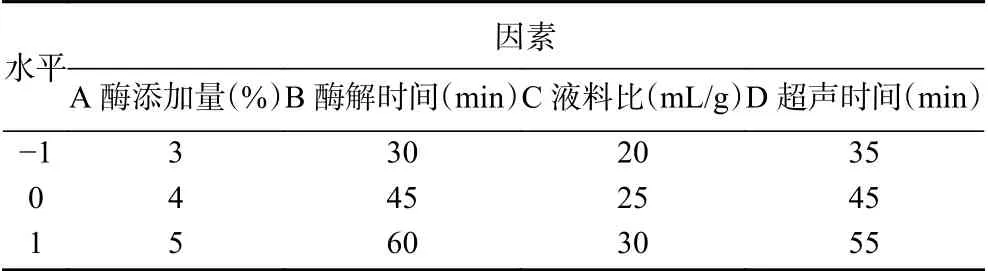
表1 响应面试验因素水平设计Table 1 Box-Behnken test design
1.2.6 百香果皮黄酮抗氧化活性的测定 百香果皮中黄酮抗氧化活性强弱以样品清除率为50%时所对应的浓度(EC50,mg/mL)来判断。
1.2.6.1 DPPH自由基清除率测定 参考张会香等[22]与杨宗玲等[23]的方法,并作修改。在1.2.2实验中得到最优的黄酮粗提取液浓度为44.2 mg/mL。取5支试管,分别加入0.2、0.4、0.6、0.8、1.0 mL百香果皮黄酮粗提取液,用60%的乙醇定容后,即得到浓度依次为0.09、0.18、0.27、0.35、0.44 mg/mL的黄酮粗提取液。再取5支试管,对应移取不同浓度梯度的黄酮粗提取液2 mL,各加入2 mL 7.5 mmol/L的FeSO4,摇匀后,避光反应30 min,在517 nm处测定吸光值AS。取2 mL不同浓度的样品黄酮提取液于试管中,分别向其中加入2 mL的无水乙醇并摇匀,作为对照,在517 nm处测定吸光值AC。再取一支试管,加入2 mL DPPH溶液和2 mL无水乙醇,摇匀并在517 nm处测定吸光值AB,抗坏血酸组为对照。参照公式(2)计算DPPH清除率。
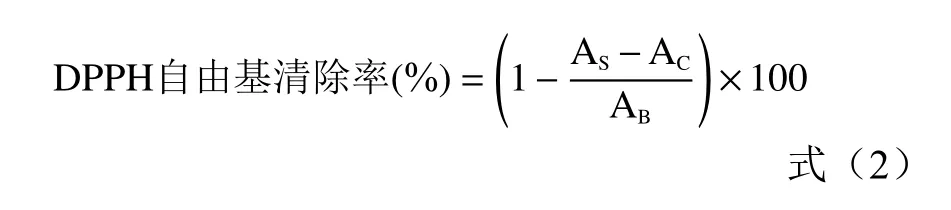
1.2.6.2 OH自由基清除率测定 参考张倩茹[24]的方法,稍作修改。取5支比色管,向每支管中依次加入1.00 mL上述再次稀释10倍后的黄酮粗提取液、9 mmol/L FeSO4溶液1.00 mL以及1.00 mL 8.8 mmol/L H2O2溶液,混匀后静置10 min。最后加入1.00 mL 9 mmol/L水杨酸乙醇溶液,摇匀静置30 min后在510 nm处测吸光值Ai。1.00 mL蒸馏水与1.00 mL 9 mmol/L FeSO4溶液、1.00 mL 8.8 mmol/L H2O2溶液按照上述步骤反应后测吸光值A0。1.00 mL不同浓度梯度的黄酮粗提取液、1.00 mL 8.8 mmol/L H2O2溶液及1.00 mL蒸馏水混匀后按上述步骤反应后测吸光值Aj。OH自由基清除率按照公式(3)计算:
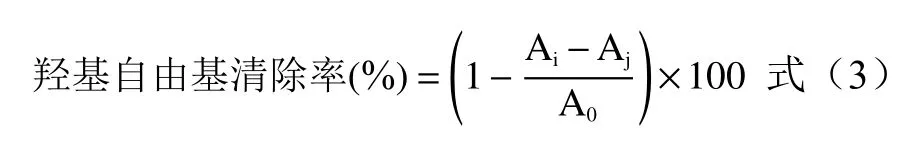
1.3 数据处理
以上处理均做3次平行试验,图表中数据为3次实验数据的平均值。利用软件Design-Expert.V8.0.6.1进行试验设计,软件Origin 8.0对试验数据进行绘图。
2 结果与分析
2.1 芦丁标准曲线的绘制
按照1.2.3.1方法测定吸光值,以芦丁质量浓度为横坐标,吸光值为纵坐标绘制标准曲线,见图1。得到回归方程:y=11.693x-0.0196(R2=0.9966),其中y为吸光值A,x为芦丁浓度(mg/mL)。根据试验结果,芦丁在0.00~0.08 mg/mL的浓度范围内与吸光值有良好的线性关系。
2.2 单因素实验
2.2.1 酶解时间对百香果皮黄酮得率的影响 由图2所示,随着酶解时间的不断增加,黄酮的得率逐渐提高,并在酶解45 min时有最大得率;但是随着酶解时间的继续延长,黄酮的得率不断下降。原因可能是:a.酶解时间较短,复合酶不能将百香果皮的细胞壁完全分解,黄酮物质不能较好的与提取溶剂乙醇接触,提取不完全;b.随着酶解时间的延长,细胞壁酶解充分,黄酮得率随之提高;c.酶解时间过长,产物的积累、酶活性部位发生变化导致酶活降低等现象都会使得酶受到抑制作用,最终使得黄酮得率降低[25]。因此,选择酶解时间为45 min最佳。
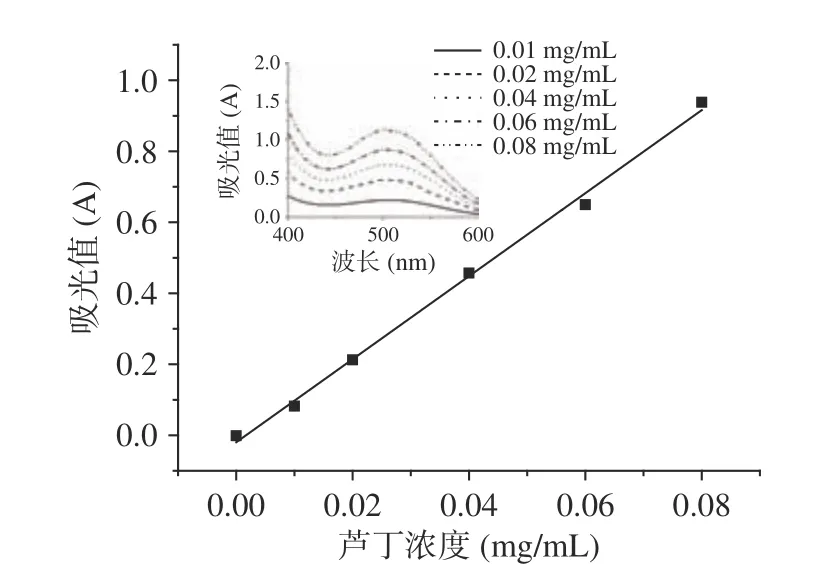
图 1 芦丁标准曲线Fig.1 Rutin standard curve
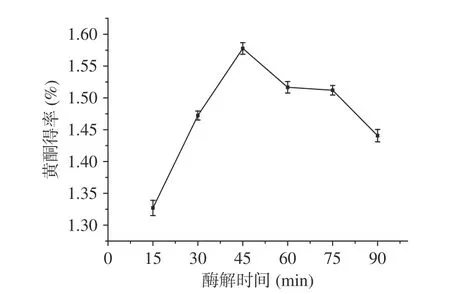
图 2 酶解时间对百香果皮黄酮得率的影响Fig.2 Effect of enzymolysis time on the extraction yield of flavonoids from Passiflora edulis peel
2.2.2 复合酶的添加量对百香果皮黄酮得率的影响图3是复合酶的添加量对百香果皮黄酮得率的影响。应用前期试验结果纤维素酶与果胶酶复配比例为2:1,当其添加量为4%时,百香果皮中黄酮的得率最高。因为百香果皮中含有大量的果胶和纤维素,纤维素酶和果胶酶可以较好分解果皮的细胞壁,使得提取溶剂直接作用于活性物质,有利于黄酮的提取。继续增加酶的添加量时黄酮得率则降低,可能原因为:当复合酶的浓度过高时,酶和部分分解的纤维素会附着在百香果皮粉的表面,阻止黄酮化合物与提取溶剂直接接触,不利于有效成分的溶出[26]。
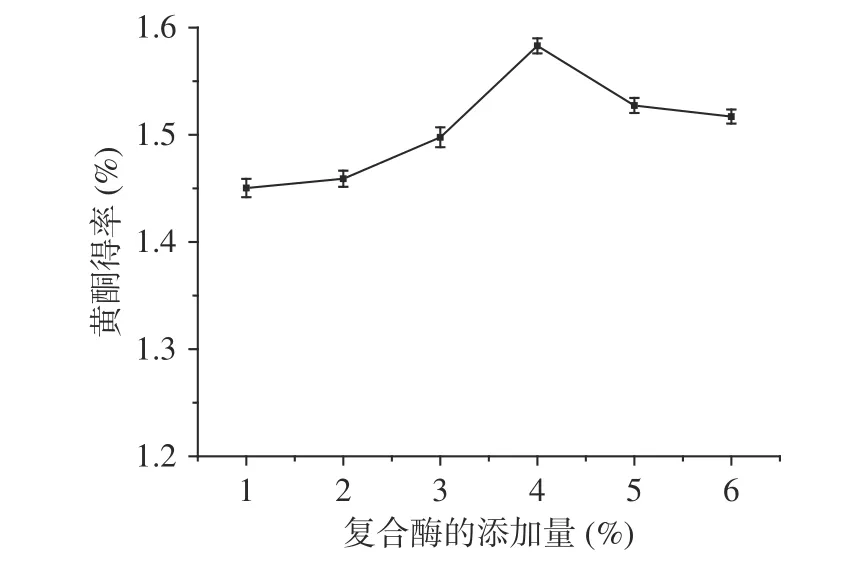
图 3 复合酶的添加量对百香果皮黄酮得率的影响Fig.3 Effect of compound enzyme dosage on the extraction yield of flavonoids from Passiflora edulis peel
2.2.3 乙醇体积分数对百香果皮黄酮得率的影响不同体积分数的乙醇溶液对黄酮得率的影响见图4。从图中可以看出,乙醇体积分数在60%处黄酮得率最高,乙醇浓度在40%~60%之间时,随着乙醇溶液浓度逐渐增大,黄酮得率逐渐提高,但当乙醇的体积分数继续增大时,黄酮得率减少,这可能是因为,百香果皮中黄酮的极性和60%乙醇极性最接近,可以最大程度地溶出黄酮[27],当浓度继续增大时,极性差异增大,可能会引起醇溶性物质的析出,间接导致黄酮得率的下降[17]。因此,乙醇浓度可以设定为60%。
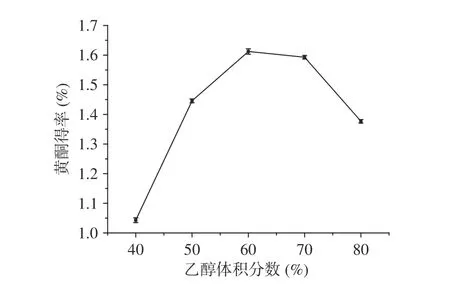
图 4 乙醇体积分数对百香果皮黄酮得率的影响Fig.4 Effect of ethanol concentration on the extraction yield of flavonoids from Passiflora edulis peel
2.2.4 液料比对百香果皮黄酮得率的影响 液料比对百香果皮黄酮得率的影响见图5。当液料比为25:1 mL/g时,百香果果皮黄酮得率最高。液料比在15:1~25:1 mL/g范围内,随着液料比的增大,百香果皮黄酮的得率不断提高。继续增大液料比黄酮的得率降低。原因可能是:加入的溶剂越多,果皮细胞的内外浓度差增大,溶剂的渗透扩散作用增强,溶解的黄酮化合物也就越多;但溶剂量达到一定程度时,溶解黄酮的量达到饱和状态,溶解其他杂质的量变大,从而使得黄酮得率下降[28]。
2.2.5 超声时间对百香果皮黄酮得率的影响 超声时间对百香果皮黄酮得率的影响如图6所示。由图6可知,随着超声时间的延长,百香果皮中黄酮的得率逐渐提高,且在超声45 min时黄酮得率最高为1.960%,之后随超声时间延长,黄酮得率下降。主要原因可能是:在提取黄酮的最开始阶段,溶剂内外存在较大的浓度差,因此随着超声时间的增加,黄酮会迅速进入提取溶剂中,从而提高黄酮得率;但随着超声时间的不断延长,样品中其他醇溶性物质被浸提出来,导致总黄酮得率有所下降[28]。综合考虑到时间和成本问题,最后在响应面优化试验中,选取超声时间为35、45、55 min三水平。
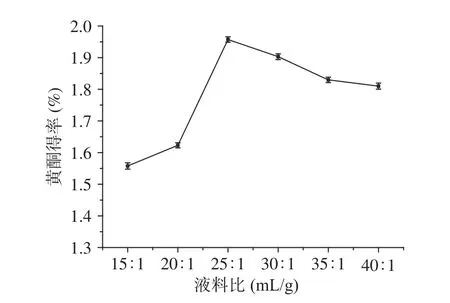
图 5 液料比对百香果皮黄酮得率的影响Fig.5 Effect of liquid-solid ratio on the extraction yield of flavonoids from Passiflora edulis peel
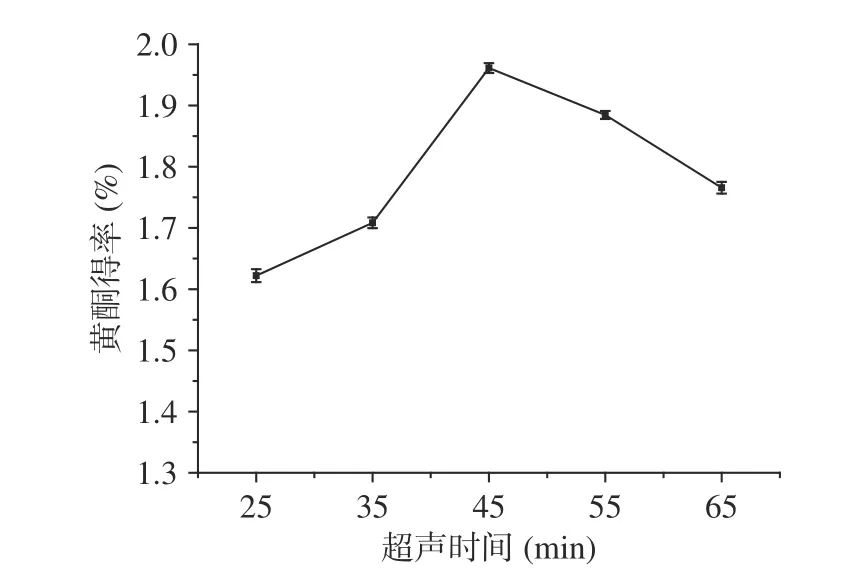
图 6 超声时间对百香果皮黄酮得率的影响Fig.6 Effect of ultrasonic time on the extraction yield of flavonoids from Passiflora edulis peel
2.3 响应面试验
2.3.1 响应面设计结果及回归模型方差分析 根据单因素实验结果,选择因素复合酶添加量(A)、酶解时间(B)、液料比(C)和超声时间(D)为考察对象,百香果皮中黄酮得率(Y)为响应值(表2),采用软件Design-expert 8对实验数据处理后,得到二次多元回归方程:
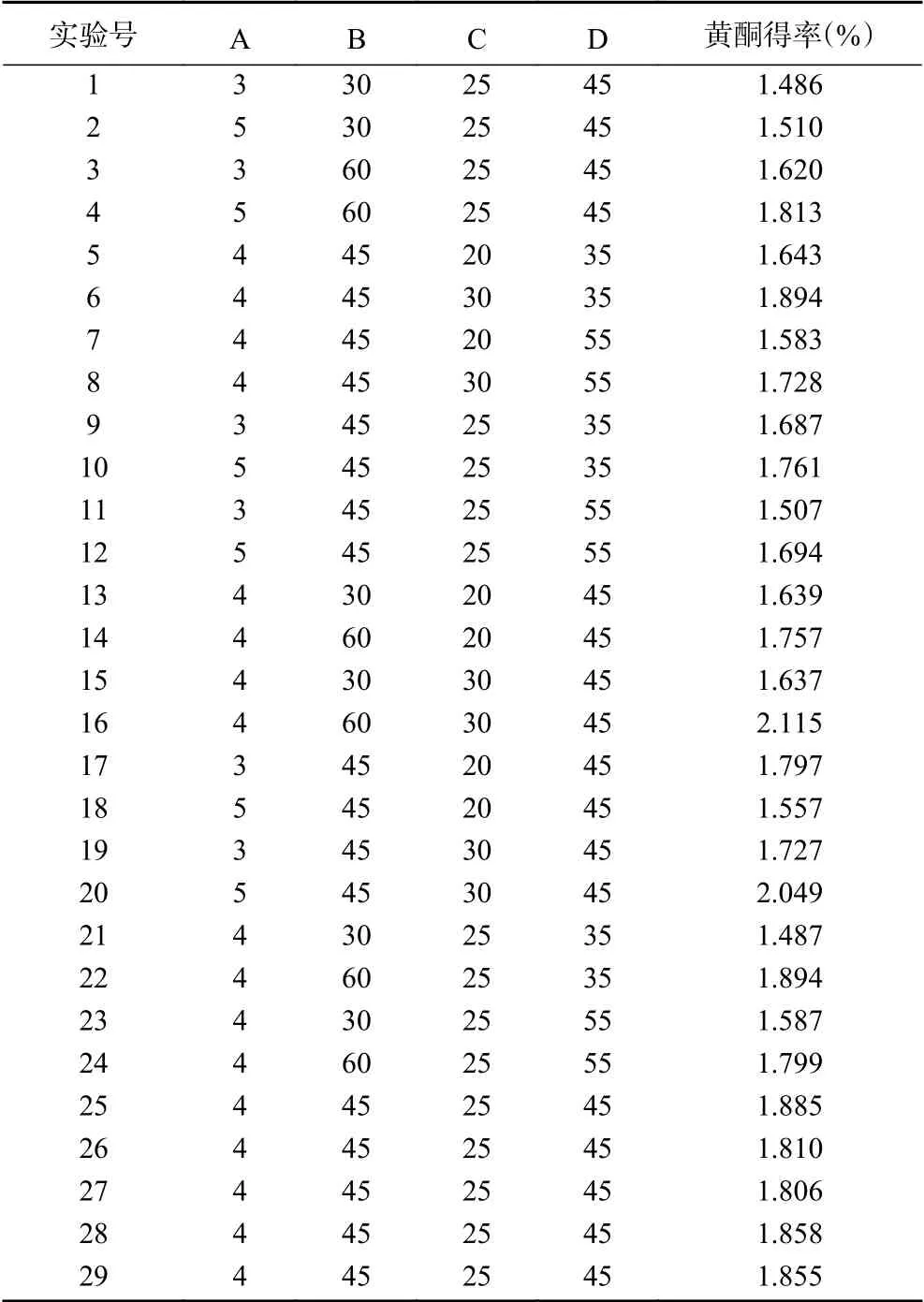
表2 响应面分析试验及结果Table 2 Response results of Box-Behnken design

由表3可知,百香果皮黄酮得率的模型方程F值为12.84,具有显著性(P<0.0001);失拟项差异不显著(P失拟=0.0924>0.05),方程的决定系数R2=0.9278,大于0.8,说明该模型与试验因素拟合较好,可以用来分析和预测百香果皮黄酮提取的工艺条件。各自变量因素对百香果皮黄酮得率的影响情况如下:一次项中酶解时间(B)和液料比(C)对黄酮得率具有极显著的影响,交互项AC、二次项A2、B2、D2对实验结果具有高度显著影响(P<0.01)。F值越大,说明该因素对百香果皮中黄酮得率的影响就越大[26],故所选的四个因素对黄酮得率的影响为:酶解时间(B)>液料比(C)>酶添加量(A)>超声时间(D)。
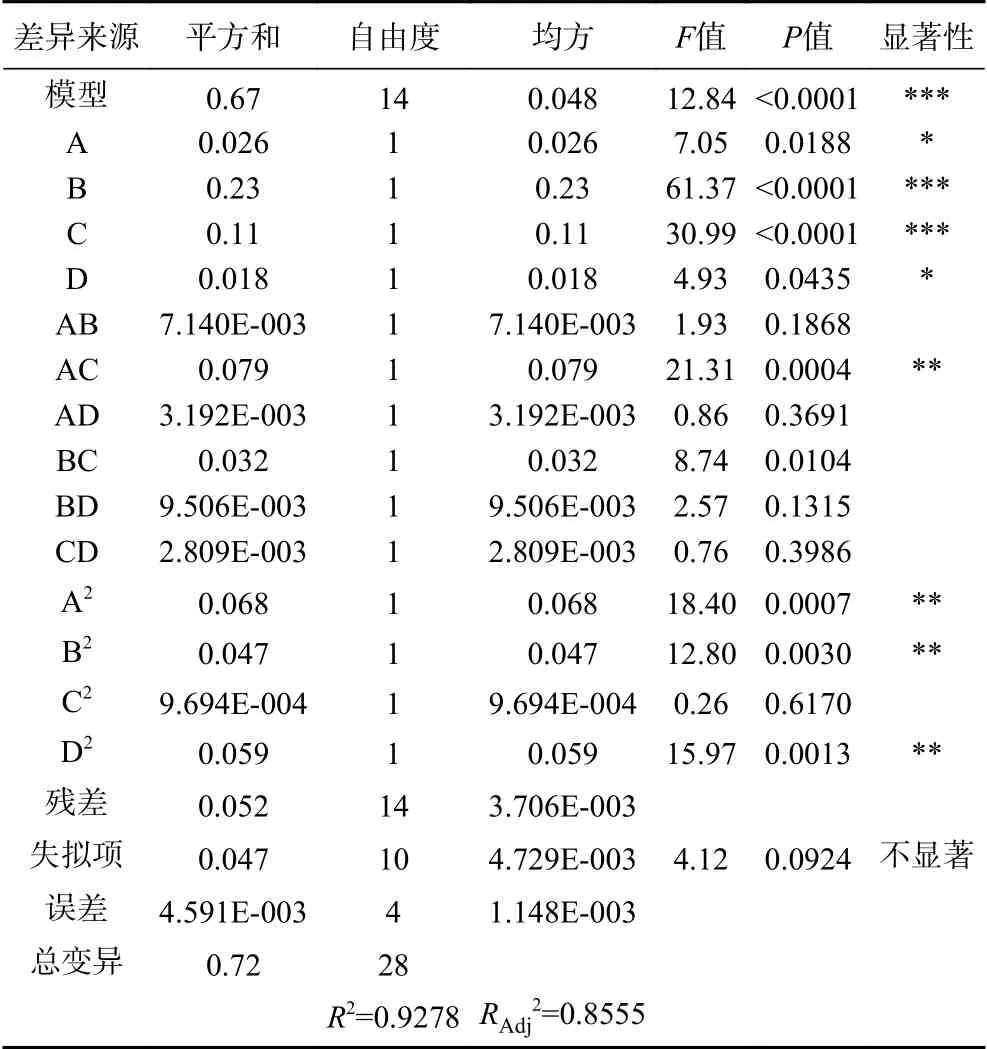
表3 响应面回归模型方差分析Table 3 Analysis of variance of response surface regression model
各因素交互对百香果皮黄酮得率的影响见图7。曲面越陡峭,说明百香果皮黄酮得率对该因素的改变就越敏感,反之,则说明该因素对黄酮得率影响不大;AB、AD、BD的曲面较陡峭等高线呈现椭圆形,说明酶添加量、酶解时间、超声时间交互作用显著[28]。由上图可知,酶添加量与酶解时间(AB)、酶添加量与超声时间(AD)、酶解时间与超声时间(BD)之间的交互作用对百香果皮中黄酮的得率影响显著;AC的响应面曲线具有显著的陡峭曲面,说明该交互作用可以显著地影响百香果皮黄酮的提取效果,与显著性差异结果一致。
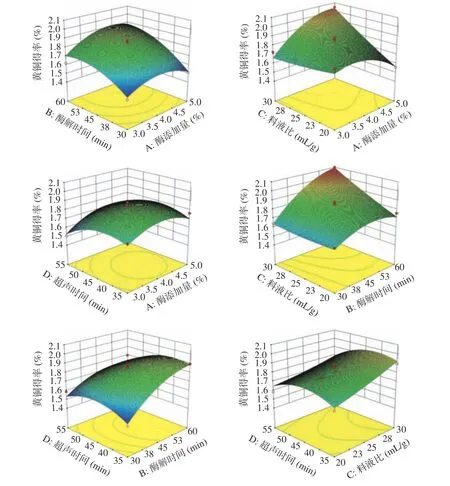
图 7 各因素交互作用对黄酮得率影响的响应面图Fig.7 Surface graph of the effect of interaction on the yield of flavonoids
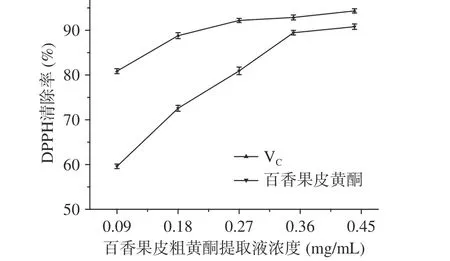
图 8 百香果皮中粗黄酮提取液与VC对DPPH自由基的清除率Fig.8 DPPH free radical scavenging rate by flavonoids from Passiflora edulis peel and VC
为验证响应面试验结果是否可靠,根据得到的优化条件选择酶添加量4.84%、酶解时间60 min、液料比30:1 mL/g、超声时间42.12 min进行提取百香果皮总黄酮,为方便试验,将最佳工艺调整为酶添加量4.8%、酶解时间60 min、料液比30:1 mL/g、超声时间42 min,在此条件下进行3次平行试验以验证该工艺的可行性。结果表明,在所得最佳工艺条件下,百香果皮黄酮得率可达(2.20%±0.05%),此结果与模型预测值2.24%相当(<1%),模型重复性较好,说明该优化的工艺参数具有可靠性。
2.4 百香果皮中黄酮抗氧化活性
2.4.1 清除DPPH自由基能力 图8是百香果皮中的黄酮与VC对DPPH自由基清除率的对照图,从图中可以看出,在0.09~0.44 mg/mL的浓度范围内,随着提取液浓度的增加,DPPH自由基的清除率也在不断提高,当黄酮粗提取液浓度为0.44 mg/mL时,有最大的清除率为90.8%。与相同浓度的抗坏血酸相比较,黄酮的清除率较小于抗坏血酸的清除率,但从数据的趋势来看,最大黄酮浓度时的清除率与抗坏血酸的清除率比较接近。说明了百香果皮中的黄酮粗提取液对DPPH自由基具有较强的抗氧化作用[23]。
2.4.2 清除羟基自由基能力 图9为百香果皮黄酮提取液对羟基自由基的清除率的影响,从图中可以看出,黄酮提取液的浓度不断提高,其对羟基自由基的清除率也逐渐增强,当黄酮粗提取液浓度为44 μg/mL时,有最大的清除率为84.1%。用抗坏血酸做对照,可以看到相同浓度下黄酮粗提取液对羟基自由基的清除效果略低于VC溶液。
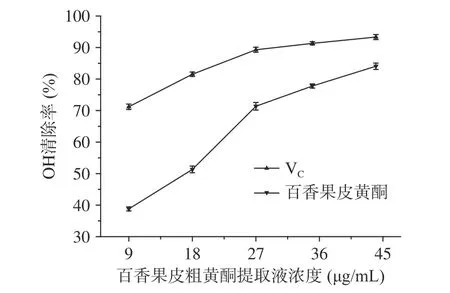
图 9 百香果皮中黄酮与VC对OH自由基的清除率Fig.9 OH free radical scavenging rate by flavonoids from Passiflora edulis peel and VC
3 结论
本文采用复合酶辅助超声波法,设计单因素实验及响应面法优化百香果皮总黄酮的提取工艺,建立了黄酮得率的模拟回归方程,且模型拟合程度较好。得到最佳工艺参数:复合酶(纤维素酶与果胶酶复配比例为2:1)的用量4.8%、酶解时间1 h、乙醇的体积分数60%、液料比30:1 mL/g、超声时间42 min。在此条件下总黄酮得率达到达到(2.20%±0.05%),回归模型的实测值与预测值2.24%(<1%)接近,模型可靠,该结果可为加快百香果皮开发与利用提供一种高效、节能、安全的提取黄酮的工艺参考。
体外抗氧化活性研究表明百香果皮总黄酮具有较高的抗氧化活性,并且其抗氧化能力与浓度呈正向线性关系。当百香果皮中黄酮浓度为0.44 mg/mL时,对DPPH自由基的清除率可达到90.8%;当百香果皮黄酮浓度为44 μg/mL时,对OH自由基的清除率可达到84.1%。试验结果证明了百香果皮中黄酮具有较强的抗氧化能力,是一种理想的天然抗氧化剂。

