α-淀粉酶抑制剂构效关系及应用研究进展
李梦洋,常 远,冯国军,3, ,孙庆申
(1.黑龙江大学农业微生物技术教育部工程研究中心,黑龙江哈尔滨 150500;2.黑龙江大学生命科学学院,黑龙江省普通高等学校分子生物学重点实验室,黑龙江哈尔滨 150080;3.黑龙江大学现代农业与生态环境学院,黑龙江哈尔滨 150080;4.黑龙江大学生命科学学院,黑龙江省普通高等学校微生物重点实验室,黑龙江哈尔滨 150080)
肥胖及其带来的健康危害,包括2型糖尿病、心血管疾病及其代谢综合征,是人们面临的世界性亚健康问题[1]。根据世界卫生组织的统计数据,2型糖尿病患者中有相当数量的人伴有肥胖症或超重的健康问题,2016年全球成年人约有19亿人超重,其中,约6.5亿人为肥胖;2019年约有3820万5岁以下儿童超重,每年至少有280万人死于超重或肥胖[2]。由于肥胖症人数的逐年增加,2型糖尿病的全球患病率在过去几十年中也呈明显上升的趋势[2]。
血糖健康的人群餐后2 h血糖正常值应小于7.8 mmol/L,而2型糖尿病患者往往伴有餐后血糖(即血液中的葡萄糖)值升高的症状。餐后食物中的糖消化成葡萄糖,吸收进入血循环,为血糖的主要来源。这些血糖源自碳水化合物的水解[3],其过程大致为:首先α-淀粉酶(化学名称为α-1,4-葡聚糖-4-葡聚糖水解酶)将食物中的碳水化合物(如淀粉)分解为低聚糖[4],而α-葡萄糖苷酶进一步将这些低聚糖转化为单糖[5]。基于这样的代谢过程,目前治疗肥胖和2型糖尿病的方法之一是使用各种药物来抑制代谢碳水化合物相关酶(包括α-淀粉酶和α-葡萄糖苷酶)的活性[2],从而降低葡萄糖的生成速度,延缓葡萄糖的吸收速率,减缓餐后血糖上升水平[5],进而减少胰岛素分泌,降低脂肪合成,最终降低2型糖尿病发生的几率[4]。
α-淀粉酶抑制剂(α-amylase inhibitor,简称α-AI),也被称为“淀粉阻断剂”或“碳水化合物阻滞剂”,是一类对人胰腺和唾液α-淀粉酶表现出抑制活性的物质,属于糖苷水解酶抑制剂的一种[6]。由于α-AI能有效抑制口腔和胃肠道内唾液及胰淀粉酶的活性,阻碍食物中碳水化合物的水解和消化,因此,在减肥、降血糖、降血脂方面的作用一直备受关注[7-8]。Beidokhti等[9]和Papoutsis等[10]总结了天然化合物中具有α-AI活性的成分,结果显示蛋白质类、多酚类、黄酮类、酚酸类和没食子酸类化合物等均具有抑制α-淀粉酶的活性。毒理学资料显示,该类抑制剂急性毒性(50 mg/kg b.w.)不会影响胰岛素功能[8]。大多数α-AI已从微生物(主要集中在链霉菌属、青霉菌属和放线菌属)、植物(尤其是禾谷作物和豆类作物的种子中)中获得, 也有少数α-AI从哺乳动物中获得[11-12]。
由于α-AI来源广泛,并且在降糖减肥、农业害虫防治等领域都有广泛的应用前景,因此,系统地阐述这类活性物质的来源、分类、作用机制以及应用前景,为这一类产品的深度开发及有目的地应用提供重要的参考,同时也为α-AI这类天然活性物质的深度挖掘指明方向。
1 α-淀粉酶抑制剂的类型、结构及作用机理
目前,天然α-AI已从多种植物、动物以及微生物中获得。不同来源的α-AI总体可分为两类:即蛋白质类α-AI和非蛋白质类α-AI。
1.1 蛋白质类抑制剂
根据序列和三级结构的相似性,自然界发现了七种蛋白质类α-AI,一种来自链霉菌种,其余六种类型均来自高等植物(表1)。目前研究较多的蛋白质类抑制剂是来源于链霉菌属的微生物类型抑制剂坦达司他(Tendamistat)[10],来源于普通菜豆的凝集素样(Lectin-like)抑制剂[11],来源于印度手指小米的谷物类双功能抑制剂RBI(RATI)[12],来源于苋属植物的Knottin型抑制剂[13],以及来源于大麦的库尼茨型(Kunitz type)抑制剂BASI[14]。而对酶-抑制剂复合物的研究主要集中在猪胰α-淀粉酶(PPA)、人胰α-淀粉酶(HPA)和黄粉虫α-淀粉酶(TMA)与蛋白质类抑制剂复合体的结构和作用机理上[7]。

表1 蛋白质类α-淀粉酶抑制剂性质Table 1 Properties of protein-based α-AI
酶-抑制剂复合物的结构主要分为5种不同类型,分别为:库尼茨型抑制剂作用于大麦α-淀粉酶2、坦达司他抑制剂作用于人胰α-淀粉酶、菜豆凝集素样抑制剂作用于人胰α-淀粉酶、苋属植物的打结型抑制剂作用于黄粉虫α-淀粉酶和谷物类双功能抑制剂作用于黄粉虫α-淀粉酶[11]。α-淀粉酶抑制剂与酶的3个催化基团之间的反应方式呈现多样性。抑制剂与酶的催化位点的结合可以通过直接与氢键结合,也可以通过水分子网络结构或水分子的氢键结合。还有一种情况是抑制剂蛋白表面的水化Ca2+连接在抑制剂和酶的催化位点中。5种抑制类型中的两种都是模拟了底物类似性[11]。
1.1.1 来源于链霉菌属的微生物型淀粉酶抑肽 淀粉酶抑肽(Tendamistat)是一种蛋白质,由74个氨基酸组成,通过与α-淀粉酶形成摩尔比为1:1的复合物,能够特异性地抑制哺乳动物的α-淀粉酶,但对植物或微生物α-淀粉酶没有抑制作用。淀粉酶抑肽的二级结构由六个β折叠结构构成,还包含两个二硫键:cys11-cys27和cys45-cys73[15]。二硫键稳定的β转角结构被认为是淀粉酶抑肽与Arg19(来自于该β转角一端的保守的三肽Trp18-Arg19-Tyr20)的酶结合位点,这个β转角结构被认为与抑制机理有关。因此,在与植物凝集素(PPA)的复合体中,β转角催化质子供体中的Glu233OE2和Glu233OE1分别与淀粉酶抑肽Arg19NH1和Arg19NH2形成了较强的静电相互作用[7]。
国外对于微生物产α-AI的研究开展较早。1970年Niwa等人报道,在一种链霉菌培养液中发现了可以抑制α-淀粉酶的抑制剂诺吉利霉素(Nojirimycin)。日本 Narimasa报道了由真菌Cladosporium herbarumF-28(多主枝孢)产生的蛋白类α-AI,打破了传统认为只有放线菌才能产生α-AI的观点,并且此种抑制剂对哺乳动物α-淀粉酶有极高的特异性[16]。国内关于微生物产α-淀粉酶抑制剂的研究最早是在1985年刘华珍[17]从科鲁链霉菌(Str. corchorusii)的菌体分泌物中筛选出一种对猪胰α-淀粉酶有强的抑制作用的α-AI—Paim,经纯化得到分子量为4300和4800 Da的PaimⅠ和PaimⅡ。两者组成中都含有大量的丙氨酸,该抑制剂对猪、狗、牛、马胰α-淀粉酶均有抑制活力,但对人的α-淀粉酶无抑制活力。刘华珍等[18]从福建永春土壤中分离得到能产α-AI的链霉菌82-2-35菌株,命名为天蓝黄链霉菌永春变种。刘英等[19]在1994年对该菌株进行抑制动力学研究,发现该菌株对α-淀粉酶具有竞争性抑制作用,该菌株具有不被蛋白酶酶解而失活的优点。国内研究突出的是河北省科学院生物研究所从链霉菌中获得产生抑制剂菌种S-19-1, 是国内首次从淡紫灰类群中筛选出该抑制剂菌株,并建立了适合S-19-1菌株的发酵工艺,其发酵滤液中的α-AI活性超过70%,小鼠试验表明此抑制剂无任何毒副作用[20]。此后,国内学者陆续从链霉菌菌株PW638的培养液[21]、天蓝黄链霉菌ZG0656的代谢产物[22]、药用植物内生放线菌菌株WS19发酵液[23]、以及链霉菌属(streptomyces sp.CC5)发酵液上清液[24]中获得具有α-AI活性的蛋白组分。因微生物具有培养时间短,发酵及产α-AI条件可优化等优势,在未开α-AI产品开发方面具有很大的优势,但因为一些微生物本身的安全性等因素的存在,这类α-AI在人体降血糖方面的应用还存在一定的距离,需要进一步进行安全性验证。
1.1.2 来源于普通菜豆的凝集素样α-AI 来源于普通菜豆(Phaseolus vulgaris)的凝集素样α-AI有三种不用的亚型:α-AI1、α-AI2和α-AI3(或α-AIL)。α-AI1是一种43 kDa的二聚体糖蛋白(α2β2),为主要的α-AI亚型,与PHA同源,它可抑制哺乳动物和昆虫的α-淀粉酶活性,α-AI1与菜豆的PHA-L结构相同,表现出一种胶状卷曲折叠的形态,与凝集素的不同之处在于α-AI1分别在第15和6个残基的两个延伸环的原聚体背面进行了截断,这些环在α-AI2中缺失,α-AI2也对应于截断的凝集素,但α-AI2仅能抑制昆虫的α-淀粉酶活性。α-AI3是对应于PHA、α-AI1和α-AI2之间的进化中间体,无抑制活性[25]。孙庆申等[14]采用盐溶的方法从黑大紫冠豆角(Phaseolus vulgarisL.)种子中提取出α-AI,对猪胰α-淀粉酶具有抑制作用,IC50值为(27.036±0.235) μg/mL。
α-AI1抑制方式为非竞争性抑制,直接通过氢键和催化残基与酶结合。α-AI1与PPA和TMA形成的复合物的结构分析显示,α-AI1中与酶的长环相互作用的Arg74在HPA和TMA复合物中分别以两种不同的构象存在,说明α-AI1有2个部位与酶的结合是最紧密的[11]。最近通过α-AI与α-淀粉酶的复合物研究显示,哺乳动物α-淀粉酶的柔性环状结构以两种不同的构象存在,具有pH依赖性型环形闭合[20]。
1.1.3 来源于印度手指小米的谷物型双功能抑制剂RBI 来自印度手指小米(ragi)的双功能α-淀粉酶/胰蛋白酶抑制剂简称RBI(E. coracanaGaertneri),属于谷物型(Cereal type)抑制剂家族成员,它是由122个氨基酸和5个二硫键组成的单体,是TMA和PPA的有效抑制剂[25]。
哺乳动物和昆虫的α-淀粉酶的结构由三个结构域组成:结构域A具有一个(β/α)8折叠管,构成催化核心结构域,能够催化三联体Asp197、Glu233和Asp300,也是氯化物的结合位点。结构域B在结构域A和C之间,形成钙结合位点,并通过二硫键与结构域A相连。结构域C呈现一个β片状结构,通过多肽链与结构域A相连,形成一个独立结构域,但功能未知[26]。α-淀粉酶都需要一种必需的Ca2+来维持其结构的完整性,并被Cl-激活。来自结构域A和结构域B的分子参与三个最重要的功能位点:活性位点、钙结合位点和氯结合位点。在RBI-TMA复合物中,抑制剂与α-淀粉酶的活性位点相结合,RBI与结构域A和结构域B的残基相互作用,结构域A和结构域B位于TMA的底物结合位点。在RBI-TMA复合物中,TMA的子位点被RBI残基完全封闭。RBI的抑制作用主要需要N端残基Ser1-Ala11和残基Pro-52-Cys-55组成的靶头状片段,伸入TMA底物结合槽,直接靶向催化残基。尽管抑制剂的残基1-5在RBI溶液结构中是呈弯曲形的,但它们在复合物中采用310-螺旋构象,填充了TMA基底的结合位点[25]。
1.1.4 来源于苋属植物的打结型抑制剂AAI 打结型(Knottin type)α-AI(AAI)存在于苋菜(Amaranthus hypocondriacus)种子中,是一种含有32个氨基酸残基的多肽,有3个二硫键。纯化后的AAI能强烈抑制昆虫幼虫的α-淀粉酶活性,但不抑制蛋白酶和哺乳动物α-淀粉酶。AAI是迄今为止发现的最小的天然蛋白质类α-AI,包括蛋白酶抑制剂南瓜家族成员(1,18,19)和w-共毒素(20,21),它们同时具有三维“结状”特征,因此被划分为Knottin-like protein,这种蛋白质的一级结构与其他已知蛋白质相似性较低[16]。
AAI-TMA复合物的晶体结构分析表明,AAI是结合到TMA的活性位点抑制区,从而阻断中心的四个糖结合亚位点——说明AAI的抑制作用与凝集素样抑制剂一样,是通过AAI残基对底物结合位点的阻断来实现的,这些残基可靶向抑制TMA的活性位点。在AAI与TMA的相互作用中,TMA的催化残基只有Asp287(对应于PPA的Asp300)与抑制剂残基Arg7直接形成盐桥。其他催化残基——亲核试剂和酸性催化剂Asp185和Glu222(分别类似于PPA残基Asp197和Glu233),通过复杂的水介导的氢键网络与抑制剂残基相连。相比之下,在α-AI和RBI对TMA发生抑制作用时,三个催化残基都与抑制剂残基的官能团建立了直接的氢键。将模拟的AAI-PPA复合物与AAI-TMA复合物的X射线结构进行比较,确定了AAI-TMA复合物特有的6个氢键,这导致了AAI抑制剂对昆虫α-淀粉酶高度的抑制特异性[25]。
1.1.5 来源于大麦的库伦玆型抑制剂BASI BASI是一种由181个氨基酸组成的单链蛋白质,属于库伦玆型(Kunitz type)抑制剂家族。BASI与来自其他植物的库伦玆型抑制剂有大约30%的序列同源性,含有两个保守的二硫键。与BASI最接近的同源物来自于小麦(WASI)和水稻(RASI)中,它们的序列同源性分别为92%和58%。大麦α-淀粉酶/枯草杆菌蛋白酶抑制剂(BASI)是一种双功能抑制剂,即枯草杆菌蛋白酶/α-淀粉酶抑制剂,胰蛋白酶/α-淀粉酶抑制剂[7],它可同时作用于来自大麦的α-淀粉酶2(AMY2)和来自枯草杆菌蛋白酶家族的丝氨酸蛋白酶。BASI具有两种功能:控制植物早期发芽过程中淀粉的降解,保护种子免受病原体来源的枯草杆菌蛋白酶型丝氨酸蛋白酶的影响。在AMY2和大麦硫氧还蛋白(HvTrxh2)的复合物中,BASI都表现出β-三叶形拓扑结构[21]。
AMY2-BASI复合物是一种内源性蛋白-蛋白复合物。该复合物的结构揭示了BASI对AMY2的严格特异性,表明AMY2的结构域B对酶抑制剂识别的特异性有很大贡献。与猪胰α-淀粉酶与蛋白抑制剂复合物的三维结构相比,AMY2-BASI结构显示该酶的必需氨基酸催化残基不直接与抑制剂结合。BASI与AMY2结合产生一个空腔,暴露在外部介质中,从而容纳额外的Ca2+。由于活性部位的关键氨基酸侧链与水分子直接接触,而水分子又与Ca2+发生连接,因此这一特性有助于发挥抑制作用[11]。
1.1.6 来源于其他植物的蛋白类淀粉酶抑制剂Poovitha等[27]对两个苦瓜品种(Momordica charantia L.)的蛋白质提取物进行体外α-淀粉酶和α-葡萄糖苷酶抑制活性的研究显示,苦瓜蛋白质提取物对α-淀粉酶抑制活性为66%,与阿卡波糖相当(68%~70%),其抑制方式为竞争性抑制,可显著降低糖尿病大鼠血糖水平。Chen等[28]对小麦面筋蛋白和大豆分离蛋白抑制α-淀粉酶活性进行了对比分析,实验结果表明小麦面筋蛋白比大豆分离蛋白具有更强的抑制α-淀粉酶活性,小麦面筋蛋白中谷蛋白显示出更强的α-淀粉酶抑制作用。
1.2 非蛋白质类抑制剂
1.2.1 多酚类化合物 多酚一般通过与α-淀粉酶分子结合来发挥其抑制活性,二者之间的相互作用力包括氢键(羟基和酶催化活性位点之间)和疏水力(多酚的芳香环和α-淀粉酶的色氨酸残基之间)。因此,多酚对α-淀粉酶的抑制作用与其分子结构密切相关。多酚类化合物至少含有一个或多个羟基的芳香环,根据它们的化学结构可以分为15个大类或小类。最重要的多酚类化合物是酚酸,如羟基酪醇、单宁酸和没食子酸等含一个C6芳香环的酚酸化合物,咖啡酸和香豆酸等含C6-C3结构的羟基肉桂酸化合物,白藜芦醇等含C6-C2-C6结构的二苯乙烯类化合物,C6-C3-C6结构的黄酮类化合物,以及C6-C4-C6结构的木酚素如开环异落叶松树脂酚。多酚中的C=C(或C=O)和芳香环之间的电子离域增强了与α-淀粉酶的疏水(π-π)相互作用[29-31]。
Gomes等[32]对巴西特有树种Terminalia phaeocarpa的叶子提取物进行了α-淀粉酶以及降血糖作用的研究,T. phaeocarpa叶子的乙醇提取物、乙酸乙酯提取物和氢化甲醇提取物组分均对α-淀粉酶具有显著抑制作用,且对猪胰α-淀粉酶的IC50值均显著低于阳性对照阿卡波糖,在体内口服淀粉耐受性实验中这三种提取物可以降低动物血糖,经分析,三种提取物中有38种酚类化合物,主要为酚酸、鞣花单宁和黄酮类化合物。因此,T. phaeocarpa叶子提取物是一种用于治疗2型糖尿病很有前途的药物。
Figueiredo-González等[33]从Myrciaspp.植物叶子中提取了酚类化合物(杨梅素、槲皮素和没食子酸)和黄酮类化合物,对猪胰α-淀粉酶有抑制作用IC50值为6.1 μg/mL,可以作为治疗2型糖尿病的一种潜在有效药物。此外,还有人研究显示沙棘浆果[34]、玉米须[35]、水稻麸皮(Oryza sativaL.)[36]中多酚类化合物[37]以及阿魏酸[38]等都对α-淀粉酶表现抑制作用。以上实例表明不同植物来源的多酚类化合物提取物可以抑制α-淀粉酶活性,可作为一种潜在的天然的糖尿病药物,但是仍需要进行更多的体内外实验来验证其效果和安全性。
Zaharudin等[39]研究了五种红藻和褐藻(马尾藻、海带、裙带菜、棉麒麟菜和卷麻叶)体外抗α-淀粉酶活性,结果显示,海带的甲醇提取物和裙带菜的丙酮提取物对α-淀粉酶的抑制率最高,IC50值低于阿卡波糖。海藻提取物中含有的多酚类化合物(2,5-二羟基苯甲酸)和海藻酸盐是有效的α-AI。但是,基于海藻中还有其他成分,为了证实研究结果的有效性,还需进行人重组酶的体外研究和人类膳食研究。
前人研究显示,影响多酚类化合物与α-淀粉酶作用的主要结构如下:含有一个或多个羟基的芳香环,例如:含一个C6芳香环、含C6-C2-C6结构的二苯乙烯类化合物,C6-C3-C6结构的黄酮类化合物,以及C6-C4-C6结构的木酚素。多酚中的C=C(或C=O)和芳香环之间的电子离域等都不同程度地增强了这些物质与α-淀粉酶的疏水(π-π)相互作用,从而影响了其水解淀粉的能力。
1.2.2 黄酮类化合物 黄酮类化合物是一类丰富的天然酚类化合物,具有多种生物活性[26]。其一级结构由两部分组成:苯并吡喃(A环和C环)和苯基(B环)基团,碳环的变化和苯并吡喃与苯基之间的连接将黄酮类化合物分为六类:黄酮、黄酮醇、黄烷醇、异黄酮、黄烷-3-醇和花青素类[36],如图1所示。这些化合物的活性与其结构有密切的关系,如黄酮类化合物的甲基化和甲氧基化会降低了氢键受体/供体的数量,明显减弱体外对α-淀粉酶的抑制作用[31]。
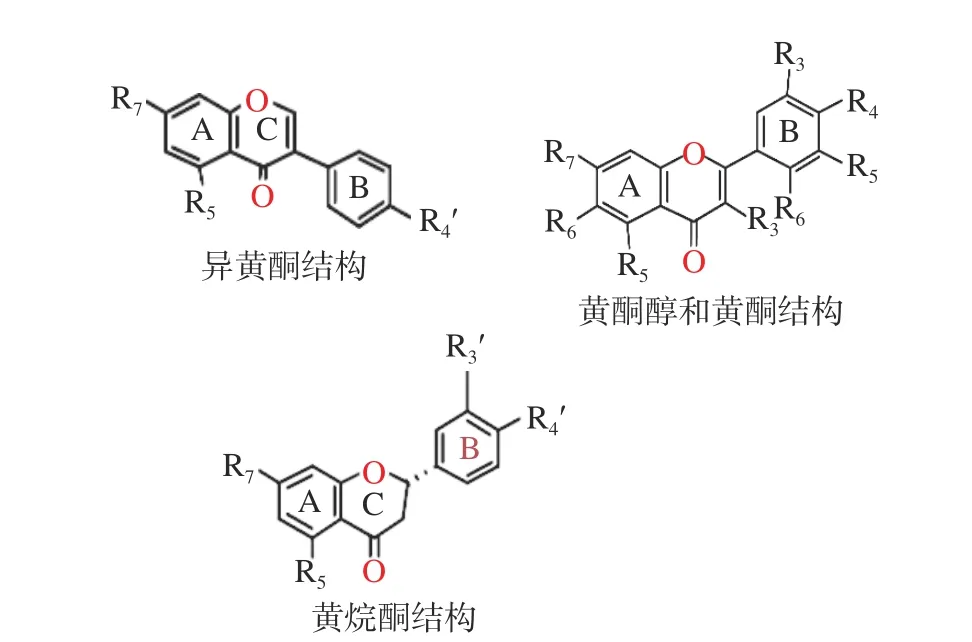
图 1 黄酮类化合物分子结构[30]Fig.1 Molecular structure of flavonoids[30]
而黄酮类化合物的羟基化则提高了体外对α-淀粉酶的抑制作用[31]。黄酮类化合物的羟基(-OH)基团对α-淀粉酶的抑制活性至关重要,因为这种抑制作用可能取决于酚类的-OH基团与α-淀粉酶活性位点的氨基酸侧链(如Asp197和Glu233)之间氢键的形成[30]。4-羟基化、4,5-二羟基化和3,4,5-三羟基化黄酮类化合物在相同黄酮类化合物中的抑制活性比较表明,抑制活性随着B环上羟基数量的增加而明显增加(黄酮醇:杨梅素>槲皮素>山奈酚;黄酮:木犀草素>芹菜素)。A、B、C环的结构与活性有关,B环在3位的连接(染料木黄酮>芹菜素),2,3-双键(异黄酮、黄酮和黄酮醇>黄烷酮和黄烷-3-醇),以及黄酮醇或异黄酮5位羟基化(槲皮素>非瑟素;染料木黄酮>大豆黄酮)增强了抑制活性。如上所述,由于抑制活性随着B环上羟基数目的增加而明显增加,染料木黄酮的3羟基化从而导致比木犀草素有更高的抑制活性,但黄酮3位羟基化不利于抑制活性(木犀草素>槲皮素;芹菜素>山奈酚)[36]。
此外,黄酮类化合物的C2=C3双键的氢化以及黄酮类化合物的糖基化都明显减弱了对α-淀粉酶的体外抑制作用[31]。C环上的2,3-双键也会在一定程度上影响黄酮类化合物的抑制活性,这个双键与4-羰基共轭,增强了环C和环A之间的电子离域。因此,有人提出苯并吡喃酮系统(环A和环C)可以在α-淀粉酶的活性位点与色氨酸的吲哚环形成高度稳定的共轭π-π系统,促进其与α-淀粉酶的结合并降低催化活性[40]。黄酮类化合物的2,3-双键的氢化不仅削弱了共轭作用,而且将近平面的分子结构(黄酮醇和黄酮)转化为更灵活和非平面的立体化学结构(黄烷酮和黄烷醇)[41]。由于空间位阻降低了与α-淀粉酶的结合能力,从而导致黄烷酮和黄烷醇化合物对α-淀粉酶的抑制作用弱于一些黄酮醇和黄酮[30]。Sun等[30]认为抑制活性变化的潜在原因如下:黄酮苷的空间结构从近平面转变为大体积的非平面,由于空间位阻效应限制了进入α-淀粉酶疏水(活性)位点的能力;当羟基被苷取代时,对蛋白质的基团亲和力相应受到影响;因此,类黄酮的糖基化降低了它们与α-淀粉酶的结合亲和力,从而降低了对α-淀粉酶的抑制作用[31]。
Hui等[42]发现蓝莓和黑加仑粉提取物中的酚类化合物可抑制α-葡萄糖苷酶和α-淀粉酶活性。蓝莓和黑加仑中的主要花青素分别为花青色素和飞燕草素,因此,富含花青色素和飞燕草素的食物可能有助于预防和治疗2型糖尿病。Tian等[43]从树莓果实中分离纯化出12种黄酮类化合物,体外α-淀粉酶抑制实验表明这12种黄酮类化合物均有较强的抑制α-淀粉酶活性,其中化合物4:槲皮素-7-O-β-D-吡喃葡萄糖苷(quercetagetin-7-O-β-D-glucopyranoside)对人胰α-淀粉酶抑制活性最强。小鼠体内实验结果与体外酶活性抑制实验结果一致,说明黄酮类化合物可用于调节餐后血糖。Anigboro等[44]研究了Justicia carnea aqueousleaf(JCAE)珊瑚花叶子提取物的体外α-淀粉酶抑制活性的IC50值是阿卡波糖的1/6。GC-MS检测到该叶子水提取物中黄酮类化合物和酚类化合物含量较高,作者建议对该植物进行进一步研究,确定其体内降血糖作用。Quaresma等[45]从银杉叶(Banisteriopsis argyrophyllaleaves)中用乙酸乙酯和正丁醇提取了酚类化合物(儿茶素和花青素)和黄酮类化合物(槲皮素和山奈酚)。Huang等[46]从蒲公英中提取的黄酮类化合物有着比阿卡波糖更高的α-淀粉酶抑制作用。Liu等[47]和Wang等[48]从莲藕叶(Nelumbo nuciferaleaves)中提取的黄酮类化合物均对α-淀粉酶表现出混合抑制作用,经分析荷叶中黄酮类化合物主要为黄酮醇,黄酮醇O-糖苷以及生物碱,在2.5 mg/mL的浓度下,荷叶黄酮类化合物对α-淀粉酶抑制率达到70.28%,但略低于阿卡波糖(85.16%)。
Sales等[38]研究表明Pouteria torta(一种茄科植物)果实的外果皮具有较高的α-淀粉酶抑制能力,当外果皮浓度在0.5 mg/mL时抑制率达到92%,IC50值为0.0736 mg/mL,可用于控制2型糖尿病饮食。经过HPLC定性分析,Pouteria torta植物中已鉴定出几种三萜类化合物和黄酮类化合物,外果皮经过乙酸乙酯提取后,含有表儿茶素、儿茶素、蔗糖、葡萄糖和果糖的馏分Ⅳ中对α-淀粉酶的抑制能力大于阿卡波糖。Kwon等[49]研究了四种不同茄子品种的不同部位的水提取物对α-葡萄糖苷酶和α-淀粉酶抑制活性,结果显示茄子肉提取物对α-葡萄糖苷酶和α-淀粉酶的抑制活性显著高于茄子皮提取物。茄子中含有的大量生物碱——东莨菪素,是对两种酶产生抑制作用的主要成分。关于生物碱的抑制α-淀粉酶活性,Hyuk等[50]进行了东莨菪素体外和体内减轻小鼠餐后高血糖实验,实验结果显示此生物碱抑制活性高于阿卡波糖,在服用剂量为10 mg/kg b.w.时可有效改善进餐后小鼠高血糖水平。Rasouli等[51]指出目前一些生物碱药物已经进入临床实验中,因此,在未来进行体内和体外的研究是有必要的。Ochieng等[52]从Zanthoxylum chalybeumEngl.根皮中提取了八种生物碱类化合物对α-淀粉酶有抑制作用,可以作为治疗2型糖尿病的一种潜在有效药物。Agatonovic-Kustrin等[53]对地中海饮食中常见的几种新鲜草药作为α-AI来源进行了研究,实验结果显示罗勒、牛至、迷迭香、鼠尾草和百里香的乙酸乙酯提取物均对α-淀粉酶有抑制作用,这五种提取物中的五环三萜类化合物——齐墩果酸为α-AI活性成分,因此传统香料植物可作为药物开发中一种有效的候选原料。以上实例初步证实来源于水果、蔬菜及香料等植物的黄酮类化合物在体外均对α-淀粉酶具有抑制作用,同时黄酮类化合物抑制作用与其分子结构相关:黄酮类化合物羟基化可对α-淀粉酶具有抑制作用;而甲基化和甲氧基化则明显减弱了该抑制作用;与4-羟基结合的不饱和2,3键的存在会增强其抑制作用;黄酮类化合物的C2=C3双键的氢化以及黄酮类化合物的糖基化都会明显减弱其对α-淀粉酶的体外抑制作用。
1.2.3 酚酸 酚酸是一种重要的多酚类物质,是具有羧酸官能团的植物次生代谢产物芳香酚(图2),它们广泛分布于整个植物界。天然植物酚酸主要包含羟基肉桂酸和羟基苯甲酸。虽然这些物质基本结构保持不变,但芳环上的取代基(羟基和甲氧基)会改变分子的结构性质,如极性、稳定性和结合性[30]。

图 2 酚酸的分子结构[30]Fig.2 Molecular structure of the phenolic acid[30]
羟基肉桂酸分子结构中的C=C双键与羰基共轭,负责丙烯酸和苯环部分之间的电子转移。因此,羟基肉桂酸可以形成高度共轭的体系,当结合到α-淀粉酶的活性位点时,形成稳定的结构。因此,共轭结构特征和多个羟基是羟基肉桂酸抑制α-淀粉酶的必要条件[30]。
绿原酸广泛分布于绿色咖啡豆中,包括三大类:咖啡酰奎宁酸、二咖啡酰奎宁酸和阿魏酸。它们能够发挥有效抑制作用的潜在原因是:二咖啡酰基提供了更多的羟基,由于羟基和活性催化位点之间形成氢键,实现了其抑制作用;与咖啡酰奎宁酸相比,二咖啡酰奎宁酸中有羰基、C=C双键和苯环。因此,二咖啡酰分子更富电子,具有p-π(双键和苯之间)和π-π(羰基和双键)共轭体系,导致与Trp59吲哚环的潜在更强的π相互作用[30]。
单宁酸(TA)是高等植物中常见的一类次生代谢产物。标准TA的化学结构是十没食子酰葡萄糖,但实际上它是一种聚没食子酰基葡萄糖或聚没食子酰基奎尼酸酯的混合物,每个分子含有2~12个没食子酰基。有研究报道TA在体外对α-淀粉酶有抑制作用,对猪胰α-淀粉酶的IC50值为0.301 mg/mL。由于酚酸质子的pKa在4~5之间,使其水溶液呈酸性(pH<7.0),因此,α-淀粉酶在体外的催化活性会因pH而受到部分抑制。另一方面,TA在体内抑制α-淀粉酶的能力可能会因为TA被胃内的氧和氧自由基氧化,或TA在到达小肠前与食物中存在的蛋白质相互作用或结合而丧失。口服TA会由于与口腔内唾液蛋白相互作用而引起涩味和苦味,因此目前正研究利用微胶囊包埋技术将TA包埋起来,并通过控制其释放来改善在胃肠道中的抑制作用[30]。
1.2.4 没食子酸 没食子酸的酰基是多酚类化合物特别是茶多酚的常见取代基。儿茶素(C)、表儿茶素(EC)、表没食子儿茶素(EGC)、表没食子儿茶素没食子酸酯(EGCG)、表儿茶素没食子酸酯(ECG)、茶黄素(TF)、茶黄素-3′-没食子酸酯(TF1)、茶黄素-3,3′-二没食子酸酯(TF2)是绿茶、乌龙茶或红茶水提取物中的主要多酚成分[30]。
Tadera等[36]比较了C、EC、EGC和EGCG对人胰腺α-淀粉酶的抑制作用,抑制作用测定结果为:EGCG>EC>EGC>C。Hara等[54]发现抑制作用的顺序为TF2>TF1>CG >ECG>EGCG。这些数据说明没食子酰化的儿茶素比非没食子酰化的儿茶素具有更高的淀粉酶抑制作用。D’costa等[55]对类黄酮的淀粉酶抑制反应进行了动力学分析,结果表明ECG和EGCG与HSA和PPA结合非常迅速,EGCG对HSA和PPA的抑制率最高。这种抑制能力可能与类黄酮化合物通过外周羟基和酶的催化残基之间的氢键以及协同共轭π堆积与α-淀粉酶结合到活性位点的能力有关,含有没食子酰基的儿茶素比不含没食子酰基的儿茶素具有更高的抑制作用。
Bernal等[56]以酸浆属果的黏性渗出液中提取的三种蔗糖酯作为α-淀粉酶抑制剂活性展开研究,发现其中peruvioses D对α-淀粉酶的抑制活性最高且显著高于阿卡波糖的抑制活性,后续会评估其对小鼠降低血糖作用的研究,这是第一个以蔗糖酯作为a-AI的研究报道。Tundis等[57]对两个不同生长阶段(成熟和未成熟)收获的四个不同辣椒品种进行了体外抑制α-淀粉酶和α-葡萄糖苷酶活性的分析,发现未成熟期收获的辣椒α-淀粉酶和α-葡萄糖苷酶抑制活性最高;且辣椒提取物中的脂肪酸(肉豆蔻酸、硬脂酸甲酯和亚油酸甲酯)、类黄酮(木犀草素)和辣椒素是抑制α-淀粉酶活性的主要成分。Cansigno等[58]对从墨西哥海岸采集的褐藻、红藻和绿藻等31种植物的45种粗提物的体外α-淀粉酶和α-葡萄糖苷酶抑制活性进行了检测,结果表明,绿藻门和红藻门粗提物对酶的抑制率在10%~25%之间,墨西哥热带海藻的甲醇提取物比阿卡波糖更有效地延迟碳水化合物的吸收,提取物中的脂肪酸、萜类和多酚类化合物是抑制两种酶的关键成分。Daoudi等[59]对摩洛哥一种专有的树种Argania spinosa进行研究,该树种的果实籽油对α-淀粉酶具有非竞争性抑制作用,且未焙烤的种子相比于焙烤具有更高的α-淀粉酶抑制活性,IC50值为(0.78±0.16)mg/mL,抑制率为69.28%,与阿卡波糖相当。给糖尿病大鼠口服2 mg/mL剂量时可以显著减弱由蔗糖和淀粉诱导的高血糖症,该实验结果意味着这种天然果实籽油比其它油脂更能抑制α-淀粉酶的活性。以上实例说明,多种植物来源的多种化合物(蔗糖酯、辣椒素、脂肪酸和天然果实籽油等)均具有体外抑制α-淀粉酶的活性,可用于2型糖尿病患者的日常饮食组分以达到控制血糖的辅助作用,但这些化合物的体内抑制活性和作为药物应用的研究仍需进一步进行验证。
1.2.5 其他来源的淀粉酶抑制剂 Ogasawara等[60]报道蚯蚓(Eisenia fetida)提取物中分子量小于3 kDa(U3EE)的组分能够抑制猪胰α-淀粉酶(PPA)活性,经分析该抑制剂成分为鸟嘌呤、肌苷和鸟苷,抑制活性大小为鸟嘌呤>鸟苷>肌苷,它们抑制PPA的活性与黄酮类化合物相当。这是第一篇报道含嘌呤环化合物能够显示出有效抑制PPA抑制活性的文章,也为U3EE作为预防和治疗糖尿病、肥胖症奠定了理论依据。
龙楚媚等[61]从广西罗汉果植株根中分离出10株内生菌,并从中筛选出2株α-淀粉酶抑制活性最高的菌株PD-3和PD-4,这两株菌的发酵液分别经正丁醇和乙酸乙酯萃取后,1 mg/mL PD-3正丁醇提取物α-淀粉酶抑制率为74.19%,PD-4乙酸乙酯提取物α-淀粉酶抑制率为88.46%,均高于阿卡波糖(45.17%)。PD-3菌株中含有多糖、黄酮类化合物,PD-4菌株种含有糖类、多酚类化合物和醌类化合物,具体哪种化学成分起到降糖作用有待进一步的研究。
上面列举了近年来国内外分别从植物、动物和微生物来源的α-AI,从以上的研究结果可以发现,多酚类化合物和蛋白质类化合物对α-淀粉酶抑制活性较强。其中,有的进行了体内外酶活实验,有的仅仅在体外验证了酶活,因此,天然提取物充当α-AI作为2型糖尿病患者食品补充剂还需进一步的体内实验进行研究,也需要更多实验人员的探索。
2 α-淀粉酶抑制剂的应用
2.1 疾病防治方面
2.1.1 作为天然降糖药物 2型糖尿病是因胰岛素分泌缺陷或其生物学作用受损而引起的糖、脂肪和蛋白质代谢紊乱。随着人们生活水平的提高,营养过剩、体力劳动减轻导致肥胖及患2型糖尿病的人数逐渐上升,长期高血糖会导致严重的糖尿病并发症,例如眼、肾功能和心脏等方面的功能损害。α-AI能够抑制体内唾液腺和胰腺分泌的α-淀粉酶的活性,从而减缓人体内碳水化合物的水解,起到降血糖、减肥的目的。
在治疗2型糖尿病方面,市场上常用的药物有阿卡波糖、米格列醇和伏格列糖,它们既是α-淀粉酶的抑制剂,也是α-葡萄糖苷酶的抑制剂,具有一定的降糖效果[14]。但这类药物往往会伴有肠胀气等副作用,因此从天然植物中提取的α-AI受到越来越多的重视。目前,国内外虽然对α-AI研究很多,但是绝大多数研究成果都处于实验室阶段,上市销售的α-AI的产品很少。杨宁等[62]对16名受试者餐前服用含有α-AI的白芸豆提取物,结果发现该提取物对餐后血糖具有改善作用,而其它具有α-淀粉酶抑制作用的多酚类化合物、黄酮类化合物以及生物碱等化合物还未应用于药品、天然食品中。叶小萍等[63]则在传统中药中提取出α-AI并用于医药研制方面。有报道称,α-AI 的应用有利于肠道有益菌群的生存,也可达到预防及治疗骨质疏松的效果[64]。因此开发利用α-AI 在降糖及减脂的领域具有广阔的应用前景。
这些化合物在体内的抑制作用还有待进一步的研究,对于天然植物来源的α-AI的开发和临床应用还需要更多实验人员的探索。
2.1.2 作为天然降糖食品 以α-AI作为主要成分的天然减肥降糖产品已得到应用,在北美和日本以白芸豆中提取的α-AI为主要原料的减肥、保健食品十分风靡[8]。市场上出现的用于减肥、降血糖和健康食品的α-AI产品制备原料仅限于来自北美的白芸豆[11]。在我国含有α-AI的天然食品已经上市,例如陕西博林生物生产的白芸豆粉、山东朱氏药业生产的白芸豆压片糖果以及河南百芝堂药业生产的白芸豆膳食代餐片。它们的作用原理是通过控制消化道内糖代谢关键酶的活性,达到减脂的目的[64]。Shi等[65]将富含α-AI的白豆提取物应用到高脂饮食诱导的肥胖大鼠中,证实其具有抗肥胖作用。
2.2 农业生产及植物保护方面
高等植物中天然存在的α-AI可以发挥抗虫作用,是植物自我保护机制之一。α-AI蛋白被昆虫食用后能抑制昆虫消化道内的α-淀粉酶活性,使淀粉及其他碳水化合物难以消化,从而阻断昆虫主要的能量来源;同时,抑制淀粉酶活性形成的复合物对昆虫消化道也是一种刺激,会引起昆虫厌食反应,导致昆虫发育不良或死亡,从而起到抗虫效果[66]。Gonzalez等[67]从不同的小麦品种中提取的α-AI可抑制小麦中谷蠹及后代的生长。Rani等[68]从当地常见的豆类品种提取的α-AI可保护谷物储藏过程中害虫的破坏。Gadge等[69]从木豆种子中提取了一种双功能α-淀粉酶/胰蛋白酶抑制剂,经体外和体内研究该抑制剂通过损害消化影响棉铃虫生理。Pereira等[70]从菜豆子叶中分离出一个编码α-AI的基因,命名为aAIPc1,通过PCR扩增、酶联免疫吸附试验以及免疫印迹分析证实了aAI-Pc1基因有可能被导入咖啡植株中并表达编码的蛋白质,以提高其对咖啡浆果蛀虫的抗性。经证实该基因具有控制咖啡浆果蛀虫的潜力。
昆虫淀粉酶的抑制剂在国内尚属新的研究领域,还有待全面和深入地开展。随着现代生物技术的不断发展,生物化学和酶学基础研究的进一步深入,昆虫淀粉酶抑制剂的研究将在现有的基础上向更宽、更广、更深、更快方向发展,从而推动全球农业的发展,为农业产量的提高提供一条崭新而有效的途径[71]。
3 结语
α-AI产品有利于减缓2型糖尿病患者餐后血糖升高症,是目前治疗2型糖尿病和减肥的较为安全的一类物质,还可减少糖向脂肪转化,增加脂肪消耗从而减轻体重。它来源广泛,目前国内外研究人员已从多种天然植物、动物和微生物中提取分离出多种化合物,分别为蛋白质类和非蛋白质类α-AI,均有抑制α-淀粉酶的效果。α-AI在医药方面可作为控制2型糖尿病患者的餐后血糖的升高以及达到减脂的作用,在农业方面可作为抗虫基因,也可作为生物防腐使植物免受害虫的侵蚀。α-AI的来源及应用效果可在未来的研究中得到更多的发现,应用前景广阔。

