褐藻胶寡糖对D-半乳糖诱导的衰老模型小鼠肝脏损伤的保护作用及其机制
陈茗 冯文静 胡松 刘佳 王珊 毛拥军
(青岛大学附属医院老年医学科,山东 青岛 266071)
肝脏衰老可使肝脏损伤的风险增加,导致肝脏功能受损,促进多种慢性肝病的进程[1-2]。作为促进肝脏衰老的主要机制之一,氧化应激可以显著上调肝脏组织中p53以及p21的表达,进而抑制细胞周期,影响肝脏的正常功能[3-5]。核因子E2相关因子2(Nrf2)作为调节组织细胞抗氧化功能的关键信号分子,通过调节下游血红素氧化酶-1 (HO-1)的水平,从而达到抑制氧化应激的目的[6]。研究表明,D-半乳糖(D-gal)通过增强组织细胞中的氧化应激反应,进而诱导机体发生衰老[7]。D-gal诱导的衰老动物模型已被广泛用于天然化合物对氧化应激损伤的治疗作用和机制的研究[8-10]。
褐藻酸盐是一种从海藻中提取的天然多糖。褐藻胶寡糖(AOS)由褐藻酸盐解聚而成,具有水溶性、无毒、无免疫原性和可生物降解等多种特性,而且具有较高的生物活性和药理活性,具有神经保护、抗氧化、抗炎、抗肿瘤、抗菌和免疫调节等作用[11-13]。目前关于衰老对促进肝脏损伤的影响及机制研究有限,明确衰老驱动的肝脏损伤的潜在机制并寻找有效的治疗策略是当今研究的热点。本研究探讨了AOS对D-gal诱导的衰老模型小鼠肝脏损伤的保护作用及可能的分子机制,为年龄相关性肝脏损伤的防治提供新的思路。
1 材料与方法
1.1 实验材料
1.1.1实验动物 健康雄性C57BL/6J小鼠32只,6~8周龄,购自北京维通利华实验动物有限公司,饲养于青岛大学医学部SPF级动物实验中心,温度(21±2)℃,相对湿度(50±10)%,12-12 h昼夜循环环境。
1.1.2实验药物与试剂 D-gal购自美国Sigma公司,AOS于青岛博智汇力生物技术有限公司获得。ALT、AST试剂盒购自南京建成生物科技有限公司,实时荧光定量PCR(RT-qPCR)相关引物购自北京睿博兴科生物技术有限公司,p21抗体购买于爱必信(上海)生物科技有限公司,gp91 phox和p67 phox抗体购自美国Santa Cruz公司,SOD1抗体购自英国abcam公司,GAPDH、山羊抗兔和山羊抗鼠二抗购自武汉Elabscience公司。
1.2 实验方法
1.2.1动物分组及处理C57BL/6J小鼠适应性饲养1周后,随机分为对照组(A组)、AOS组(B组)、D-gal组(C组)以及D-gal+AOS组(D组),每组各8只小鼠。C组和D组小鼠连续每天颈背部皮下注射D-gal 200 mg/kg,连续8周从而建立小鼠肝脏衰老模型,A组和B组小鼠相同部位注射等剂量的生理盐水;B组和D组小鼠于第5周开始每天以AOS(200 mg/kg)灌胃处理,连续4周,其余各组以等量生理盐水灌胃处理。
1.2.2肝脏功能测定 干预结束后使用吸入性麻醉剂异氟烷麻醉小鼠,通过眼眶静脉收集小鼠血液, 4 ℃下以2 500 r/min离心20 min后,收集血清于-80 ℃保存备用,根据试剂盒说明书要求的步骤分别检测小鼠血清中ALT、AST的水平。实验重复3次,结果取均值。
1.2.3Western blot方法检测小鼠肝脏组织之中衰老蛋白p21、还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)的氧化酶亚基gp91 phox、p67 phox和超氧化物歧化酶1(SOD1)蛋白水平 收集血液后处死小鼠,取各组小鼠肝脏组织并加入含有蛋白酶抑制剂RIPA裂解液,匀浆后4 ℃下以12 000 r/min离心20 min,收集含有总蛋白的上清液。蛋白样品通过凝胶电泳进行分离,电泳完成后转移到聚偏氟乙烯(PVDF)膜上,并使用脱脂牛奶于室温下封闭1.5 h,TBST洗膜3次,每次10 min,分别加入相应的一抗,4 ℃下孵育过夜,TBST再次洗膜3次,室温下使用二抗孵育1.5 h,TBST洗膜后通过ECL显影液进行曝光。蛋白条带成像后使用Image J软件分析灰度值,以GAPDH蛋白作为内参照,计算各蛋白的相对表达水平。实验重复3次,结果取3次实验的均值。
1.2.4RT-qPCR方法检测小鼠肝脏组织中Nrf2、HO-1 mRNA的表达 取适量的各组小鼠肝脏组织并加入Trizol提取总RNA,使用紫外分光光度计测定RNA浓度,用逆转录试剂盒逆转录为cDNA。分别取各组的cDNA样本和Nrf2、HO-1的上、下游引物按照RT-qPCR试剂盒说明书要求的步骤进行RT-qPCR检测。结果通过2-△△CT法计算各目的基因的相对表达量。实验重复3次,结果取均值。引物序列见表1。

表1 引物名称及其序列Tab.1 Primer names and sequences
1.3 统计学分析
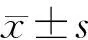
2 结 果
2.1 AOS对D-gal诱导的衰老模型小鼠血清中ALT和AST表达水平的影响
析因设计方差分析结果显示,AOS干预、D-gal诱导以及AOS和D-gal交互作用均对小鼠血清中ALT和AST的水平具有明显影响(FAOS=13.06、13.12,FD-gal=136.82、93.40,FAOS*D-gal=8.03、7.56,P<0.05)。单独效应分析显示,AOS干预和不干预时,D-gal对小鼠血清中ALT和AST的水平均有影响(F=23.92~105.58,P<0.05)。D-gal干预时,AOS的单独效应显著(F=20.29、20.78,P<0.05);无D-gal干预时,AOS的单独效应不显著(P>0.05)。结果见表2。
2.2 AOS对D-gal诱导的衰老模型小鼠肝脏组织中衰老相关蛋白p21、NADPH氧化酶亚基gp91 phox、p67 phox表达的影响
析因设计的方差分析结果显示,AOS干预对小鼠肝脏组织中p21和gp91 phox的表达均有影响(FAOS=67.34、41.85,P<0.05),对于p67 phox表达则无明显影响(P>0.05)。D-gal诱导及AOS和D-gal交互作用对小鼠肝脏组织中p21、gp91 phox和p67 phox的表达有明显的影响(FD-gal=60.22~1 053.16,FAOS*D-gal=14.35~85.13,P<0.05)。单独效应分析显示,AOS干预和不干预时,D-gal对小鼠肝脏组织中p21、gp91 phox和p67 phox的表达均有影响(F=174.80~836.38,P<0.05)。D-gal干预时,AOS的单独效应显著(F=12.28~138.67,P<0.05);无D-gal干预时,AOS的单独效应不显著(P>0.05)。结果见表2。
2.3 AOS对D-gal诱导的衰老模型小鼠肝脏组织中Nrf2、HO-1 mRNA和SOD1蛋白表达的影响
析因设计方差分析结果显示,AOS干预、D-gal诱导及AOS和D-gal交互作用对小鼠肝脏组织中SOD1及Nrf2、HO-1 mRNA的水平均有明显影响(FAOS=8.82~19.78,FD-gal=12.25~435.92,FAOS*D-gal=12.60~44.78,P<0.05)。单独效应分析显示,AOS干预和不干预时,D-gal对小鼠肝脏组织中Nrf2和HO-1 mRNA的表达水平均有明显影响(F=70.00~380.07,P>0.05);D-gal干预时,AOS的单独效应较显著(F=62.04、253.34,P<0.05);无D-gal干预时,AOS的单独效应不显著(P>0.05)。小鼠肝脏组织中抗氧化酶SOD1结果单独效应分析显示,AOS干预时,D-gal的单独效应不显著(P>0.05);无AOS干预时,D-gal的单独效应显著(F=24.85,P<0.05);D-gal干预时,AOS的单独效应显著(F=21.26,P<0.05),无D-gal干预时,AOS的单独效应不显著(P>0.05)。结果详见表2。

表2 AOS对D-gal诱导的衰老模型小鼠血清中ALT和AST水平及肝脏功能的影响Tab.2 Effect of AOS on the serum levels of ALT and AST and liver function in a mouse model of D-gal-induced senescence
3 讨 论
衰老是机体正常的生理过程,也是多种疾病发生发展的重要危险因素,机体衰老伴随着维持氧化平衡稳态能力的降低[14]。氧化应激是肝脏损伤的主要危险因素之一。正常情况下,机体通过各种抗氧化酶清除细胞内过量的活性氧簇(ROS),维持氧化还原平衡,使组织免受氧化应激的损伤,但衰老机体清除细胞内ROS的能力明显降低,机体氧化应激水平升高,氧化/抗氧化系统失衡会损害组织器官功能,促进衰老和疾病的发生与发展[15-17]。
研究发现,长期注射D-gal会导致机体发生严重的氧化应激反应,因此被广泛用于动物衰老模型的制备[18-19]。D-gal通过破坏肝细胞结构,使其发生坏死裂解。本研究结果显示,D-gal诱导的衰老模型小鼠血清中ALT、AST的水平明显升高,表明D-gal严重损害了小鼠肝功能;而AOS干预显著降低了小鼠血清中ALT和AST的水平,据此我们推断AOS对D-gal诱导的衰老模型小鼠肝脏损伤具有保护作用,可以改善衰老模型小鼠的肝功能。
研究显示,NADPH氧化酶亚基gp91 phox参与调节细胞中ROS的生成、肝星状细胞活化和肝纤维化过程,gp91 phox特异性缺失小鼠可以免受肥胖引起的葡萄糖代谢异常和肝细胞损伤[20]。AOS可通过降低细胞内gp91 phox、p67 phox的表达,减轻细胞中ROS累积,降低组织氧化应激水平,显示出较强的抗衰老活性[8,21]。为了明确AOS对衰老相关性肝脏损伤的潜在保护机制,本研究检测了小鼠肝脏组织中相应指标的变化,结果显示,D-gal干预可显著提高小鼠肝脏组织中衰老相关蛋白p21及NADPH氧化酶亚基gp91 phox、p67 phox的表达;而AOS干预显著抑制了衰老模型小鼠肝脏组织中p21、gp91及p67 phox的表达,减轻了D-gal诱导的衰老模型小鼠肝脏组织中的氧化应激水平,表明AOS抗氧化应激的特性可能在保护D-gal诱导的衰老模型小鼠肝脏损伤中起重要作用。
衰老与细胞内ROS的产生增加和抗氧化能力降低引起的组织氧化损伤有关。随着年龄的增长,肝脏的抗氧化能力降低,且易受氧化应激的影响。以往研究表明,Nrf2/HO-1是机体抗氧化损伤的重要信号通路。在正常情况下,Nrf2在细胞质中与Kelch样环氧氯丙烷相关蛋白-1(Keap1)结合,并被泛素蛋白酶体迅速降解[22-23]。当组织遭受氧化应激时,Nrf2/Keap1复合物解离,Nrf2经Keap1介导的蛋白酶体降解减少并转移到细胞核中,与抗氧化反应元件(ARE)结合,并诱导HO-1基因的表达,进而促进下游抗氧化酶SOD1的产生,增强组织的抗氧化能力[24-26]。因此,本研究检测了小鼠肝脏细胞中Nrf2/HO-1通路的相关指标,并探讨了AOS是否通过激活Nrf2/HO-1信号通路增强肝脏组织的抗氧化能力。结果表明,D-gal显著降低了小鼠肝脏组织中Nrf2、HO-1 mRNA及SOD1蛋白的表达水平;AOS的干预显著上调了小鼠肝脏组织中Nrf2、HO-1 mRNA和SOD1蛋白表达,使肝脏组织的抗氧化能力显著增强。上述结果表明,AOS可能通过激活肝脏细胞中Nrf2/HO-1信号通路上调抗氧化酶的表达,抑制肝脏组织中的氧化应激水平,减轻D-gal诱导的衰老模型小鼠肝脏损伤。
综上所述,本研究证实了D-gal诱导的衰老模型小鼠肝脏组织中氧化应激水平升高,抗氧化能力降低。AOS可以显著改善D-gal诱导的衰老模型小鼠肝脏损伤,其机制可能与AOS激活肝脏细胞中Nrf2/HO-1信号通路,从而增强肝脏组织的抗氧化能力并抑制氧化应激水平有关。然而,本研究仅在动物水平探讨了AOS通过抑制肝脏组织中的氧化应激和增强肝脏组织的抗氧化能力起到改善D-gal诱导的衰老模型小鼠肝脏损伤的作用,AOS延缓肝脏衰老、抑制肝脏损伤的具体机制还有待在细胞水平进一步验证。
利益冲突声明:所有作者声明不存在利益冲突。
ConflictsofInterest: All authors disclose no relevant conflicts of interest.
伦理批准和动物权利声明:本研究涉及的所有动物实验均已通过青岛大学附属医院医学伦理委员会的审核批准(文件号QYFYWZLL-26710)。所有实验过程均遵照《实验动物管理条例》进行。
EthicsApprovalandAnimalRight: All experimental animal protocols in this study were reviewed and approved by The Medical Ethics Committee of The Affiliated Hospital of Qingdao University (Approval Letter No. QYFYWZLL26710), and all experimental animal protocols were carried out by following the guidelines of Regulations for The Administration of Experimental Animals.
作者贡献:毛拥军、陈茗、冯文静参与了研究设计;陈茗、胡松、刘佳、王珊参与了论文的写作和修改。所有作者均阅读并同意发表该论文。
Contributions: The study was designed byMAOYongjun,CHENMing, andFENGWenjing. The manuscript was drafted and revised byCHENMing,HUSong,LIUJia, andWANGShan. All the authors have read the last version of the paper and consented submission.

