23价肺炎球菌多糖疫苗与预灌封注射器的相容性研究
摘 要 目的:评估肺炎球菌疫苗产品与预灌封注射器的相容性。方法:根据肺炎球菌疫苗产品的性质,选择3种提取溶剂(酸性缓冲液、碱性缓冲液、极性溶剂)对其包材(预灌封注射器)进行提取,对提取液中的元素、不挥发性物质、挥发性/半挥发性物质、挥发性物质的含量以及特殊化合物进行分析测试;并通过玻璃内表面实验考查玻璃脱片情况。结果:提取液中检测出Al、Si、W元素和有机物丙酮,但其含量均远低于每日允许最大曝露量(PDE);特殊化合物未有检出,玻璃内表面无脱片现象。结论:初步评估结果表明肺炎球菌疫苗产品与预灌封注射器可良好地相容。
关键词 肺炎球菌疫苗 预灌封注射器 相容性 可提取物研究
中图分类号:R945 文献标志码:A 文章编号:1006-1533(2022)11-0068-04
引用本文 蒋纯. 23价肺炎球菌多糖疫苗与预灌封注射器的相容性研究[J]. 上海医药, 2022, 43(11): 68-71.
Compatibility study of 23-valent pneumococcal polysaccharide vaccine and prefilled syringe
JIANG Chun
(ICAS Testing Technology Service (Shanghai) Co., Ltd., Shanghai 201702, China)
ABSTRACT Objective: To evaluate the compatibility between pneumococcal vaccine product and its prefilled syringes. Methods: Three solvents (acid buffer, alkaline buffer, polar solvent) were selected to extract the packaging material (prefilled syringe) based on the property of 23-valent pneumococcal polysaccharide vaccine. The contents of elements, non-volatile substances, volatile/semi-volatile substances, volatile substances and the special compounds in the extracts were determined and the peeling of glass was examined by the experiment of the glass inner surface. Results: Element Al, Si and W and organic acetone were detected in the extracts, but all were far below the maximum daily permissible exposure (PDE). Special compounds were not detected and peeling phenomenon on the glass inner surface was not observed. Conclusion: The pneumococcal vaccine products have good compatibility with prefilled syringes.
KEY WORDS pneumococcal vaccine; prefilled syringe; compatibility; analysis of extractables
1983年,23價肺炎球菌多糖疫苗研制成功[1],用于免疫预防肺炎链球菌引起的肺炎疾病,其对肺炎球菌引起的肺炎具有非常好的预防功效,据研究表明其覆盖率可达到85%~90%。免疫力低下的人群和老年人群是肺炎的多发人群,所以本品对于这类人群的应用占据了很大比例[2]。
预灌封注射器是一种新型的药品包装,它同时具有储存和注射的功能,相对于传统的一次性使用无菌塑料注射器,能极大地降低生产与使用的人力和成本,并降低药品在使用过程中被污染的可能性,近几年越来越多地被运用到临床中,尤其更多地被运用到疫苗的包装中[3]。
本产品为一种肺炎多糖疫苗,属于无需配伍就可直接使用的注射药品,这种预灌封药品包装材料为这类药品的使用提供了便捷与安全。预灌封注射器由玻璃针筒、推杆、护帽以及活塞组成,包含了玻璃和弹性体等材质,这些材质为药品的一级包装,会直接接触到药品,材料中的各类添加剂、残留物等可能会浸出到产品中,从而对人体产生危害[4-5]。所以,须对药品和包装材料的相容性进行研究[6]。相容性研究的第一步就是对预灌封注射器中可能会出现的物质有一个全面的了解,其中最重要的研究就是在对生产中的添加剂种类了解的基础上进行有目的的可提取物研究,从而将预灌封注射器中可能迁移到药液中的物质的范围缩小到一个可定量、定性研究的范围。
美国FDA、欧洲EMEA以及产品质量研究协会(PQRI)等各国各地区的权威机构颁布了各项条例和指南,用来指导、规范药品与包装材料相容性研究。随着这些规范在国外发达国家的深入执行,我国药品监督管理机构在近十年内也陆续颁布了药物与塑料、玻璃、弹性体密封件、生产系统的相容性指导原则。我们根据这一系列的指南进行实验的设计。
1 材料和方法
1.1 仪器
1290/6470的液相色谱-质谱(LC-MS)、7890B/ 7000D Triple Quad的气相色谱-质谱(GC-MS)和GC 7890B/5977B MSD/7697A HS的顶空气相色谱-质谱(HS-GCMS)(Agilent公司); NexIon1000的电感耦合等离子体-质谱(ICP-MS)(Perkin Elmer公司)。
1.2 提取液制备
选择的三种提取溶剂分别为A:氯化钾溶液(0.2 mol/L,pH 3.0±0.1);B:磷酸盐溶液(0.2 mol/L,pH 10.0±0.1);C:乙醇水溶液(20%)。取30支预灌封注射器(宁波正力药品包装有限公司),每支加入提取液溶剂A 1 mL,用铝箔纸密封后放入烘箱中,55 ℃的温度下提取72 h,取出冷却后待测记作提取液A;同法用提取溶剂B、C制备提取液B、C;另外取各提取溶剂30 mL于聚四氟乙烯瓶中与样品同法操作后作为对照空白。
本疫苗产品含有氯化钠溶液0.76%~1.00%,pH为6.0~7.5,提取溶剂的pH为3和10,严苛于药品pH,提取液C为20%的乙醇水溶液,其有机相的比例高于本药品,本产品于2~8 ℃避光储存运输,参考ISO10993-12,浸提条件温度为55 ℃严格于临床使用条件。
1.3 分析评价阈值
遗传毒性致癌物的安全性阈值(SCT)为欧洲药品局推荐的1.5 mg/d,即低于该值的化合物无论致癌与否,都可认为化合物不会对人体产生危害。根据用药剂量等可以将SCT换算成特定包装容器中可提取物的分析评价阈值(analytical evaluation threshold,AET),以便于直观地对特定药物进行分析。当某一化合物被检出超过AET值时,会将其报告出来,并进行鉴定,评估;反之则不对此化合物进行报告。换言之,本研究只报告超出 AET值的化合物。
由于可提取物的检测为单点加标的半定量方法,并且考虑到不同化合物之间结构的差异从而会导致响应因子的不同,因此在计算AET值的时候,设置50%的不确定度。
根据化学药品与弹性体密封件相容性研究技术指导原则,本研究中药品每日最大用药量为1支,故有机物AET=SCT(1.5 mg/d)÷每日最大用药量(1支/天)×不确定度(50%)=0.75 mg/支。
1.4 样品制备
1.4.1 元素测试样品制备
1)定量限(LOQ) B、Mg、Si、Ca为50 ng/mL;V、Co、Ni、As、Cd、Hg、Pb为1.0 ng/mL;其他元素为5.0 ng/mL,回收率满足70%~150%。
2)样品制备 移取提取液A、B各1.0 mL于不同容量瓶中,用4%硝酸定容至25 mL;同法制备空白对照[7]。
1.4.2 不挥发性有机物测试样品制备
1)定量限 0.05 mg/mL的混标[三苯基氧化膦(TPPO)、抗氧剂XH-245(C34H50O8)、促进剂DT(C15H17N3)、双酚M(C24H26O2)、促进剂DETU(C5H12N2S)和全氟辛酸]为代表性物质,满足信噪比(S/N)≥10。
2)样品溶液 取A、B、C各5 mL于分液漏斗中,用二氯甲烷(DCM)5 mL萃取,取下层有机相;再用DCM 5 mL重复萃取1次,合并有机相,用氮气吹干,用50%甲醇溶液5 mL复溶成样品溶液。同法制备平行样品和空白对照[8]。
1.4.3 挥发性/半挥发性有机物测试样品制备
1)定量限 0.1 mg/mL的混标(十甲基环五硅氧烷、2,6-二叔丁基-4-甲基苯酚(BHT)、四氯乙烯、邻苯二甲酸二异丁酯(DIBP)、二苯胺、氘代萘、氘代苊和氘代屈)为代表性物质,满足S/N≥10。
2)样品溶液 取提取液A、B、C各5 mL于不同分液漏斗中,加入内标溶液(40 mg/mL)25 mL,加DCM 5 mL萃取后取有机相;再用DCM 5 mL重复萃取1次;合并有机相后加入适量无水硫酸钠除水,氮气吹至1 mL刻度以下,加DCM定容至1.0 mL作为样品溶液。同法制备平行样品和空白对照[9]。
1.4.4 挥发性有机物测试样品制备
1)定量限 0.1 mg/mL,满足S/N≥10。
2)样品 取1套预灌封注射器中的组件活塞和护帽,放入同一顶空瓶中。以空顶空瓶为空白对照[10]。
1.4.5 玻璃内表面测试样品制备
1)阴性对照样品 未经提取液提取的预灌封注射器样品。
2)阳性对照样品 用氢氧化钠溶液(0.5 mol/L)于105 ℃提取4 h的预灌封注射器样品。
3)提取样品 在55 ℃下经提取液A、B提取72 h的预灌封注射器样品。
1.4.6 2-巯基苯并噻唑(2-MBT)测试样品制备
1)定量限 即线性低点溶液(10 ng/mL),满足S/N≥10。
2)樣品制备 将弹性体剪成小块,取1.0 g于玻璃容器中,加入甲醇4.0 mL,加盖密封后常温下超声30 min,摇匀,取上清作为样品液。同法制备平行样品液及空白对照。
1.4.7 N-亚硝胺类物质测试样品制备
1)定量限 即线性低点溶液(10 ng/mL),满足S/N≥10。
2)样品制备 将弹性体剪成小块,取2.0 g置于容器中,加入甲醇2.0 mL,加盖密封后室温下超声30 min,取上清作为样品液。同法制备平行样品液及空白对照。
1.4.8 多环芳烃类物质测试样品制备
1)定量限 线性低点溶液(50 ng/mL),满足S/N≥10。
2)样品制备 将弹性体剪成小块,称取2.0 g置于玻璃瓶中,加入甲醇2.5 mL(含0.1 mg/mL内标),加盖密封后在60 ℃下超声60 min作为样品液。同法制备平行样品液及空白对照。
1.5 分析方法
1)ICP-MS 扫描模式:跳峰(Peak Hopping);保压时间:50.0 ms;模式:动能歧视模式(KED)。
2)HPLC-MS 色谱柱:Zorbax SB-aq 3.0 mm×100 mm,3.5 mm;进样量:5 mL;柱温:40 ℃;流速:0.45 mL/min;质谱扫描模式:单离子检测扫描(SIM)。洗脱程序:时间(min):0→5.5→24→29→29.5→33,对应的流动相A(5 mmol/L乙酸铵)(%):90→27→0→0→90→90、流动相B(甲醇)(%):10→73→100→100→10→10。
3)GC-MS 色谱柱:HP-5MS UI (30 m×250 μm×0.25 mm);进样量:1 mL;进样口温度:300 ℃;四级杆温度:150 ℃;流速:1.5 mL/min;质谱扫描模式:全扫描模式[Scan(45~550)]。升温程序:初始温度40 ℃,保持5 min;20 ℃/min至240 ℃,保持5 min;10 ℃/min至310 ℃,保持10 min。
4)HSGC-MS色谱柱:DB-624,30 m×250 μm×1.4 mm;载气:He;进样时间:0.5 min;保温箱温度:90 ℃;四级杆温度:150 ℃;GC循环时间:46 min;流速:1.2 mL/min;质谱扫描模式:Scan(35~250)。升温程序:40℃保持2 min;2.5 ℃/min至100 ℃;10 ℃/min至240 ℃;
2 结果
2.1 元素扫描(ICP-MS)测试
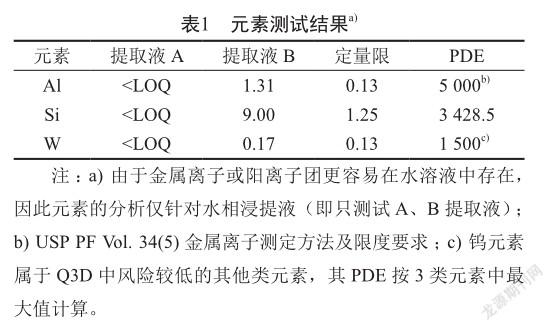
检测结果表明,提取液B中仅Al、Si、W三种元素的含量超出了定量限,但均未超出其PDE值(见ICH Q3D:元素杂质指导原则);而在提取液A中他们的含量均小于定量限(表1)。
2.2 小分子挥发物HSGC-MS全扫测试
检测结果表明,样品中检测到丙酮(检出值8.00 mg/支)大于AET值(0.75 mg/支),但小于其PDE限值(50 000 mg/支)。
2.3 玻璃内表面测试
对阴性对照样品和提取样品进行扫描电子显微镜(SEM)观察均未发现玻璃内表面侵蚀脱片现象,而阳性对照样品发现侵蚀脱片现象,此阳性侵蚀脱片图可为浸出实验提供参考。
2-MBT测试结果表明,样品中未检测到超出定量限2-MBT;N-亚硝胺类物质和多环芳烃类物质测试结果表明,样品中未检测到超出定量限的目标化合物。
2.4 不挥发性有机物HPLC-MS和挥发性/半挥发性有机物GC-MS测试
检测结果表明,提取液中均未检测到大于AET值的物质。
3 讨论
用3种提取溶剂(酸、碱、有机溶剂)对预灌封注射器组合件进行提取,对提取液进行元素和有机物的测试,共检测出的元素有Al、Si、W,但含量均未超过PDE值;有机化合物虽然检出丙酮含量大于AET值,但远未超出其PDE限值。
药用玻璃中通常包含三氧化二铝、二氧化硅等成分,本研究中检出的元素Al、Si可能来自于这些成分,由于预灌封注射器的针头是用钨针插入玻璃针筒中制成的,所以钨(W)元素常残留于预灌封注射器中,丙酮是橡胶中常见的残留溶剂。
根据对提取物质及其PDE值的分析,从而对23价肺炎球菌多糖疫苗产品与包装材料-预灌封注射器的相容性进行初步的安全风险评估,可以看出该包材的安全性较高,风险度较低,可进行下一步浸出物研究。另外可预测潜在的浸出物为元素Al、Si、W以及丙酮,再结合ICH Q3D、包材配方以及各指导原则来进一步确认所要考察的浸出物种类。
参考文献
[1] Pneumococcal conjugate vaccine for childhood immunization WHO position paper[J]. Wkly Epidem Rec, 2007, 82(12): 93-104.
[2] 韩菲, 曹欣, 胡鹏, 等. 23价肺炎链球菌荚膜多糖疫苗的研制[J]. 国际生物制品学杂志, 2010, 33(3): 134-138.
[3] 蔡荣. 预灌封注射器简介[J]. 上海包装, 2006(2): 19-20.
[4] 何子骞. 药品包装材料对药品质量的影响[J]. 生物化工, 2020, 6(2): 112-114.
[5] 張芳艳, 赵欣欣, 余萍. 药品包装材料存在的问题及其对用药安全的影响[J]. 中国药业, 2012, 21(16): 10-12.
[6] 方旻, 梁伊琳, 谢新艺, 等. 药品包装与药品的相容性研究进展[J]. 中国包装, 2018, 38(7): 78-81.
[7] 武静文. 金属元素检测技术在药包材常规检测、相容性研究中的应用及探讨[J]. 中国医药导刊, 2020, 22(5): 331-335.
[8] 李春焕, 薛维丽, 邢晟, 等. 高效液相色谱法检测溴化丁基胶塞中11种抗氧剂及游离硫的浸出量及迁移量[J].分析实验室, 2020, 39(1): 91-96.
[9] 索玲喆, 于祥勇, 徐健峰, 等. GC-MS法应用于胶塞与疫苗注射液的包材相容性[J]. 沈阳药科大学学报, 2019, 36(9): 805-811.
[10] 赵霞, 胡昌勤, 金少鸿. 药用丁基胶塞中易挥发性成分的成分分析[J]. 药物分析杂志, 2006, 26(3): 315-318.

