黑果腺肋花楸花色苷微波辅助提取工艺优化
韩东,李建颖,孙怡,邢丽颖
(天津商业大学生物技术与食品科学学院,天津 300134)
黑果腺肋花楸[Aronia melanocarpa(Michx.)Elliott],又称野樱莓、不老莓,蔷薇科腺肋花楸属,落叶灌木,原产于北美地区,起初作为观赏树木,用于水果生产的黑果腺肋花楸培育时间距今100多年,目前在欧美地区广泛种植。黑果腺肋花楸抗逆性强,适合多种环境种植。20世纪90年代辽宁干旱地区研究所将一个黑果腺肋花楸栽培种从朝鲜引种到我国东北地区[1],从此开始了黑果腺肋花楸在我国的研究。目前的种植地区主要集中在我国的东部和中部地区。黑果腺肋花楸主要有药用、食用、观赏三大价值。黑果腺肋花楸富含花青素、原花青素、黄酮、绿原酸,膳食纤维等物质[2-5]。研究发现,黑果腺肋花楸具有很好的抗氧化活性,在抗炎、抑菌、抑癌、调节血糖、护肝、免疫调节、调节血压[6-17]等方面具有一定作用。
黑果腺肋花楸果实中富含多酚类物质,且多酚含量是目前已知果实中含量最高的,其中花色苷含量可占总酚的四分之一,花色苷是一类广泛存在于植物中的天然活性物质,是一种水溶性色素。黑果腺肋花楸花色苷主要由4种花色苷组成,包括矢车菊素-3-半乳糖苷、矢车菊素-3-阿拉伯糖苷、矢车菊素-3-葡萄糖苷、矢车菊素-3-木糖苷,其中矢车菊素-3-半乳糖苷占比最大为68.68%,其次是矢车菊素-3-阿拉伯糖苷占比为25.62%,另外2种糖苷分别占比5.28%和0.42%[18]。
目前对于黑果腺肋花楸花色苷常用的提取方法有溶剂浸提法、超声波辅助提取法,例如唐璐[19]采用乙醇浸提法对黑果腺肋花楸花色苷进行提取,经过响应面优化获得最优条件下黑果腺肋花楸花色苷提取量为6.43 mg/g。朱凤妹等[20]在进行黑果腺肋花楸花色苷提取工艺优化时,采用了更高效的超声辅助提取法。通过响应面法优化得到的黑果腺肋花楸花色苷最佳提取工艺条件为乙醇溶液(含0.5%乙酸)浓度40%、提取温度43℃、超声时间23 min、液料比为89∶1(mL/g),此条件下,黑果腺肋花楸中花色苷提取得率为(0.79±0.01)g/100 g。也有研究采用高压脉冲电场提取方法提取黑果腺肋花楸果实中的花色苷,在最优条件下,此方法的花色苷提取量比溶剂浸提法提高36.70%,比超声波辅助提取法提高9.87%[21]。微波辅助提取法是利用微波进行物质萃取的一种技术,相对于溶液浸提法、超声辅助提取法,微波辅助提取法具有快速、高效、噪声小、加热均匀、节能等优点。
本研究以黑果腺肋花楸作为原料,采用微波辅助萃取法进行提取,运用单因素和响应面法进行优化,旨在得到黑果腺肋花楸中花色苷提取的最佳工艺,为黑果腺肋花楸中花色苷的深入研究提供一定的理论依据。
1 材料与方法
1.1 材料
黑果腺肋花楸鲜果:天津市静海区崇泰龙泉农业基地,品种为富康源一号;无水乙醇:天津市永大化学试剂有限公司;浓盐酸:天津市大茂化学试剂厂;无水乙酸钠:南京化学试剂有限公司;氯化钾:天津市科密欧化学试剂有限公司;以上试剂均为分析纯;矢车菊素-3-葡萄糖苷:德国sigma公司。
1.2 仪器
Discover SPX全自动微波萃取仪:美国CEM公司;CL5R型医用离心机:长沙湘仪离心机仪器有限公司;UV-2600型紫外分光光度计:日本SHIMADZU公司;ST3100 pH计、AX224ZH型电子天平:奥豪斯仪器(常州)有限公司;VaCo-Ⅱ冷冻干燥机:德国ZIRBUS公司;YB-2500A多功能粉碎机:永康市速锋工贸有限公司;SY-2-4电热恒温水浴锅:天津市欧诺仪器仪表有限公司;HH-6恒温水浴锅:上海胜卫电子科技有限公司。
1.3 方法
1.3.1 样品预处理
将黑果腺肋花楸鲜果去梗、去叶,挑选饱满、无虫、无腐烂的果实洗净后经预冻处理,置于冷冻干燥机中冻干48 h,冻干后的样品经粉碎、过100目筛后,置于-4℃保存。
1.3.2 黑果腺肋花楸果粉花色苷的提取
精密称取1.000 g预处理后的粉末,加入无水乙醇(含0.1%盐酸)溶液后再放入微波反应器中进行提取,冷却至室温(25℃)后,在4 000 r/min下离心20 min,取上清液,即黑果腺肋花楸花色苷提取液。
1.3.3 黑果腺肋花楸果粉花色苷提取量的测定方法
采用pH示差法[22]测定花色苷提取量,以矢车菊素-3-葡萄糖苷为计量标准。
提取液用乙醇定容后,分别用pH1.0盐酸氯化钾缓冲液和pH4.5盐酸醋酸钠缓冲液稀释,混匀后,放入40℃水浴锅中水浴40 min。以蒸馏水为对照组进行同样操作,水浴结束后,测定520 nm和700 nm处的吸光度,分别记为A520和A700。按下式计算提取液中花色苷提取量。
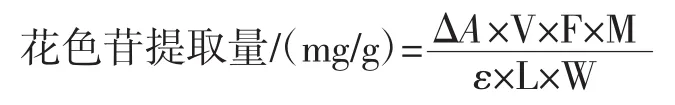
式中:ΔA=(A520-A700)pH1.0-(A520-A700)pH4.5;V为最后定容的体积,10 mL;F为稀释倍数,20;ε为矢车菊素-3-葡萄糖苷的摩尔消光系数,26 900 L/(mol·cm);M为矢车菊素-3-葡萄糖苷的相对分子质量,449.2 g/mol;L为比色皿的厚度,1 cm;W为黑果腺肋花楸样品质量,1.000 g。
1.3.4 单因素试验
本试验选取乙醇浓度、液料比、提取温度和提取时间4个影响因素,进行黑果腺肋花楸中花色苷微波辅助提取单因素试验。分别研究不同乙醇(含0.1%盐酸)浓度(40%、50%、60%、70%、80%)、不同液料比[10∶1、20∶1、30∶1、40∶1、50∶1(mL/g)]、不同提取温度(40、50、60、70、80 ℃)、不同提取时间(5、10、15、20、25 min)对黑果腺肋花楸花色苷提取量的影响,每个试验平行重复3次,结果取平均值。
1.3.5 响应面优化试验
将乙醇浓度(A)、液料比(B)、提取温度(C)、提取时间(D)设为自变量,以花色苷提取量(Y)为响应值,建立四因素三水平的Box-Behnken中心组合试验。因素水平设计见表1。
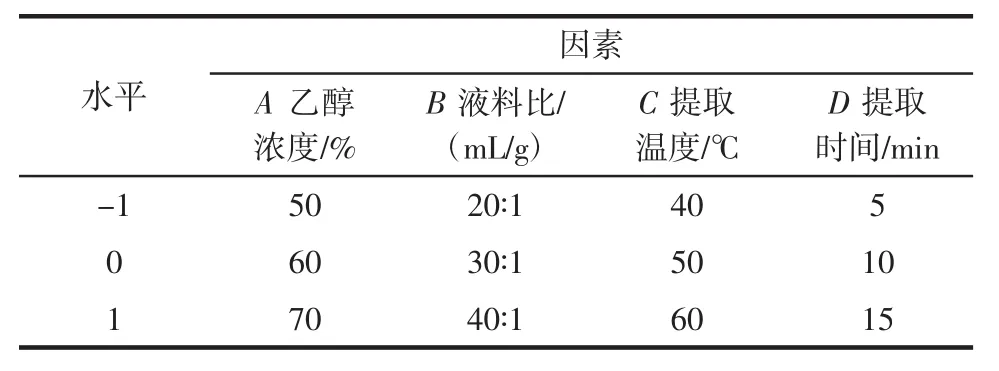
表1 响应面试验设计因素与水平Table 1 Factors and levels of response surface methodologies
1.3.6 数据处理
采用Design-Expert 10.0.7软件对响应面试验数据进行方差分析,作图采用Origin2018软件。
2 结果与分析
2.1 单因素试验结果分析
2.1.1 乙醇浓度对黑果腺肋花楸花色苷提取效果分析
乙醇浓度单因素试验结果见图1。
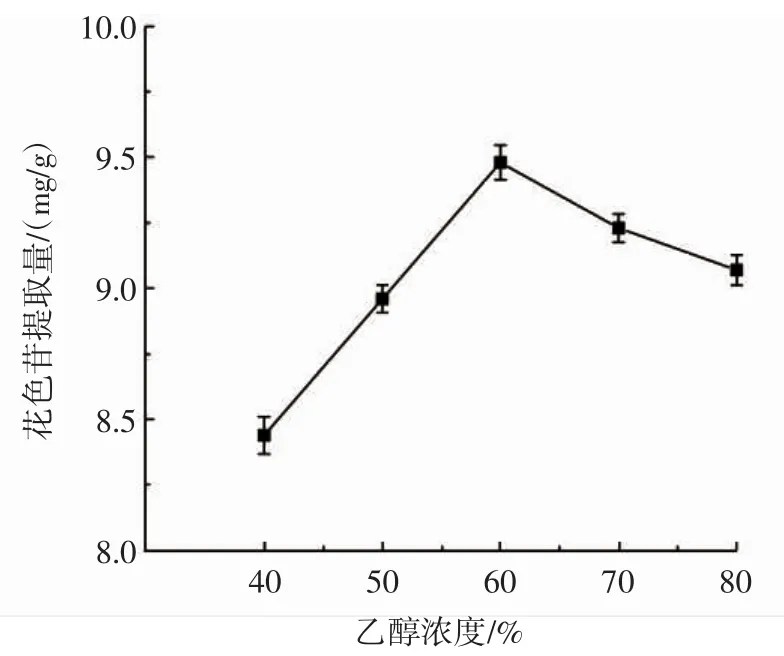
图1 乙醇浓度对花色苷提取量的影响Fig.1 Effect of ethanol concentration on anthocyanin content
由图1可知,当提取溶剂中乙醇浓度在40%~60%时,黑果腺肋花楸花色苷提取量随着乙醇浓度的增大而升高;当提取溶剂中乙醇浓度在60%~80%时,黑果腺肋花楸花色苷提取量逐渐降低。当乙醇浓度较低时,黑果腺肋花楸果实中含有的易溶于水的物质(例如糖类),可能影响了花色苷的溶出,造成了花色苷提取量低,当乙醇浓度较高时,极性降低,不利于黑果腺肋花楸花色苷溶出,从而导致花色苷提取量降低。所以为了保证花色苷的提取效果并尽量节省资源,选择乙醇浓度为50%、60%、70%进行下一步的优化试验。
2.1.2 液料比对黑果腺肋花楸花色苷提取效果分析
液料比单因素试验结果见图2。
由图2可知,当液料比小于30∶1(mL/g)时,提取液中花色苷提取量随着液料比的增加而升高;在液料比30∶1(mL/g)时,花色苷提取量达到最高;之后,随着液料比的继续增加,花色苷提取量有所下降。这可能是由于随着提取剂用量的增加,花色苷分子间的作用力随之减弱,花色苷的稳定性降低,同时随着提取剂用量的增加干扰性的杂质也会增多,造成花色苷提取量降低。所以为了保证花色苷的提取效果并尽量节省资源,液料比选择20∶1、30∶1、40∶1(mL/g)进行下一步的优化试验。
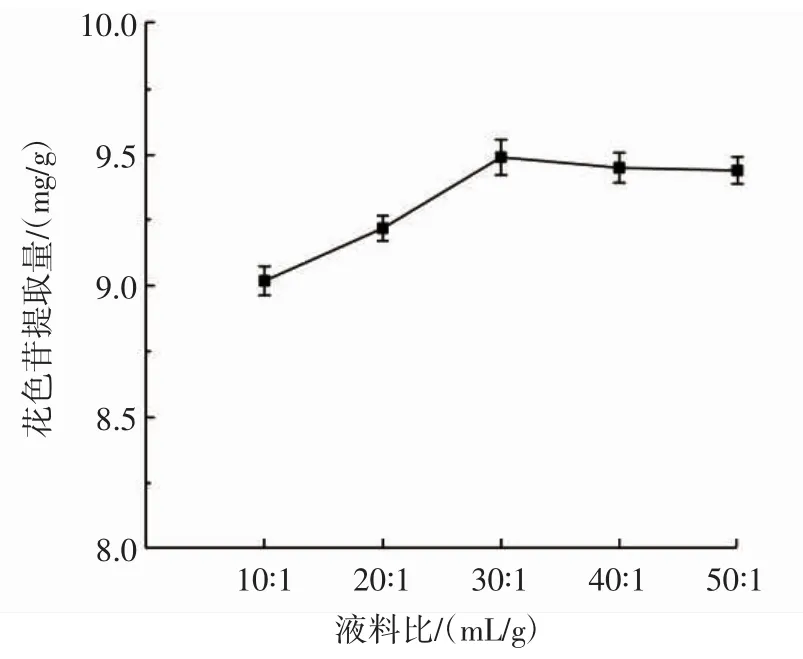
图2 液料比对花色苷提取量的影响Fig.2 Effect of material to liquid ratio on anthocyanin conten
2.1.3 提取温度对黑果腺肋花楸花色苷提取效果分析
提取温度单因素试验结果见图3。
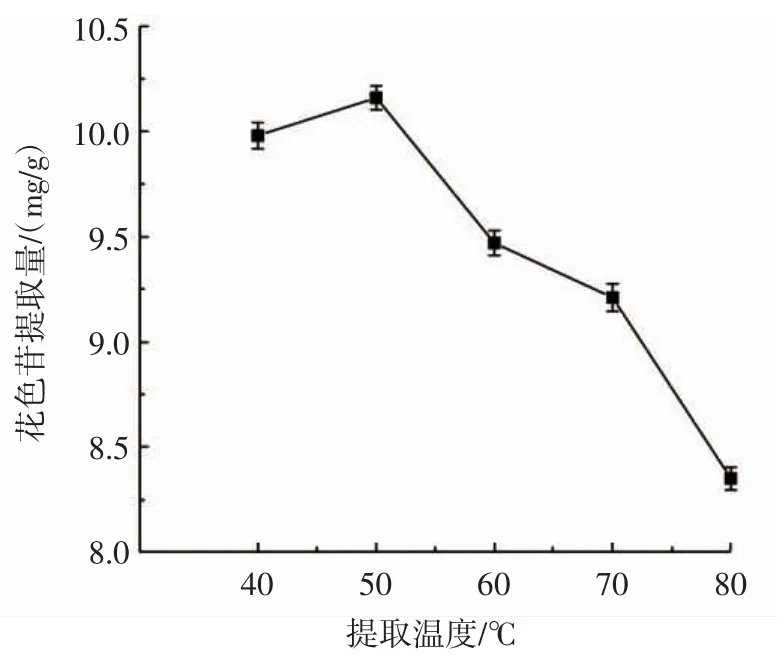
图3 提取温度对花色苷提取量的影响Fig.3 Effect of extraction temperature on anthocyanin content
由图3可知,当提取温度小于50℃时,黑果腺肋花楸花色苷提取量随着提取温度的升高逐渐升高,当温度达到50℃时,黑果腺肋花楸花色苷提取量达到最高。当温度继续升高时,花色苷提取量开始下降,这是因为花色苷的耐热性较差,花色苷在低温下较稳定,当在高温环境下,花色苷会发生降解,从而导致提取量降低。所以,为了保证花色苷的提取效果并尽量节省资源,提取温度选择40、50、60℃进行下一步的优化试验。
2.1.4 提取时间对黑果腺肋花楸花色苷提取效果分析
提取时间单因素试验结果见图4。
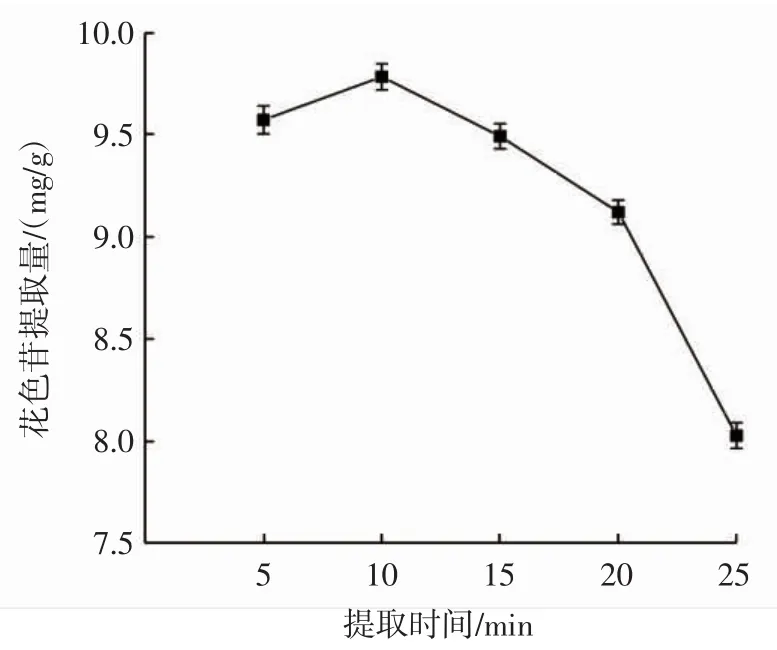
图4 提取时间对花色苷提取量的影响Fig.4 Effect of extraction time on anthocyanin content
由图4可知,当提取时间小于10 min时,提取液中花色苷提取量随着提取时间的延长而升高;当提取时间大于10 min时,花色苷提取量随着时间的延长而降低。这是因为提取时间的适当延长,可以使黑果腺肋花楸花色苷更加充分地溶出,但是当提取时间过长时,花色苷会被降解,从而导致花色苷提取量的下降。所以,为了保证花色苷的提取效果并尽量节省资源,提取时间选择5、10、15 min进行下一步的优化试验。
2.2 响应面优化试验结果分析
以A(乙醇浓度)、B(液料比)、C(提取温度)、D(提取时间)为自变量,以黑果腺肋花楸花色苷提取量(Y)为响应值进行响应面法优化分析,具体试验方案及结果见表2,方差分析见表3。
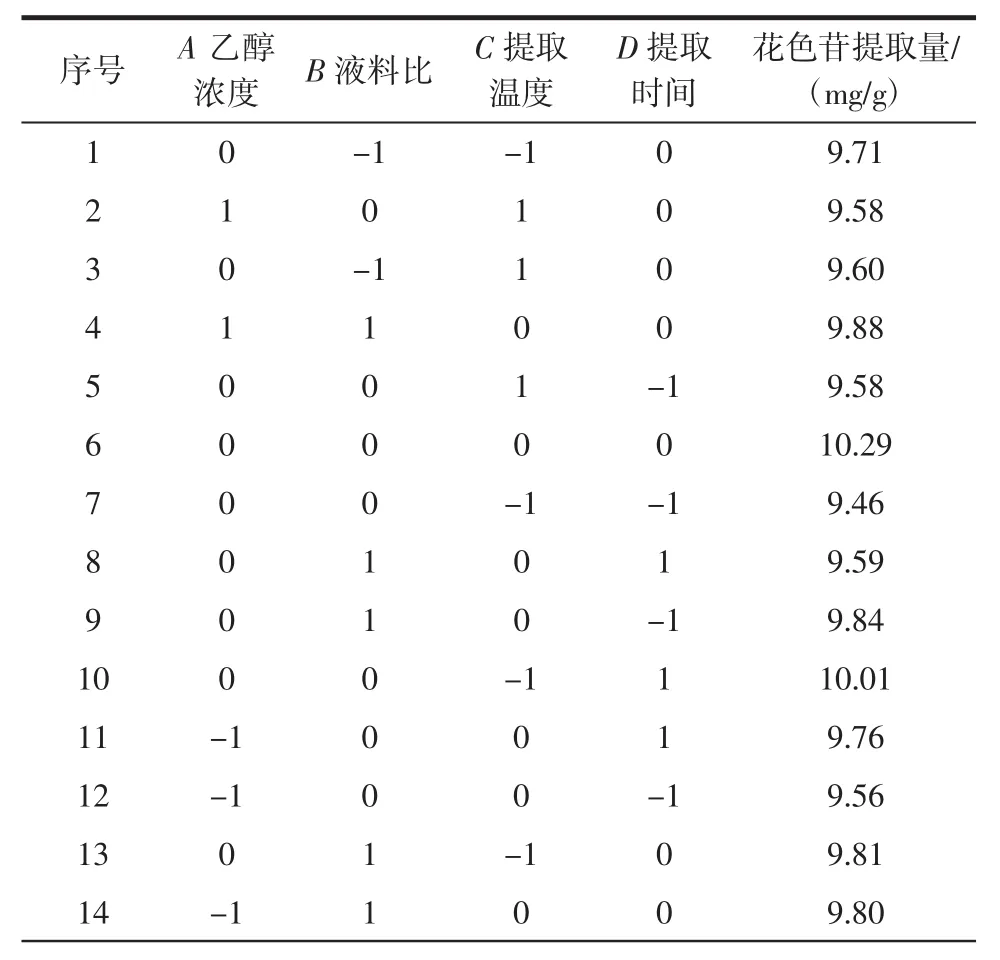
表2 响应面试验方案及结果Table 2 Box-Behnken experimental design and results

续表2 响应面试验方案及结果Continue table 2 Box-Behnken experimental design and results
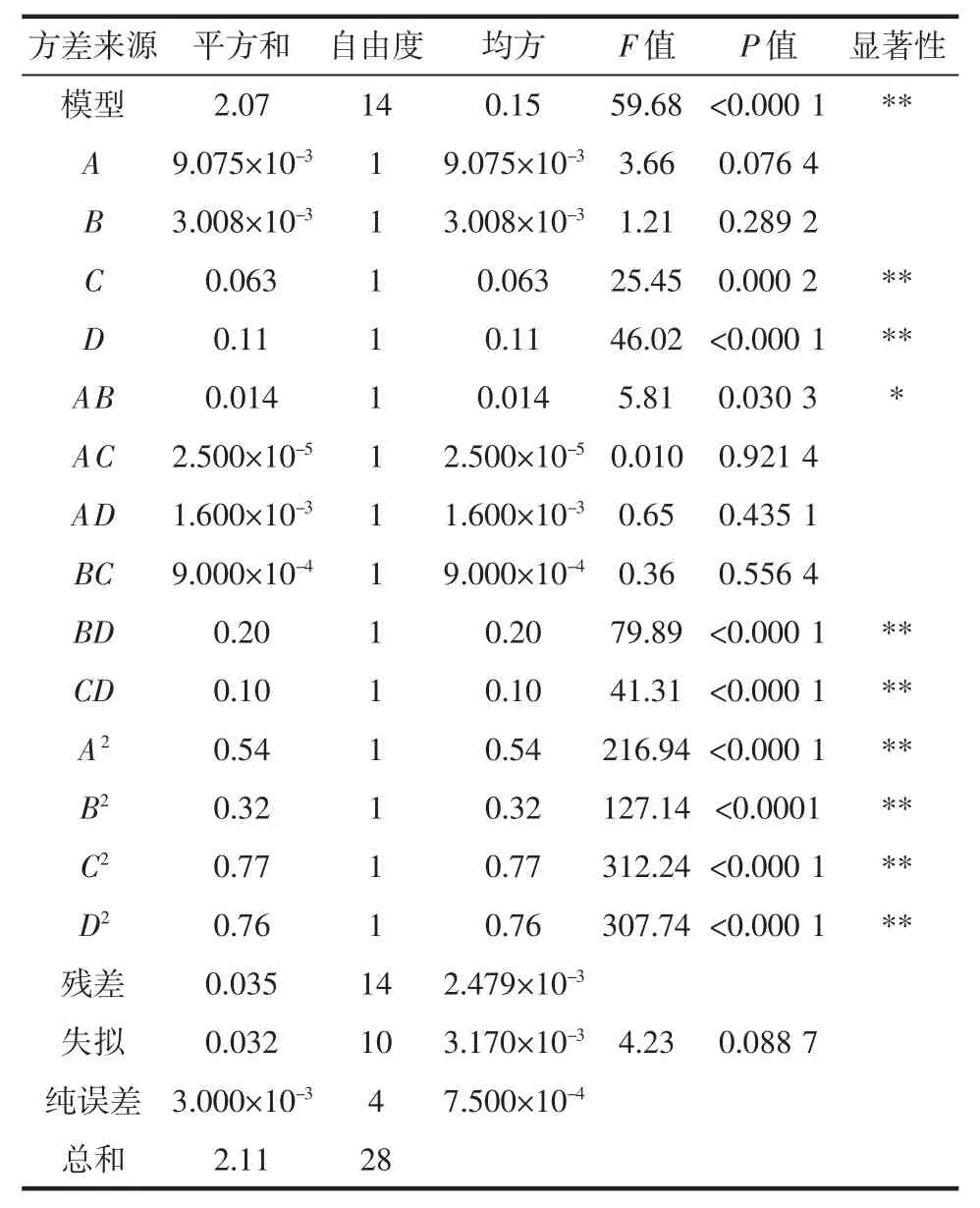
表3 响应面试验方差分析Table 3 Variance analysis of response surface methodology
采用Design Expert 10.0.7对数据进行处理分析,所得关于黑果腺肋花楸花色苷提取量的多元回归方程为Y=10.29-0.027A+0.016B-0.073C+0.098D+0.060AB-0.0025AC-0.020AD-0.015BC-0.22BD-0.16CD-0.29A2-0.22B2-0.35C2-0.34D2。
由表3可知,该模型的F值为59.68,模型的P<0.0001,表示该模型具有极显著性。该模型失拟项F值为4.23,失拟度(P=0.088 7>0.05)不显著,表示该模型能很好地预测结果,试验预测数据具有良好的可靠性。通过F值大小可以得出各因素对响应值影响程度的大小为提取时间>提取温度>乙醇浓度>液料比。提取温度与提取时间影响极显著,乙醇浓度和料液比影响不显著,交互项BD和CD影响极显著,交互项AB影响显著,其余交互项不显著,平方项均为极显著,与方差分析结果一致。
各因素之间的交互作用可以从等高线的形状、密集程度和响应曲面的陡峭程度来判断。等高线密集、形状呈扁平或椭圆形,响应曲面比较陡峭表明试验因数的变化对响应值影响较大,表明两组因素间的交互作用较大。反之,等高线稀疏、形状接近圆形,响应曲面相对比较平缓表明两组因素的交互作用较小[23-24]。各因素交互作用对花色苷提取量影响情况见图5。
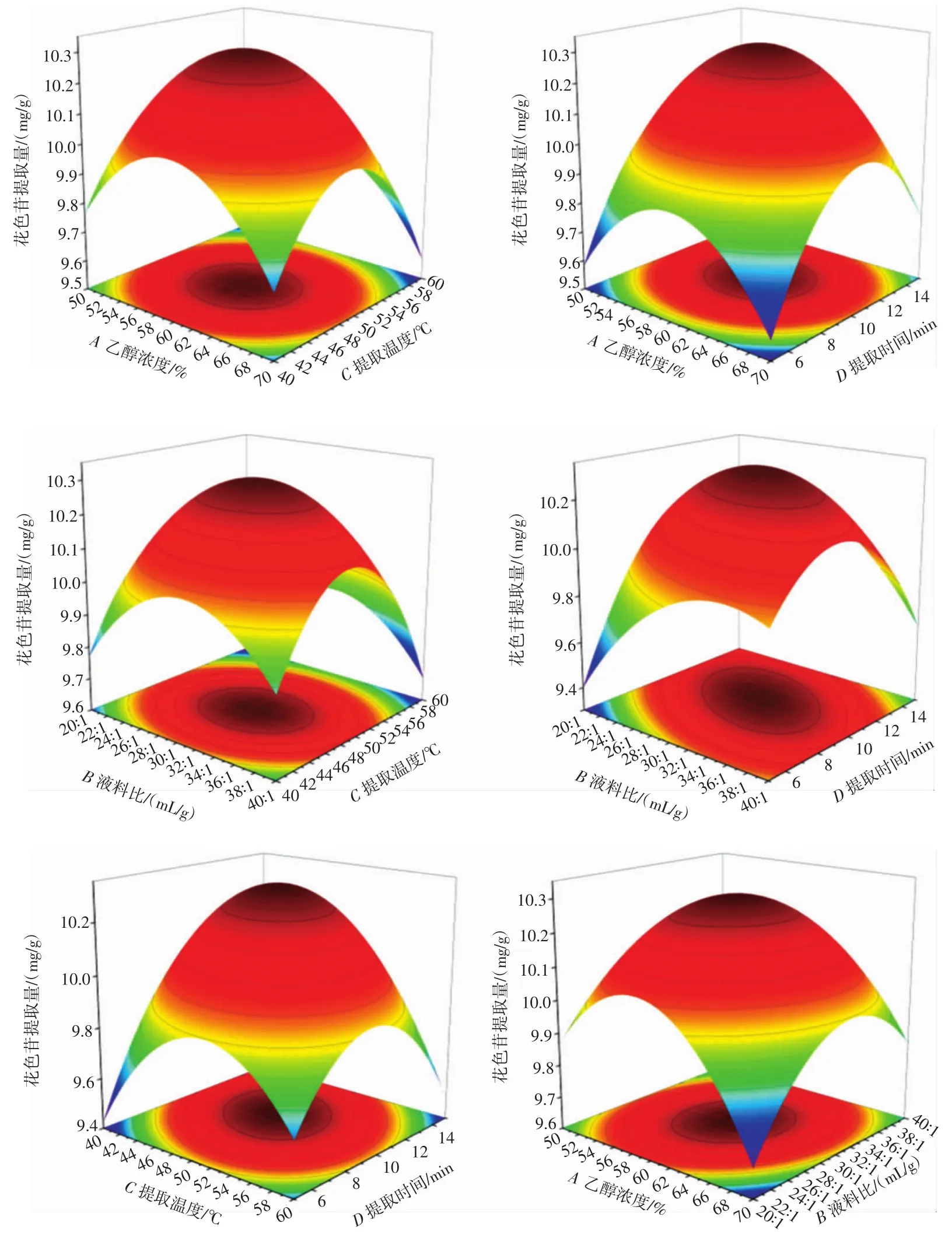
图5 各因素间相互作用的响应曲面图Fig.5 Response surface diagram of interaction of various factors
由图5可知,乙醇浓度和提取温度、乙醇浓度和提取时间、液料比和提取温度间的交互作用不显著。乙醇浓度和液料比、液料比和提取温度、液料比和提取时间间交互作用显著。此结论与方差分析结果一致。
2.3 试验验证
由Design Expert 10.0.7软件得到的微波辅助提取黑果腺肋花楸花色苷的最佳提取条件为乙醇浓度59.377%、液料比29.318∶1(mL/g)、提取温度 48.506℃、提取时间10.994 min,在此条件下,理论上花色苷提取量为10.306 mg/g。为了方便具体试验操作,将最佳工艺调整为乙醇浓度59%、液料比29∶1(mL/g)、提取温度48℃、提取时间为11 min,对黑果腺肋花楸中花色苷进行提取,做3次平行试验,得到花色苷的提取量为10.298 mg/g。验证试验的结果与最佳提取条件下得到的理论值相近,说明结果可靠。该模型合理可行。
3 结论
黑果腺肋花楸营养丰富,具有极高的食用与药用价值,但是黑果腺肋花楸在我国的起步较晚,随着黑果腺肋花楸种植面积的扩大,对其功效方面的研究逐渐深入,黑果腺肋花楸所蕴藏的价值将会被更广泛地应用。
本文以酸化乙醇为提取剂,采用微波辅助法提取黑果腺肋花楸花色苷,通过单因素试验与响应面试验设计发现,各因素对黑果腺肋花楸花色苷提取量影响顺序为提取时间>提取温度>乙醇浓度>液料比,得到的黑果腺肋花楸花色苷提取最佳工艺条件:提取剂为体积分数为59%的乙醇、液料比为29∶1(mL/g)、提取温度为48℃、提取时间为11 min。通过此方法提取黑果腺肋花楸花色苷提取量有明显提高。

