siRNA-KCNQ1OT1对人LECs凋亡的抑制作用及其靶向miR-199a-5p机制
鲁诚 张凤妍 张宇航 张佳娟
1新乡市第一人民医院眼科,新乡 453000;2郑州大学第一附属医院眼科,郑州 450000
白内障是严重致盲眼病,常用的治疗方法是手术治疗,寻求白内障的非手术治疗方法一直是相关研究的热点。研究显示,长链非编码RNA(long non-coding RNA,lncRNA)参与细胞增生、凋亡和氧化应激过程,如KCNQ1重叠转录物1(KCNQ1 overlapping transcript 1,KCNQ1OT1)在过氧化氢(hydrogen peroxide,HO)诱导的人晶状体上皮细胞(lens epithelial cells,LECs)中表达量升高,其可通过靶向负调控miR-214抑制LECs凋亡。微小RNA(micro RNA,miRNA)广泛参与多种疾病的发生和发展,包括白内障。miR-199a-5p在高糖诱导人LECs中表达量减少,miR-199a-5p通过负调控特异性蛋白1而抑制细胞的上皮-间质转化(epithelial-mesenchymal transition,EMT)。LECs的EMT与白内障发病密切相关。如何干预HO诱导人LECs的生物学行为对于白内障的防治具有重要意义。关于KCNQ1OT1和miR-199a-5p调控作用研究鲜有报道,在线生物信息学网站Starbase预测显示,KCNQ1OT1与miR-199a-5p有互补结合位点,推测KCNQ1OT1和miR-199a-5p共同参与LECs的生物学功能,但二者间的相互作用及其能否对白内障的EMT过程产生影响尚未阐明。本研究拟探讨KCNQ1OT1和miR-199a-5p的相互作用及其对氧化应激状态下人LECs增生、凋亡的影响及可能的作用机制,以期为白内障的治疗寻找新的靶点。
1 材料与方法
1.1 材料
1
.1
.1
标本及细胞来源 收集2018年12月至2019年8月在新乡市第一人民医院行白内障手术的23例年龄相关性白内障患者的晶状体前囊膜组织,同时收集20例正常供体眼晶状体前囊膜组织。本研究方案经新乡市第一人民医院伦理委员会批准[批文号:2019(001)],患者家属均签署知情同意书。人LECs株SRA01/04购于上海研生生化公司。本实验在郑州大学第一附属医院眼科学与视觉科学实验室进行。1
.1
.2
主要试剂及仪器 胎牛血清、DMEM培养基(美国Hyclone公司);HO(美国Sigma公司);小干扰RNA-阴性对照(small interfering RNA-negative control,siR-NC)、siRNA-KCNQ1OT1、miR-NC、miR-199a-5p、抗miR-NC、抗-miR-199a-5p(广州锐博生物科技有限公司);Lipofectamine2000试剂盒、Trizol试剂盒(美国Invitrogen公司);逆转录试剂盒、荧光定量试剂盒(日本Toyobo公司);MTT试剂盒(上海碧云天生物技术有限公司);凋亡试剂盒(上海贝博生物科技有限公司);鼠单克隆bcl-2抗体(12381-1-AP)、鼠单克隆bax抗体(50571-2-Ig)、鼠单克隆甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(59094-1-Ig)(美国Protein Tech公司);辣根过氧化物酶(horseradish peroxidase,HRP)标记的兔抗羊IgG(SV0002)(武汉博士德生物工程有限公司);超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malonaldehyde,MDA)试剂盒(南京建成生物研究所);双荧光素酶活性试剂盒(美国Promega公司)。MultiskanFC Microplate Photometer酶标仪、AttuneNxT流式细胞仪、Applied Biosystems PCR仪(美国Thermo公司);荧光显微镜(日本Olympus公司)。1.2 方法
1
.2
.1
细胞培养 LECs(SRA01/04)解冻复苏后接种在含有质量分数10%胎牛血清、100 U/ml(商品单位)青霉素和100 μg/ml链霉素的DMEM培养液内,在37 ℃、体积分数5% CO恒温培养箱内进行培养,待细胞生长融合至85%,加入胰蛋白酶消化传代培养。取第5代细胞用于后续实验。1
.2
.2
细胞分组及处理 取对数生长期细胞以1×10个/孔接种在96孔板中,将细胞分为空白对照组、模型对照组、siR-NC组、siR-KCNQ1OT1组、miR-NC组、miR-199a-5p组、siR-KCNQ1OT1+anti-miR-NC组和siR-KCNQ1OT1+ anti-miR-199a-5p组。空白对照组不做任何处理;模型对照组采用100 μmol/L HO培养细胞24 h制作氧化应激损伤模型;其余各组按照Lipofectamine2000试剂盒说明分别用siR-NC、siR-KCNQ1OT1、miR-NC、miR-199a-5p、siR-KCNQ1OT1+anti-miR-NC、siR-KCNQ1OT1+anti-miR-199a-5p转染LECs 6 h后更换培养基,添加100 μmol/L HO继续培养24 h。1
.2
.3
实时荧光定量PCR检测晶状体前囊膜组织及各组细胞中KCNQ1OT1和miR-199a-5p表达 取晶状体前囊膜组织及各组培养的细胞,采用Trizol试剂盒抽提细胞总RNA,采用逆转录试剂盒合成cDNA,按照荧光定量试剂盒的操作步骤进行PCR反应。引物由上海吉玛制药技术有限公司合成。KCNQ1OT1正向引物序列:5'-GCACTCTGGGTCCTGTTCTC-3',反向引物序列:5'-CACTTCCCTGCCTCCTACAC-3';GAPDH正向引物序列:5'-ATCACTGCCACCCAGAAGAC-3',反向引物序列:5'-TTTCTAGACGGCAGGTCAGG-3'。miR199a-5p正向引物序列:5'-TTATTACCCAGGCAGACACCG-3',反向引物序列:5'-AGTGCGAACTGTGGCGAT-3';U6正向引物序列:5'-CTTCGGCAGCACATATAC-3',反向引物序列:5'-GAACGCTTCACGAATTTGC-3'。反应条件:95 ℃ 5 min,95 ℃ 30 s,60 ℃ 30 s;72 ℃ 30 s,共40个循环;60 ℃延长5 min。以GAPDH作为KCNQ1OT1反应的内参,U6作为miR-199a-5p反应的内参,采用2法计算KCNQ1OT1和miR-199a-5p相对表达量。1
.2
.4
MTT法检测细胞活力 将培养的各组细胞接种在96孔板中,细胞密度为5×10个/ml,在恒温培养箱内培养48 h,每孔培养基中加入20 μl MTT,室温培养4 h,加入DMSO溶液150 μl,结晶振荡溶解,采用酶标仪在波长为490 nm处检测吸光度(A
)值。细胞生存率(%)=(实验组A
值-空白组A
值)/(对照组A
值-空白组A
值)×100%。1
.2
.5
流式细胞术检测细胞凋亡率 将培养的各组细胞接种在6孔板中,细胞密度为1×10个/ml,加入磷酸盐缓冲液(phosphate-buffered saline,PBS)制备细胞悬液,取悬液200 μl,加入Annexin V-FITC和PI 5 μl,避光孵育15 min,加入PBS 150 μl重悬细胞1 h,流式细胞仪检测细胞凋亡水平。细胞凋亡率(%)=早期凋亡细胞百分率+晚期凋亡细胞百分率。1
.2
.6
Western blot法检测细胞中bcl-2和bax蛋白表达 取各组培养细胞加入蛋白裂解液提取细胞总蛋白,按照BCA法定量蛋白。100 ℃变性10 min,取35 μg上样,10% SDS-PAGE处理蛋白样品,转膜,采用新鲜脱脂牛奶封闭2 h,分别加入bcl-2(1∶ 500)、bax(1∶ 500)和GAPDH抗体(1∶ 1 000),4 ℃孵育24 h,加入HRP标记的IgG抗体(1∶ 2 500),37 ℃孵育2 h,加入化学发光液显影并拍照,应用Band Scan 5.0凝胶软件扫描分析蛋白条带灰度值,以GAPDH为内参,计算目的蛋白相对表达量。1
.2
.7
ELISA法检测各组细胞中SOD活性和MDA含量 取各组培养细胞,离心半径14 cm,1 000 r/min离心10 min,收集细胞上清液,根据SOD试剂盒说明书步骤,将上清液稀释至150 μl,酶标仪上检测589 nm处A
值,计算细胞SOD活性。SOD活性值=(对照组A
值-实验组A
值)×样品体积/(0.5×对照组A
值×样品鲜重×测定样品用量)。按照MDA试剂盒说明书步骤,将上清液稀释至10 μl,与待测样本混匀,离心取上清液,于酶标仪上检测530 nm、600 nm处A
值,计算细胞MDA含量。MDA含量=6.45×(A
-A
)-0.560。1
.2
.8
双荧光素酶报告实验检测法验证KCNQ1OT1和miR-199a-5p的关系 生物信息学网站预测显示,KCNQ1OT1与miR-199a-5p有结合互补关系,构建KCNQ1OT1野生型载体(KCNQ1OT1-WT)和突变型载体(KCNQ1OT1-MUT),分别与miR-NC和miR-199a-5p转染LECs(SRA01/04)48 h,采用双荧光素酶活性试剂盒检测荧光素酶活性。1.3 统计学方法
采用SPSS 22.0统计学软件进行统计分析。计量资料数据经Shapiro-Wilk检验证实呈正态分布,以表达,2个组间计量资料数据比较采用独立样本t
检验;多组间计量资料的数据比较采用单因素方差分析,两两比较采用LSD-t
检验。P
<0.05为差异有统计学意义。2 结果
2.1 正常供体和白内障患者晶状体前囊膜组织中KCNQ1OT1和miR-199a-5p表达比较
与正常供体组织相比,白内障患者晶状体前囊膜组织内KCNQ1OT1 mRNA相对表达量明显升高,差异有统计学意义(t
=14.112,P
<0.001);miR-199a-5p相对表达量明显降低,差异有统计学意义(t
=16.507,P
<0.001)(表1)。2.2 模型对照组与空白对照组细胞中KCNQ1OT1和miR-199a-5p相对表达量比较
与空白对照组比较,模型对照组细胞中KCNQ1OT1 mRNA相对表达量明显升高,差异有统计学意义(t
=15.449,P
<0.001);miR-199a-5p相对表达量较空白对照组明显降低,差异有统计学意义(t
=22.823,P
<0.001)(表2)。表1 正常供体和白内障患者晶状体前囊膜组织中KCNQ1OT1和miR-199a-5p相对表达量比较(x±s)Table 1 Comparison of the expressions of KCNQ1OT1 and miR-199a-5p in lens anterior capsule between normal donor and cataract patients (x±s)组织样本量KCNQ1OT1miR-199a-5p正常供体前囊膜200.97±0.191.04±0.15白内障患者前囊膜232.41±0.420.36±0.12t值14.11216.507P值<0.001<0.001 注:(独立样本t检验) KCNQ1OT1:KCNQ1重叠转录物1;miR:微小RNA Note:(Independent samples t test) KCNQ1OT1:KCNQ1 overlap-ping transcript 1;miR:microRNA
表2 模型对照组与空白对照组细胞中KCNQ1OT1和miR-199a-5p相对表达量比较(x±s)Table 2 Comparison of the relative expression levels of KCNQ1OT1 and miR-199a-5p between two groups (x±s)组别样本量KCNQ1OT1miR-199a-5p空白对照组91.03±0.090.97±0.08模型对照组92.35±0.240.32±0.03t值15.44922.823P值<0.001<0.001 注:(独立样本t检验) KCNQ1OT1:KCNQ1重叠转录物1;miR:微小RNA Note:(Independent samples t test) KCNQ1OT1:KCNQ1 overlap-ping transcript 1;miR:microRNA
2.3 不同siRNA转染组KCNQ1OT1及凋亡相关蛋白表达量比较
模型对照组、siR-NC组细胞中bax蛋白表达条带强于空白对照组和siR-KCNQ1OT1组,bcl-2蛋白表达条带弱于模型对照组和siR-NC组(图1)。空白对照组、模型对照组、siR-NC组、siR-KCNQ1OT1组细胞中KCNQ1OT1及bcl-2和bax蛋白相对表达量总体比较差异均有统计学意义(F
=96.159、175.196、85.656,均P
<0.001),其中与空白对照组比较,模型对照组细胞中KCNQ1OT1和bax蛋白相对表达量明显升高,bcl-2蛋白相对表达量明显降低,差异均有统计学意义(均P
<0.05);与siR-NC组比较,siR-KCNQ1OT1组细胞中KCNQ1OT1和bax蛋白相对表达量降低,bcl-2蛋白相对表达量升高,差异均有统计学意义(均P
<0.05)(图1,表3)。
图1 不同siRNA转染组凋亡相关蛋白表达电泳图 1:空白对照组;2:模型对照组;3:siR-NC组;4:siR-KCNQ1OT1组 bax:bcl-2相关X蛋白;bcl-2:B细胞淋巴瘤/白血病-2;GAPDH:甘油醛-3-磷酸脱氢酶Figure 1 Electrophoretogram of apoptosis-related protein in different siRNA transfection groups 1:blank control group;2:model control group;3:siR-NC group;4:siR-KCNQ1OT1 group bax:bcl-2 related X protein;bcl-2:B-cell lymphoma/leukemia-2;GAPDH:glyceraldehyde-3-phosphate dehydrogenase
表3 不同siRNA转染组细胞中KCNQ1OT1及凋亡相关蛋白相对表达量比较(x±s)Table 3 Comparison of the relative expressions of KCNQ1OT1 and apoptosis-related proteins among different siRNA transfection groups (x±s)组别样本量KCNQ1OT1bcl-2bax空白对照组90.98±0.060.97±0.080.92±0.07模型对照组92.21±0.22a0.41±0.03a1.76±0.16asiR-NC组92.16±0.240.44±0.041.72±0.15siR-KCNQ1OT1组91.54±0.13b0.67±0.07b1.26±0.12bF值96.159175.19685.656P值<0.001<0.001<0.001 注:与空白对照组比较,aP<0.05;与siR-NC组比较,bP<0.05(单因素方差分析,LSD-t检验) siRNA:小干扰RNA;KCNQ1OT1:KC-NQ1重叠转录物1;NC:阴性对照;bcl-2:B细胞淋巴瘤/白血病-2;bax:bcl-2相关X蛋白 Note:Compared with blank control group,aP<0.05;compared with siR-NC group,bP<0.05 (One-way ANOVA,LSD-t test) siRNA:small interfering RNA;KCNQ1OT1:KCNQ1 overlapping transcript 1;NC:negative control;bcl-2:B-cell lymphoma/leukemia-2;bax:bcl-2 re-lated X protein
2.4 不同siRNA转染组细胞生存率和凋亡率比较
空白对照组、模型对照组、siR-NC组、siR-KCNQ1OT1组细胞生存率和凋亡率总体比较差异均有统计学意义(F
=136.460、137.352,均P
<0.001),其中与空白对照组比较,模型对照组细胞生存率明显降低,细胞凋亡率明显升高,差异均有统计学意义(均P
<0.05);与siR-NC组比较,siR-KCNQ1OT1组细胞生存率明显升高,细胞凋亡率明显降低,差异均有统计学意义(均P
<0.05)(图2,表4)。
图2 流式细胞术检测不同siRNA转染组细胞凋亡水平 A:空白对照组 B:模型对照组 C:siR-NC组 D:siR-KCNQ1OT1组Figure 2 Cell apoptosis analysis of different siRNA transfection groups detected by flow cytometry A:blank control group B:model control group C:siR-NC group D:siR-KCNQ1OT1 group
2.5 不同siRNA转染组细胞中氧化应激相关指标比较
不同转染组细胞中SOD活性值和MDA含量总体比较差异均有统计学意义(F
=162.758、81.059,均P
<0.001),其中与空白对照组相比,模型对照组SOD活性值显著降低,MDA含量显著升高,差异均有统计学意义(均P
<0.05);与siR-NC组比较,siR-KCNQ1OT1组SOD活性值显著升高,MDA含量显著降低,差异均有统计学意义(均P
<0.05)(表5)。2.6 KCNQ1OT1与miR-199a-5p的靶向关系
在线生物信息学预测结果显示,KCNQ1OT1与miR-199a-5p存在互补的核苷酸序列。与miR-NC组比较,miR-199a-5p组的KCNQ1OT1-WT荧光素酶活性值显著降低,差异有统计学意义(t
=21.131,P
<0.001),2个组间KCNQ1OT1-MUT荧光素酶活性值比较差异无统计学意义(t
=1.302,P
=0.211)(图3,表6)。表4 不同siRNA转染组细胞生存率和凋亡率比较(x±s,%)Table 4 Comparison of cell survival rate and apoptosis rate among different siRNA transfection groups (x±s,%)组别样本量细胞生存率细胞凋亡率空白对照组998.2±9.89.2±0.9模型对照组942.5±4.6a26.5±2.9asiR-NC组946.7±4.227.2±3.1siR-KCNQ1OT1组975.1±6.7b15.3±1.2bF值136.460137.352P值<0.001<0.001 注:与空白对照组比较,aP<0.05;与siR-NC组比较,bP<0.05(单因素方差分析,LSD-t检验) siRNA:小干扰RNA;NC:阴性对照;KC-NQ1OT1:KCNQ1重叠转录物1 Note:Compared with blank control group,aP<0.05;compared with siR-NC group,bP<0.05 (One-way ANOVA,LSD-t test) siRNA:small interfering RNA;NC:negative control;KCNQ1OT1:KCNQ1 o-verlapping transcript 1
表5 不同siRNA转染组细胞中SOD活性值和MDA含量比较(x±s)Table 5 Comparison of SOD activity and MDA concentration in cells among different siRNA transfection groups (x±s)组别样本量SOD活性值[mmol/(L·min)]MDA含量(mmol/L)空白对照组945.4±3.936.7±3.5模型对照组921.4±2.2a65.4±5.7asiR-NC组918.6±1.868.6±6.1siR-KCNQ1OT1组932.5±3.1b49.2±4.0bF值162.75881.059P值<0.001<0.001 注:与空白对照组比较,aP<0.05;与siR-NC组比较,bP<0.05(单因素方差分析,LSD-t检验) siRNA:小干扰RNA;SOD:超氧化物歧化酶;MDA:丙二醛;NC:阴性对照;KCNQ1OT1:KCNQ1重叠转录物1 Note:Compared with blank control group,aP<0.05;compared with siR-NC group,bP<0.05 (One-way ANOVA,LSD-t test) siRNA:small interfering RNA;SOD:superoxide dismutase;MDA:malondialde-hyde;NC:negative control;KCNQ1OT1:KCNQ1 overlapping transcript 1

图3 KCNQ1OT1与miR-199a-5p结合位点 KCNQ1OT1:KCNQ1重叠转录物1;WT:野生型;miR:微小RNA;MUT:突变型Figure 3 The binding site of KCNQ1OT1 and miR-199a-5p KCNQ1OT1:KCNQ1 overlapping transcript 1;WT:wild type;miR:microRNA;MUT:mutant type
表6 各组间野生型和突变型KCNQ1OT1荧光素酶活性值比较(x±s)Table 6 Comparison of the luciferase activity of wild-type and mutant KCNQ1OT1 between two groups (x±s)组别KCNQ1OT1-WTKCNQ1OT1-MUTmiR-NC组1.03±0.080.95±0.07miR-199a-5p组0.40±0.040.99±0.06t值21.1311.302P值<0.0010.211 注:(独立样本t检验) KCNQ1OT1:KCNQ1重叠转录物1;WT:野生型;MUT:突变型;miR:微小RNA;NC:阴性对照 Note:(Independent samples t test) KCNQ1OT1:KCNQ1 overlap-ping transcript 1;WT:wild type;MUT:mutant type;miR:microRNA;NC:negative control
2.7 不同miRNA转染组细胞miR-199a-5p及凋亡相关蛋白表达量比较
模型对照组和miR-NC组细胞中bax蛋白表达条带明显强于空白对照组,bcl-2蛋白表达条带弱于空白对照组;miR-199a-5p组细胞中bax蛋白表达条带明显弱于miR-NC组,bcl-2蛋白表达条带强于模型对照组和miR-NC对照组(图4)。空白对照组、模型对照组、miR-NC组和miR-199a-5p组miR-199a-5p及bcl-2和bax蛋白相对表达量总体比较差异均有统计学意义(F
=367.360、220.909、61.407,均P
<0.001),其中与空白对照组比较,模型对照组miR-199a-5p和bcl-2蛋白相对表达量下降,bax蛋白相对表达量升高,差异均有统计学意义(均P
<0.05);与miR-NC组比较,miR-199a-5p组miR-199a-5p和bcl-2蛋白相对表达量明显升高,bax蛋白相对表达量显著降低,差异均有统计学意义(均P
<0.05)(表7)。
图4 不同miRNA转染组凋亡相关蛋白表达电泳图 1:空白对照组;2:模型对照组;3:miR-NC组;4:miR-199a-5p组 bax:bcl-2相关X蛋白;bcl-2:B细胞淋巴瘤/白血病-2;GAPDH:甘油醛-3-磷酸脱氢酶Figure 4 Electrophoretogram of apoptosis-related proteins in different miRNA transfection groups 1:blank control group;2:model control group;3:miR-NC group;4:miR-199a-5p group bax:bcl-2 related X Protein;bcl-2:B-cell lymphoma/leukemia-2;GAPDH:glyceraldehyde-3-phosphate dehydrogenase
表7 不同miRNA转染组细胞中miR-199a-5表达及凋亡相关蛋白相对表达量比较(x±s)Table 7 Comparison of the expression of miR-199a-5 and the relative expression of apoptosis-related proteins among different miRNA transfection groups (x±s)组别样本量miR-199a-5pbcl-2bax空白对照组90.99±0.060.95±0.070.96±0.08模型对照组90.35±0.03a0.42±0.03a1.66±0.15amiR-NC组90.38±0.040.39±0.041.61±0.14miR-199a-5p组90.63±0.05b0.66±0.06b1.26±0.12bF值367.360220.90961.407P值<0.001<0.001<0.001 注:与空白对照组比较,aP<0.01;与miR-NC组比较,bP<0.01(单因素方差分析,LSD-t检验) miRNA:微小RNA;NC:阴性对照;bcl-2:B细胞淋巴瘤/白血病-2;bax:bcl-2相关X蛋白 Note:Compared with blank control group,aP<0.01;compared with miR-NC group,bP<0.01 (One-way ANOVA,LSD-t test) miRNA:microRNA;NC:negative control;bcl-2:B-cell lymphoma/leukemia-2;bax:bcl-2 related X protein
2.8 不同miRNA转染组细胞生存率和凋亡率比较
空白对照组、模型对照组、miR-NC组和miR-199a-5p组细胞生存率和凋亡率总体比较差异均有统计学意义(F
=184.269、370.944,均P
<0.001),其中与空白对照组比较,模型对照组细胞生存率明显降低,细胞凋亡率明显升高,差异均有统计学意义(均P
<0.05);与miR-NC组比较,miR-199a-5p组细胞生存率明显升高,细胞凋亡率明显降低,差异均有统计学意义(均P
<0.05)(图5,表8)。
图5 流式细胞术检测不同miRNA转染组细胞凋亡水平 A:空白对照组 B:模型对照组 C:miR-NC组 D:miR-199a-5p组Figure 5 Cell apoptosis analysis of different miRNA transfection groups determined by flow cytometry A:blank control group B:model control group C:miR-NC group D:miR-199a-5p group
2.9 不同miRNA转染组SOD活性值和MDA含量比较
空白对照组、模型对照组、miR-NC组和miR-199a-5p组SOD活性值和MDA含量总体比较差异均有统计学意义(F
=164.651、66.376,均P
<0.001),其中与空白对照组比较,模型对照组SOD活性值明显降低,MDA含量明显升高,差异均有统计学意义(均P
<0.05);与miR-NC组比较,miR-199a-5p组SOD活性值明显升高,MDA含量明显降低,差异均有统计学意义(P
<0.05)(表9)。2
.10
抑制miR-199a-5p表达后miR-199a-5p相对表达量、细胞生存率、凋亡和氧化应激相关指标比较与siR-KCNQ1OT1+anti-miR-NC组相比,siR-KCNQ1OT1+anti-miR-199a-5p组bax蛋白表达条带增强,bcl-2蛋白表达条带减弱。siR-KCNQ1OT1+anti-miR-199a-5p组miR-199a-5p相对表达量、细胞生存率、bcl-2蛋白相对表达量和SOD活性值明显低于siR-KCNQ1OT1+anti-miR-NC组,细胞凋亡率、bax蛋白相对表达量和MDA含量显著高于siR-KCNQ1OT1+anti-miR-NC组,差异均有统计学意义(均P
<0.05)(图6,7,表10)。表8 不同miRNA转染组细胞生存率和凋亡率比较(x±s,%)Table 8 Comparison of cell survival rate and apoptosis rate among different miRNA transfection groups (x±s,%)组别样本量细胞生存率细胞凋亡率空白对照组999.7±8.78.7±0.6模型对照组945.4±3.9a27.1±1.9amiR-NC组941.2±4.126.4±1.7miR-199a-5p组969.5±5.8b14.2±1.1bF值184.269370.944P值<0.001<0.001 注:与空白对照组比较,aP<0.05;与miR-NC组比较,bP<0.05(单因素方差分析,LSD-t检验) miRNA:微小RNA;NC:阴性对照 Note:Compared with blank control group,aP<0.05;compared with miR-NC group,bP<0.05 (One-way ANOVA,LSD-t test) miRNA:microRNA;NC:negative control
表9 不同miRNA转染组细胞中SOD活性值和MDA含量比较(x±s)Table 9 Comparison of SOD activity and MDA concentration among different miRNA transfection groups (x±s)组别样本量SOD活性值[mmol/(min·L)]MDA含量(mmol/L)空白对照组941.2±3.433.4±3.1模型对照组917.2±1.8a61.6±5.8amiR-NC组920.4±2.058.4±5.5miR-199a-5p组928.6±2.5b45.1±4.2bF值164.65166.376P值<0.001<0.001 注:与空白对照组比较,aP<0.01;与miR-NC组比较,bP<0.01(单因素方差分析,LSD-t检验) miRNA:微小RNA;SOD:超氧化物歧化酶;MDA:丙二醛;NC:阴性对照 Note:Compared with blank control group,aP<0.01;compared with miR-NC group,bP<0.01 (One-way ANOVA,LSD-t test) miRNA:microRNA SOD:superoxide dismutase;MDA:malondialdehyde;NC:negative control
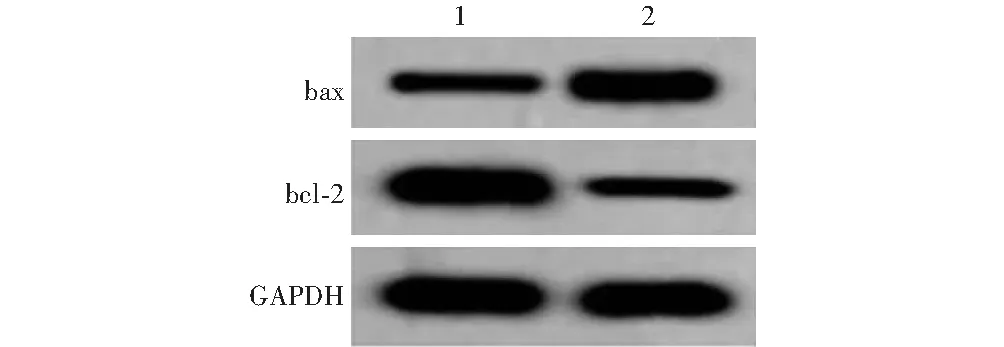
图6 抑制miR-199a-5p表达后凋亡相关蛋白表达电泳图 1:siR-KCNQ1OT1+anti-miR-NC组;2:siR-KCNQ1OT1+anti-miR-199a-5p组 bax:bcl-2相关X蛋白;bcl-2:B细胞淋巴瘤/白血病-2;GAPDH:甘油醛-3-磷酸脱氢酶Figure 6 Electrophoretogram of apoptosis-related proteins after inhibiting miR-199a-5p expression 1:siR-KCNQ1OT1+anti-miR-NC group;2:siR-KCNQ1OT1+anti-miR-199a-5p group bax:bcl-2 related X protein;bcl-2:B-cell lymphoma/leukemia-2;GAPDH:glyceraldehyde-3-phosphate dehydrogenase
表10 抑制miR-199a-5p表达后各组miR-199a-5p相对表达量、细胞生存率、凋亡和氧化应激指标比较(x±s)Table 10 Comparison of relative expression level of miR-199a-5p,cell survial rate,apoptosis and oxidative stress index between two groups after inhibiting miR-199a-5p expression (x±s)组别样本量miR-199a-5p相对表达量细胞生存率(%)细胞凋亡率(%)bcl-2蛋白相对表达量bax蛋白相对表达量SOD活性值[mmol/(L·min)]MDA含量(mmol/L)siR-KCNQ1OT1+anti-miR-NC组90.93±0.0778.2±7.214.4±1.60.72±0.071.32±0.1436.7±3.445.2±3.8siR-KCNQ1OT1+anti-miR-199a-5p组90.35±0.0362.3±6.821.4±1.80.53±0.041.58±0.1625.3±2.253.2±4.7t值22.8474.8168.7207.0703.6698.4453.971P值<0.001<0.001<0.001<0.001<0.001<0.0010.001 注:(独立样本t检验) miR:微小RNA;KCNQ1OT1:KCNQ1重叠转录物1;NC:阴性对照;bcl-2:B细胞淋巴瘤/白血病-2;bax:bcl-2相关X蛋白;SOD:超氧化物歧化酶;MDA:丙二醛 Note: (Independent samples t test) miR:microRNA;KCNQ1OT1:KCNQ1 overlapping transcript 1;NC:negative control;bcl-2:B-cell lympho-ma/leukemia-2;bax:bcl-2 related X protein;SOD:superoxide dismutase;MDA:malondialdehyde

图7 流式细胞术检测抑制miR-199a-5p表达后细胞凋亡水平 A:siR-KCNQ1OT1+anti-miR-NC组 B:siR-KCNQ1OT1+anti-miR-199a-5p组Figure 7 Cell apoptosis analysis after the inhibition of miR-199a-5p detected by flow cytometry A:siR-KCNQ1OT1+anti-miR-NC group B:siR-KCNQ1OT1+anti-miR-199a-5p group
3 讨论
LECs凋亡是除先天性白内障外其他类型白内障形成的细胞分子基础,减轻LECs凋亡和氧化损伤是防治白内障的关键。在体外实验中常用HO、高糖和高钙等因素诱导LECs产生大量活性氧,促进细胞氧化损伤和凋亡。本研究采用100 μmol/L HO诱导人LECs损伤后,细胞活力和SOD活性明显降低,细胞凋亡率和MDA含量显著升高,bcl-2蛋白表达下调,bax蛋白表达上调,表明HO诱导的人LECs损伤模型构建成功。
LncRNA已被证实在白内障疾病中发挥着关键作用,如肺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1)在高糖诱导的人LECs中表达上调,MALAT1通过激活p38MAPK信号通路促进高糖诱导人LECs凋亡和氧化应激,并抑制细胞增生。Du等研究结果显示,INK4基因座中反义非编码RNA(antisense noncoding RNA in the INK4 locus,ANRIL)在HO诱导的人LECs中表达上调,ANRIL通过靶向负调控miR-21促进HO诱导的人LECs凋亡。KCNQ1OT1位于人染色体11p15.5,在多种疾病中表达上调,如KCNQ1OT1在白内障组织和转化生长因子β2(transforming growth factor-β2,TGF-β2)诱导的人LECs中表达上调,沉默KCNQ1OT1通过调节miR-29c-3p/FOS轴促进TGF-β2诱导的人LECs增生和转移,并抑制细胞凋亡。本研究发现HO诱导人LECs损伤后KCNQ1OT1表达上调,抑制KCNQ1OT1能够增强细胞活力和SOD活性,降低细胞凋亡率和MDA含量,上调bcl-2蛋白表达,下调bax蛋白表达,表明抑制KCNQ1OT1可以增强LECs活力,减缓细胞凋亡和氧化应激,这与之前的研究结果相似。有研究发现,miR-199a-5p在高糖诱导人LECs中表达下调,miR-199a-5p通过SP1调控细胞的EMT过程,但是对HO诱导的人LECs研究机制尚不明确。在线生物信息学网站预测结果显示,KCNQ1OT1和miR-199a-5p有互补的结合位点,并进行首次验证。
miRNA已经成为近年在白内障研究中的热点,如miR-34a、miR-124和miR-204等已被证实与白内障相关。Zhou等研究显示,miR-23b-3p在白内障组织和HO诱导的人LECs中表达上调,miRNA-23b-3p通过靶向负调控SIRT1抑制HO诱导的人LECs凋亡和自噬,这与本研究结果相反。Li等研究显示,miR-182-5p在HO诱导的人LECs中表达下调,而过表达miR-182-5p可增强LECs增生活性,并抑制细胞凋亡和氧化损伤。以上研究说明miRNA与白内障发展有关,但是miR-199a-5p与白内障的研究鲜有报道。本研究结果显示,miR-199a-5p在HO诱导人LECs中表达下调,过表达miR-199a-5p可以增强细胞活力和SOD活性,细胞凋亡率和MDA含量降低,上调bcl-2蛋白表达,下调bax蛋白表达。KCNQ1OT1可通过调控下游多个miRNA影响疾病的发生和发展,通过在线生物信息学网站预测显示,miR-199a-5p是KCNQ1OT1的靶标,双荧光素酶报告实验证实KCNQ1OT1可以靶向miR-199a-5p的表达。进一步研究发现,抑制miR-199a-5p表达可部分恢复抑制KCNQ1OT1对HO诱导的人LECs增生、凋亡和氧化应激的影响,说明KCNQ1OT1通过靶向负调控miR-199a-5p的表达减弱HO诱导人LECs损伤。
综上所述,本研究结果显示在HO诱导的人LECs氧化应激损伤中KCNQ1OT1表达上调,miR-199a-5p表达下调,siRNA-KCNQ1OT1通过上调miR-199a-5p的表达增强人LECs的活力,并抑制细胞凋亡和氧化应激。关于miR-199a-5p对下游基因的调控作用以及KCNQ1OT1与miR-199a-5p对信号转导途径的作用机制需要进一步研究。
利益冲突
所有作者均声明不存在任何利益冲突作者贡献声明
鲁诚:酝酿和设计实验、实施研究、采集数据、分析/解释数据、起草及修改文章;张凤妍:酝酿和设计实验、实施研究、对文章知识性内容的审阅和智力性内容的修改及定稿;张宇航:采集数据、分析/解释数据、起草文章;张佳娟:采集数据
