必需脂肪酸经MCP-1/TGF-β1/COL-Ⅰ通路对糖损伤人肾小管上皮细胞的作用
姜明霞, 王 宇, 吕桂兰, 周轶南,董杏媛, 许 琦, 郑锦锋
(中国人民解放军东部战区总医院, 1. 营养科,2. 国家肾脏疾病临床医学研究中心, 江苏 南京, 210002)
糖尿病肾病(DKD)的发病机制复杂,至今尚未完全阐明,可能与遗传易感性、糖代谢紊乱、细胞因子、炎症机制等多种因素有关。单核细胞趋化蛋白-1(MCP-1)是DKD重要的生物学标志物,其引起的炎症反应可引起肾血管损伤、肾基质纤维化以及肾组织结构重建[1]。转化生长因子β1(TGF-β1)是一种调节细胞生长和分化的蛋白,可在多种细胞中表达,参与细胞外基质沉淀及纤维化的发生,包括Ⅰ型胶原蛋白(COL-Ⅰ)和纤维连接蛋白。MCP-1能够活化糖尿病高糖状态下的肾脏巨噬细胞,增加TGF-β1分泌,并组成MCP-1/TGF-β1通路参与DKD的发生[2-3]。除了肾小球的结构和功能变化之外,肾小管和肾小管间质的损伤和炎症也参与DKD的发展[4-5]。肾小管上皮细胞被认为是促进炎症、肾小管变性和纤维化的介质[6]。因此,本研究选用HK-2细胞作为实验对象,通过高糖作用建立糖损伤肾小管的体外模型,观察必需脂肪酸α-亚麻酸(ALA)/亚油酸(LA)对肾小管损伤的作用和效果。
ALA和LA是人体必需脂肪酸,具有多种多样的生理功能。本课题组前期研究[7-8]结果证明, ALA/LA可改善HK-2细胞的糖毒性和氧化应激作用,但对于MCP-1/TGF-β1介导的肾纤维化损伤尚无研究。本研究旨在观察ALA/LA对高糖损伤HK-2细胞MCP-1、TGF-β1和COL-Ⅰ表达的影响,探讨ALA/LA通过该信号通路保护DKD患者肾脏的功能和结构,减缓肾脏炎症状态及纤维化的发生发展的相关作用机制。
1 材料与方法
1.1 材料与仪器
ALA、LA和二十碳五烯酸(EPA)购自美国Nuchek公司; 成人肾脏近曲小管上皮细胞(HK-2)购自美国标准菌种收藏中心 (ATCC); 胎牛血清、DMEM/F12液体培养基、胰蛋白酶购自Gibco公司; 二甲基亚枫(DMSO)、四甲基偶氮唑盐(MTT)购自Sigma公司; 牛血清白蛋白(BSA)购自Amersco公司; 葡萄糖和NaOH均为国产分析纯试剂。Trizol试剂盒购自Invitrogen公司,逆转录试剂盒购自Thermo公司, RNA酶抑制剂购自Fermentas公司,聚合酶链反应(PCR)引物由上海生工生物有限公司合成,人MCP-1、TGF-β1和COL-Ⅰ酶联免疫吸附法(ELISA)检测试剂盒均购自凯基生物科技发展有限公司。仪器: CO2细胞培养箱(美国Thermo公司), 酶标仪(美国Bio-Rad公司), THZ-C恒温震荡器(北京佳源兴业科技有限公司),倒置荧光显微镜(日本OLYMPUS公司), 温控水浴箱(金坛科兴仪器厂), 722型分光光度计(上海第三分析仪器厂),低温高速离心机、台式高速离心机(Eppendorf), 制冰机(AF-100, Scotsman); -80 ℃冰箱(美国Revco)。
1.2 方法
1.2.1 ALA/LA/BSA溶液制备: 参照COUSIN S P等[9]方法,将ALA、LA制成5 mmol/L ALA/LA/BSA 储存液,冷却至室温,无菌过滤(0.45 mm), 分装储存, -20 ℃保存。每次实验前取出ALA/LA/BSA储存液,于55 ℃水浴中加热 15 min 后,冷却至室温备用。
1.2.2 HK-2细胞培养: HK-2细胞接种于含100 U/mL 青霉素、100 μg/mL 链霉素、10%胎牛血清的DMEM/F12(1∶1)完全培养基中,置于37 ℃、5% CO2细胞培养箱中培养。
1.2.3 葡萄糖毒性测定: 取对数生长期细胞接种于96孔培养板,每孔100 μL(含5×103个细胞)。待细胞贴壁后,吸去原培养液,加入不同浓度葡萄糖溶液(17.5、30.1、35.1、40.2、48.7、56.5、64.3 mmol/L), 培养48 h后,吸去培养液,加入MTT 溶液, 37 ℃孵育4 h, 弃上清,加入DMSO, 室温避光置摇床低速震荡10 min, 用酶标仪测定490 nm处光密度(OD)值,计算细胞存活率[5]。存活率=(实验组OD-对照组OD)×100%。
1.2.4 实验分组: 本实验中将细胞分为6组。① 正常对照组(N组): HK-2细胞正常生长于DMEM/F12培养液; ② 高糖模型组(G组): HK-2细胞在DMEM/F12培养液基础上加入高浓度葡萄糖共同培养; ③ 阳性对照组(E组): EPA作为阳性对照物,该组HK-2细胞在高糖环境下,给予10、50、100、200 μmol/L共4种浓度EPA分别进行干预; ④ ALA组(A组): 该组HK-2细胞在高糖环境下,给予10、50、100、200 μmol/L共4种浓度ALA分别进行干预; ⑤ LA组(L组): 该组HK-2细胞在高糖环境下,给予10、50、100、200 μmol/L共4种浓度LA分别进行干预; ⑥ ALA/LA组(M组): 该组HK-2细胞在高糖环境下,给予ALA/LA混合液分别干预, ALA/LA浓度为50、100 μmol/L, 比例分别是1∶1、1∶4、1∶8。
1.2.5 ELISA测定HK-2细胞上清中TGF-β1、MCP-1和COL-Ⅰ含量: HK-2细胞经高糖培养以及ALA/LA干预后,分离获得细胞上清液,按照相应指标ELISA试剂盒的说明书进行操作,采用酶标仪测定OD值,计算TGF-β1、MCP-1和COL-Ⅰ表达量。
1.2.6 逆转录聚合酶链反应(RT-PCR)测定HK-2细胞TGF-β1、MCP-1和COL-ⅠmRNA的表达: 收集各组细胞,采用Trizol 试剂盒提取细胞TGF-β1、MCP-1和COL-Ⅰ总RNA, 方法按照试剂盒说明书进行。PCR扩增引物根据GenBank 中相应基因序列设计,引物序列:MCP-1-F为5′-TATTGTCCACTGACCCC-3′,MCP-1-R为5′-CTTCACCCAACTCCTAACCT-3;TGF-β1-F为5′-AGCTGTACATTGACTTCCGCAAGG-3,TGF-β1-R为5′-CAGGCAGAAGTTGGCGTGGTAG-3′;COL-Ⅰ-F为5′-TAGGTAGGCCATTGTGTATGCAGC-3′,COL-Ⅰ-R为5′-ACATGTTCAGCTTTGTGGCC-3′;β-actin-F为CCTAAAAGCCACCCCACTTC,β-actin-R为AGGGAGACCAAAAGCCTTCA。
1.3 统计学分析

2 结 果
2.1 高浓度葡萄糖对HK-2细胞的作用
根据MTT实验结果,与17.5 mmol/L浓度相比,葡萄糖浓度从40.2 mmol/L开始,细胞的存活率受到抑制,差异有统计学意义(P<0.05); 在40.2~60.4 mmol/L范围内,葡萄糖浓度与HK-2 细胞存活率呈负相关(r=-0.91,P<0.05)。60.4 mmol/L浓度时, HK-2 细胞的存活率最低(图1)。结合文献和课题组前期实验[5, 7]结果, 本研究采用葡萄糖浓度40.2 mmol/L、培养48 h作为HK-2细胞的高糖损伤条件。

与17.5 mmol/L浓度相比, *P<0.05, **P<0.01, ***P<0.001。图1 不同浓度葡萄糖对HK-2细胞活力的影响(48 h)
2.2 ALA/LA降低糖损伤HK-2细胞的MCP-1水平
经高糖培养后,与正常对照组相比, HK-2细胞上清液MCP-1水平升高,差异有统计学意义(P<0.05)。给予糖损伤HK-2细胞100 μmol/L ALA 和 LA(A3组、L3组),50、100 μmol/L EPA(E2组、E3组)干预48 h后,细胞上清液MCP-1含量较高糖模型组降低,差异有统计学意义(P<0.05); 给予HK-2细胞终浓度为50 μmol/L 和100 μmol/L, 且比例为1∶4的ALA/LA混合液(M2组、M5组)作用48 h后,干预组HK-2细胞上清液MCP-1含量低于高糖模型组,差异有统计学意义(P<0.05)。其中,干预浓度为100 μmol/L, 比例为1∶4的ALA/LA混合液(M5组)的干预效果最佳。见图2。

N: 正常对照组; G: 高糖模型组; A1~A4: ALA干预组,干预物浓度分别为10、50、100、200 μmol/L; L1~L4: LA干预组,干预物浓度分别为10、50、100、200 μmol/L; E1~E4: EPA干预组,干预物浓度分别为10、50、100、200 μmol/L; M1~M3: ALA/LA混合干预组,干预物浓度为50 μmol/L, 混合比例分别为 1∶1、1∶4、1∶8; M4~M6: ALA/LA混合干预组,干预物浓度为100 μmol/L, 混合比例分别为 1∶1、1∶4、1∶8。与正常对照组相比, *P<0.05; 与高糖模型组相比, #P<0.05。图2 ALA/LA对糖损伤HK-2细胞MCP-1表达的影响
2.3 ALA/LA降低糖损伤HK-2细胞的TGF-β1水平
高糖培养后,与正常对照组细胞相比, HK-2细胞上清液TGF-β1水平升高,差异有统计学意义(P<0.05)。给予HK-2细胞100、200 μmol/L ALA(A3组、A4组), 100 μmol/L LA(L3组), 10、50、100、200 μmol/L EPA(E1组、E2组、E3组、E4组)干预48 h后,与高糖模型组相比,细胞上清液TGF-β1含量降低,差异有统计学意义(P<0.05); 另外给予HK-2细胞终浓度分别为50 μmol/L和100 μmol/L, 比例为1∶4的ALA/LA混合液(M2组、M5组)干预48 h后,细胞上清液TGF-β1含量均低于高糖模型组,差异有统计学意义(P<0.05)。其中, 100 μmol/L ALA(A3组)和100 μmol/L、比例为1∶4的ALA/LA混合液(M5组)对高糖损伤HK-2细胞的作用效果较好。见图3。
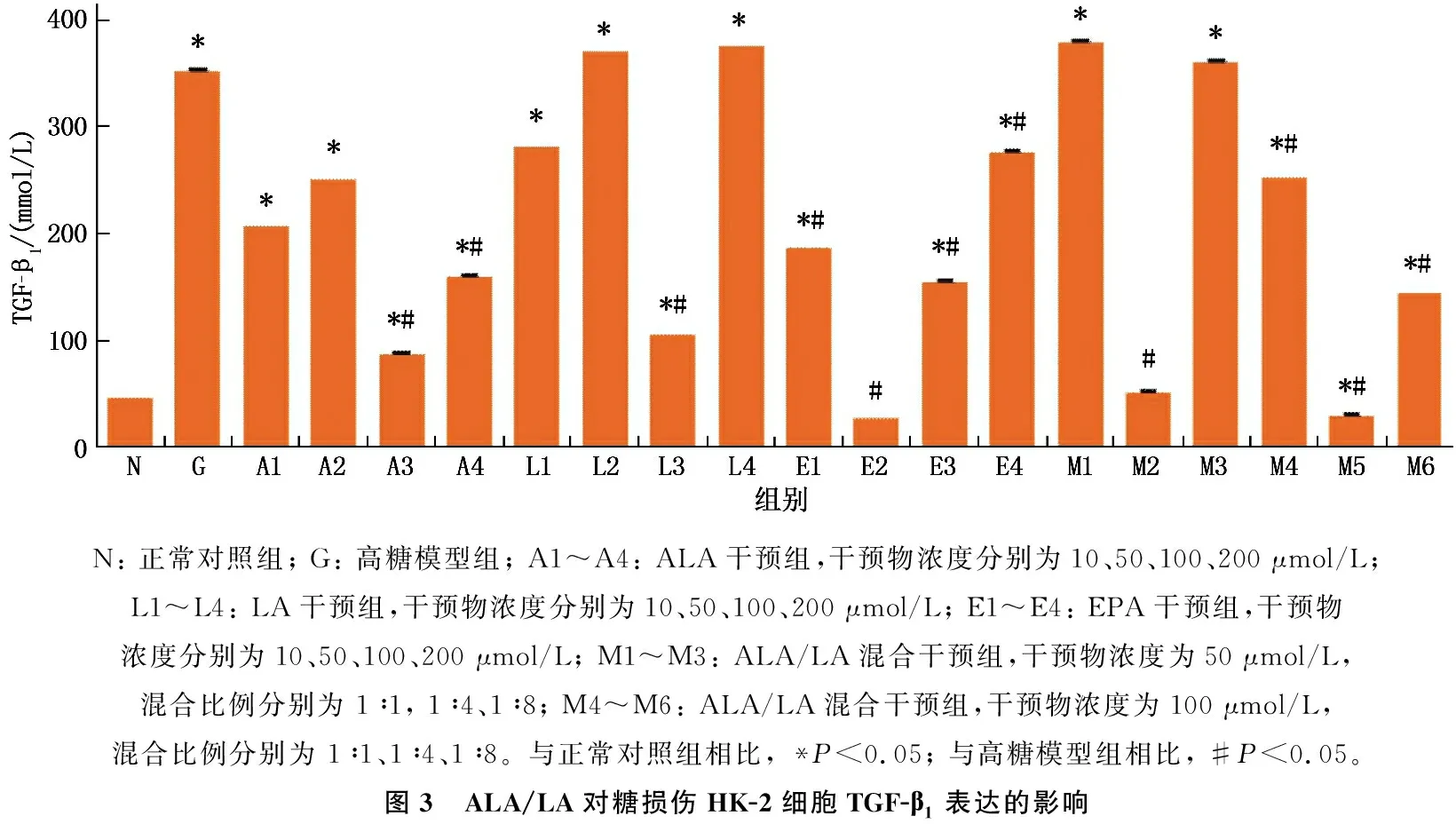
N: 正常对照组; G: 高糖模型组; A1~A4: ALA干预组,干预物浓度分别为10、50、100、200 μmol/L; L1~L4: LA干预组,干预物浓度分别为10、50、100、200 μmol/L; E1~E4: EPA干预组,干预物浓度分别为10、50、100、200 μmol/L; M1~M3: ALA/LA混合干预组,干预物浓度为50 μmol/L, 混合比例分别为 1∶1, 1∶4、1∶8; M4~M6: ALA/LA混合干预组,干预物浓度为100 μmol/L, 混合比例分别为 1∶1、1∶4、1∶8。与正常对照组相比, *P<0.05; 与高糖模型组相比, #P<0.05。图3 ALA/LA对糖损伤HK-2细胞TGF-β1表达的影响
2.4 ALA/LA降低糖损伤HK-2细胞的COL-Ⅰ水平
高糖培养后,与正常对照组相比,高糖模型组HK-2细胞上清液COL-Ⅰ水平升高,差异有统计学意义(P<0.05)。给予HK-2细胞100、200 μmol/L ALA(A3组、A4组), 10、50、100 μmol/L LA(L1组、L2组、L3组),10、50、100 μmol/L EPA(E1组、E2组、E3组)以及终浓度为50 μmol/L、比例为1∶4的ALA/LA混合液(M2组)干预48 h后,细胞上清液COL-Ⅰ含量均低于高糖模型组,差异有统计学意义(P<0.05)。见图4。
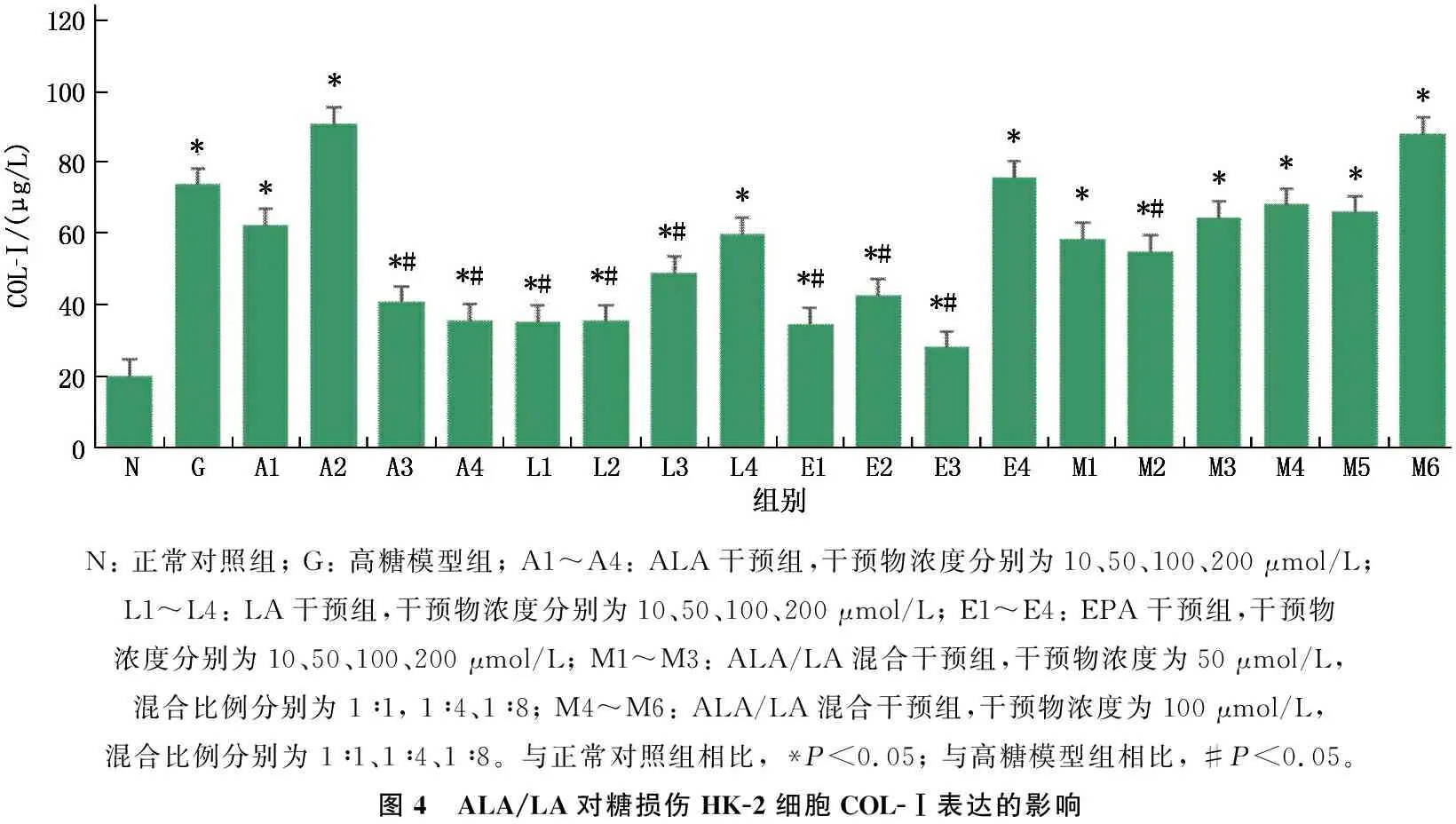
N: 正常对照组; G: 高糖模型组; A1~A4: ALA干预组,干预物浓度分别为10、50、100、200 μmol/L; L1~L4: LA干预组,干预物浓度分别为10、50、100、200 μmol/L; E1~E4: EPA干预组,干预物浓度分别为10、50、100、200 μmol/L; M1~M3: ALA/LA混合干预组,干预物浓度为50 μmol/L, 混合比例分别为 1∶1, 1∶4、1∶8; M4~M6: ALA/LA混合干预组,干预物浓度为100 μmol/L, 混合比例分别为 1∶1、1∶4、1∶8。与正常对照组相比, *P<0.05; 与高糖模型组相比, #P<0.05。图4 ALA/LA对糖损伤HK-2细胞COL-Ⅰ表达的影响
2.5 ALA/LA降低糖损伤HK-2细胞的MCP-1mRNA水平
与正常对照组相比,高糖模型组HK-2细胞MCP-1mRNA水平升高,差异有统计学意义(P<0.05)。给予HK-2细胞50 μmol/L ALA(A2组), 50、100 μmol/L LA(L2组、L3组)和100 μmol/L EPA(E3组),以及50、100 μmol/L比例为1∶4的ALA/LA(M2组、M5组)干预48 h后,与高糖模型组相比,细胞MCP-1mRNA水平下降,差异有统计学意义(P<0.05)。见图5。

A: MCP-1电泳图: B: MCP-1 mRNA相对表达量。N: 正常对照组; G: 高糖模型组; A2、A3: ALA干预组,干预物浓度分别为50、100 μmol/L; L2、L3: LA干预组,干预物浓度分别为50、100 μmol/L; E2、E3: EPA干预组,干预物浓度分别为50、100 μmol/L; M2、M5: ALA/LA混合干预组,干预物浓度为50、100 μmol/L, 混合比例为1∶4。与正常对照组相比, *P<0.05; 与高糖模型组相比, #P﹤0.05。图5 ALA/LA对糖损伤HK-2细胞MCP-1 mRNA表达的影响
2.6 ALA/LA降低糖损伤HK-2细胞的TGF-β1 mRNA水平
与正常对照组相比,高糖模型组HK-2细胞TGF-β1mRNA 水平升高,差异有统计学意义(P<0.05)。在前期实验的基础上,给予50、100 μmol/L的 ALA、LA和EPA(A2组、A3组、L2组、L3组、E2组、E3组)干预48 h后, HK-2细胞TGF-β1mRNA水平均低于高糖模型组,差异有统计学意义(P<0.05)。见图6。

A: TGF-β1电泳图: B: TGF-β1 mRNA相对表达量。N: 正常对照组; G: 高糖模型组; A2、A3: ALA干预组,干预物浓度分别为50、100 μmol/L; L2、L3: LA干预组,干预物浓度分别为50、100 μmol/L; E2、E3: EPA干预组,干预物浓度分别为50、100 μmol/L; M2、M5: ALA/LA,混合干预组干预物浓度为50、100 μmol/L, 混合比例为1∶4。与正常对照组相比, *P<0.05; 与高糖模型组相比, #P<0.05。图6 ALA/LA对糖损伤HK-2细胞TGF-β1 mRNA表达的影响
2.7 ALA/LA降低糖损伤HK-2细胞的COL-Ⅰ mRNA水平
高糖培养后, HK-2细胞COL-ⅠmRNA水平高于正常对照组,但差异无统计学意义(P>0.05)。在前期实验的基础上,给予糖损伤HK-2细胞100 μmol/L ALA(A3组)、50 μmol/L LA(L2组),以及终浓度为50 μmol/L、比例为1∶4的ALA/LA(M2组)混合液干预48 h后, HK-2细胞COL-ⅠmRNA水平低于高糖模型组,差异有统计学意义(P<0.05)。见图7。

A: COL-Ⅰ电泳图: B: COL-Ⅰ mRNA相对表达量。N: 正常对照组; G: 高糖模型组; A2、A3: ALA干预组,干预物浓度分别为50、100 μmol/L; L2、L3: LA干预组,干预物浓度分别为50、100 μmol/L; E2、E3: EPA干预组,干预物浓度分别为50、100 μmol/L; M2、M5: ALA/LA混合干预组,干预物浓度为50、100 μmol/L, 混合比例为1∶4。与高糖模型组相比, #P<0.05。图7 ALA/LA对糖损伤HK-2细胞COL-Ⅰ mRNA表达的影响
3 讨 论
COL-Ⅰ可在DKD进展过程中沉积于肾小球基底膜、系膜基质和肾小管间质。肾小管上皮细胞可通过分泌丰富的细胞外基质、细胞因子和黏附分子填充肾小管间质空间,并通过信号通路相互影响,损害肾实质细胞和重塑肾脏结构[10-12]。TGF-β信号系统可损害肾小管细胞完整性,导致肾小管萎缩,并通过诱导上皮细胞凋亡或自噬导致肾小管间质纤维化。本研究结果显示,高糖模型组HK-2细胞外液TGF-β1和COL-Ⅰ水平显著高于正常对照组(P<0.05), 提示高糖可刺激HK-2细胞分泌TGF-β1, 进而促进COL-Ⅰ生成。这与陈继业等[13]提出的观点一致,高糖可刺激HK-2细胞增强胶原和TGF-β1基因转录,导致肾小管基底膜增厚和肾小管间质组织学异常。
本研究结果进一步显示,经ALA、ALA/LA干预48 h后,高糖损伤HK-2细胞TGF-β1和COL-Ⅰ含量,以及细胞TGF-β1和COL-ⅠmRNA水平都较高糖模型组显著降低(P<0.05), 表明ALA/LA可延缓HK-2细胞的纤维化进程。ALA和LA为人体必需脂肪酸,具有抗氧化、抗炎、抗肿瘤等多种生理功能。本课题组前期实验结果表明, ALA/LA可提高糖损伤HK-2细胞的抗氧化酶活力,降低活性氧簇(ROS)的生成,提高HK-2细胞的抗氧化能力。ROS可激活TGF-β1信号通路,触发多种细胞分泌TGF-β1, 产生纤维化的作用。但ALA/LA通过抑制ROS的生成,下调TGF-β1的表达,延缓纤维化的作用机制还有待进一步研究。
肾脏的炎症因子和炎症状态对于促进DKD的发展和进展至关重要,是DKD的主要病理生理学参与者[14]。MCP-1是单核细胞的有效趋化因子,可影响DKD进程中单核细胞相关炎症的整个级联反应,包括从骨髓释放单核细胞,建立黏附和浸润的趋化因子梯度[8]。MCP-1和TGF-β1是相互作用的细胞因子, TGF-β1能刺激MCP-1在肾近端小管中的表达,引起巨噬细胞的浸润[15]。本研究结果显示, HK-2细胞在高糖环境下,MCP-1基因和MCP-1蛋白的表达量均显著增加(P<0.05)。且经ALA、ALA/LA干预48 h后,与高糖模型组相比, HK-2细胞MCP-1含量以及MCP-1mRNA水平显著降低(P<0.05), 证明一定剂量ALA、ALA/LA可从基因和蛋白水平抑制MCP-1的产生。因此,通过ALA/LA抑制MCP-1/TGF-β1的表达,下调COL-Ⅰ的生成,减缓HK-2细胞纤维化的进程,有望成为治疗DKD的新策略、新方法。

