信号蛋白3A对成肌细胞功能的影响及其转录调控机制
李上,徐子瑛,于子惠,冯韬锦,王中奇,李然,尹鹏滨,张里程,唐佩福*
1解放军医学院,北京 100853;2解放军总医院第四医学中心骨科医学部,北京 100048;3国家骨科与运动康复临床医学研究中心,北京 100853;4首都儿科研究所,北京 100020;5中国科学院北京基因组研究所(国家生物信息中心),北京 100101
骨骼肌干细胞又称卫星细胞,贮存于肌纤维基底膜下,在生理条件下多保持静息状态[1]。当骨骼肌受到损伤时,卫星细胞被激活,增殖、分化为成肌细胞并向损伤部位迁移,融合形成肌管,进而修复受损的肌组织[2]。有研究发现,骨骼肌损伤后卫星细胞中信号蛋白3A(semaphorin 3A,Sema3A)自分泌水平明显上调[3]。Sema3A是信号蛋白家族的一种分泌型信号蛋白,可作用于微管等细胞骨架结构,从而趋化导向神经轴突发育与再生,同时在肿瘤的发生发展、血管生成和通透性改变、免疫系统功能及骨代谢中承担着重要角色[4-5]。既往研究显示,Sema3A对于特定肌源性前体细胞亚群可发挥迁移导向作用,并调控肌纤维的类型,其表达缺失时成肌细胞功能状态受到显著影响[6-7]。本课题组前期研究表明,Sema3A对骨骼、血管及神经肌肉接头等组织的结构与功能具有协同调控能力,是肌、骨损伤修复中极具潜力的研究对象,但目前外源性Sema3A影响成肌细胞功能的研究鲜见[8-9]。本研究探讨Sema3A对成肌细胞功能的影响及其可能的转录调控机制,以期为后续骨骼肌损伤修复策略及相关材料学研究提供参考。
1 材料与方法
1.1 主要试剂及仪器 C 2 C 1 2 成肌细胞系(1101MOU-PUMC000099)购自中国医学科学院基础医学研究所细胞资源中心;胎牛血清、马血清、DMEM高糖培养基、胰蛋白酶、青-链霉素双抗购自美国Gibco公司;重组Sema3A蛋白购自中国义翘神州公司;RNA提取试剂盒、反转录试剂盒HiScript Ⅲ 1st Strand cDNA Synthesis Kit (+gDNA wiper)、实时荧光定量ChamQ Universal SYBR qPCR Master Mix试剂盒、VAHTS Universal V8 RNA-seq Library Prep Kit for Illumina、Ribo-off Globin & rRNA Depletion试剂盒购自南京诺唯赞生物科技股份有限公司。细胞计数仪购自美国Millipore Scepter公司;荧光定量PCR仪(CFX-96)购自美国Bio-Rad公司;IncuCyte ZOOM长时程动态活细胞成像及数据分析系统购自美国森西公司;Qubit 4.0荧光定量仪购自美国Thermo Fisher公司。
1.2 方法
1.2.1 细胞培养及分组 C2C12成肌细胞培养于含10%胎牛血清(FBS)、1%青-链霉素双抗的DMEM高糖培养基中(增殖培养基),置于37 ℃、5% CO2细胞培养箱中,每24 h进行细胞传代。根据文献[10-12]的方法,各实验组所用细胞培养基中重组Sema3A蛋白的终浓度分别为1.0 µg/ml、0.1 µg/ml、0.01 µg/ml,并设置对照组。
1.2.2 动态活细胞成像检测细胞增殖能力 取生长状态良好的成肌细胞,消化至细胞悬液,离心后重悬并使用Millipore Scepter细胞计数仪进行细胞计数,调整细胞浓度为2.5×103个/ml,接种于96孔板中,每孔200 µl。待细胞均匀贴壁后,依照实验分组将细胞培养基分别更换为含有重组Sema3A蛋白的增殖培养基。将96孔板置入IncuCyte ZOOM长时程动态活细胞成像系统培养箱中,每2 h进行1次拍摄,持续24 h后终止拍摄。所得图像数据使用IncuCyte Software中的Cell-By-Cell算法进行分析处理,对每孔中间区域进行四等分后计数并绘制增殖曲线。
1.2.3 划痕实验检测细胞迁移能力 取生长状态良好的成肌细胞接种于96孔板中(200 µl/孔,细胞浓度5×104个/ml)。待细胞生长密度达到100%后,使用IncuCyte细胞划痕器对细胞进行标准化伤口划痕,弃上清,用PBS清洗,依照实验分组将细胞培养基更换为含有重组Sema3A蛋白的DMEM高糖培养基。将96孔板置入IncuCyte ZOOM长时程动态活细胞成像系统培养箱中,每2 h进行1次拍摄,持续24 h后终止拍摄。所得图像数据使用IncuCyte Software进行分析处理,计算划痕愈合率并绘制伤口愈合曲线。
1.2.4 RT-qPCR检测成肌分化因子的表达 取生长状态良好的成肌细胞,待细胞融合度达到80%~90%后,更换为含2%马血清(HS)、1%青-链霉素双抗的DMEM高糖培养基(分化培养基),诱导各组成肌细胞分化培养72 h。利用Trizol裂解法提取成肌细胞总RNA,使用Qubit 4.0测定RNA浓度,行琼脂糖凝胶电泳评价RNA的完整度,IQ值达到5即可进行后续实验。
取1 µg RNA样本,使用HiScript Ⅲ 1st Strand cDNA Synthesis Kit (+gDNA wiper)进行gDNA去除及cDNA合成,取相同cDNA模板量与2× ChamQ Universal SYBR qPCR Master Mix试剂及目标引物混匀进行RT-qPCR。使用Bio-Rad CFX Manager软件进行处理分析,以2-ΔΔCt法计算目的基因相对表达水平。使用Primer Premier 6软件进行引物设计,引物序列如表1所示。
1.2.5 RNA提取及转录组测序分析 诱导1.0 µg/ml Sema3A组及对照组成肌细胞分化72 h,利用Trizol裂解法提取细胞总RNA,使用Qubit 4.0测定RNA浓度,行琼脂糖凝胶电泳评价RNA的完整度,IQ值达到8以上且浓度达到建库标准即可用于后续RNA文库构建。
利用Ribo-off rRNA Depletion kit去除rRNA。对剩余RNA进行定量后,利用VAHTS Universal V8 RNA-seq Library Prep Kit for Illumina进行链特异文库构建;最终磁珠筛选400 bp左右片段,并进行文库扩增。最终文库进行2100及RT-qPCR实际文库质量检测,合格后借助Illumina测序平台的Novaseq进行双端150 bp的RNA测序,每个样本10G数据量。
利用数据过滤软件Trimmomatic对数据中的读段进行处理,主要去除接头(adapter)序列和低质量序列等。其余读段使用HISAT2的小鼠参考基因组(mm10)进行基因组比对。对于每个样本,仅保留比对质量分数≥20的唯一读段用于后续分析。使用HT Seq Python (0.9.1)计算每个基因的唯一比对读段。基因表达以FPKM(Fragments Per Kilobase per Million)进行量化,并用于相关性分析。采用R-package DEseq2分析1.0 µg/ml Sema3A组与对照组之间的差异表达基因,fold-change cut-off=1.0,Pvalue cut-off=0.05。利用R-package Cluster Profiler对基因进行GO(Gene Ontology)功能富集分析,保留显著富集且P<0.05的GO通路。
1.2.6 RT-qPCR验证差异基因的表达 诱导1.0 µg/ml Sema3A组及对照组成肌细胞分化72 h,采用RTqPCR对部分差异表达基因进行验证,操作步骤同1.2.4。引物序列如表1所示。
1.3 统计学处理 采用GraphPad Prism 8.0软件进行统计分析。计量资料以表示,两组间比较采用t检验,多组间比较采用单因素方差分析(one-way ANOVA),进一步两两比较采用Turkey法。P<0.05为差异有统计学意义。
2 结 果
2.1 Sema3A对成肌细胞增殖和迁移能力的影响IncuCyte细胞成像计数显示,成肌细胞计数随着重组Sema3A蛋白浓度增高而增加,其中1.0 µg/ml Sema3A组细胞计数较对照组增加17.36%(P<0.001,图1A)。培养24 h后,1.0 µg/ml Sema3A组成肌细胞计数[(1464.19±29.72)个]明显高于0.1 µg/ml Sema3A组[(1397.69±49.50)个,P<0.001]、0.01 µg/ml Sema3A组[(1381.11±35.18)个,P<0.001]和对照组[(1247.58±26.55)个,P<0.001],0.1 µg/ml Sema3A组与0.01 µg/ml Sema3A组细胞计数均明显高于对照组(P<0.001),但两组间差异无统计学意义(P>0.05)。
划痕实验结果显示,成肌细胞划痕愈合率随着重组Sema3A蛋白浓度增高而增高,其中1.0 µg/ml Sema3A组划痕愈合率较对照组升高69.66%(P<0.001,图1B)。划痕24 h后,1.0 µg/ml Sema3A组划痕愈合率(86.46%±3.09%)明显高于0.1 µg/ml Sema3A组(78.51%±5.32%,P<0.001)、0.01 µg/ml Sema3A组(73.81%±3.54%,P<0.001)和对照组(50.96%±2.50%,P<0.001),0.1 µg/ml Sema3A组与0.01 µg/ml Sema3A组划痕愈合率均明显高于对照组(P<0.001),同时0.1 µg/ml Sema3A组划痕愈合率高于0.01 µg/ml Sema3A组(P<0.05)。
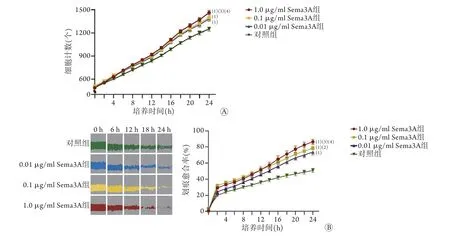
图1 Sema3A对成肌细胞增殖与迁移能力的影响Fig.1 Effects of Sema3A on proliferation and migration of myoblasts
2.2 Sema3A对成肌细胞分化相关基因表达的影响 RT-qPCR检测结果显示,Sema3A可上调成肌分化相关基因Myf5、MyoG的表达(P<0.05,图2)。与对照组比较,各浓度(0.01、0.1、1.0 µg/ml) Sema3A组Myf5mRNA相对表达量分别升高25.21%±1.89%、34.02%±5.78%、37.47%±11.67%(P<0.05或P<0.01),1.0 µg/ml Sema3A组MyoGmRNA相对表达量升高26.57%±11.31%(P<0.05)。各浓度(0.01、0.1、1.0 µg/ml)Sema3A组MyoDmRNA相对表达量呈上升趋势,但与对照组比较差异无统计学意义(P>0.05)。

图2 Sema3A对成肌细胞Myf5、MyoG和MyoD基因表达的影响Fig.2 Effects of Sema3A on the expressions of Myf5, MyoG and MyoD of myoblasts
2.3 Sema3A对成肌细胞基因转录组表达的影响为了进一步探索Sema3A影响成肌细胞功能状态的机制,对1.0 µg/ml Sema3A干预24 h的成肌细胞与对照组细胞进行去核糖体链特异转录组测序(n=3),结果显示,样本转录组的组内相关性较好,组间差异较大(图3A);与对照组细胞转录组比较,1.0 µg/ml Sema3A组有1101个基因表达上调,974个基因表达下调,两组间总体表达谱差异较大(图3B)。1.0 µg/ml Sema3A组上、下调基因见附加材料。

图3 Sema3A对成肌细胞基因转录组表达的影响Fig.3 Effect of Sema3A on the transcription profile of myoblasts
GO功能富集分析结果显示,1.0 µg/ml Sema3A组成肌细胞的上调通路显著富集于调控肌细胞与肌纤维发育、细胞与解剖结构成熟等与骨骼肌发育显著相关的功能通路,以及骨与软骨细胞增殖、成骨分化及骨矿化成熟等骨形成相关的功能通路(图4A);而下调通路主要富集于调控脂蛋白、乳糜微粒等脂代谢相关的功能通路(图4B)。

图4 Sema3A刺激成肌细胞后差异表达基因的GO富集通路Fig.4 The GO enrichment pathway of differentially expressed genes stimulated by Sema3A in myoblasts
基于生物信息学分析获得的差异表达基因,对其中部分参与多个富集通路的Prox1、Myh11、IHH、LipC、ApoC2基因在转录水平进行验证,结果显示,与对照组比较,1.0 µg/ml Sema3A组Prox1、Myh11mRNA相对表达量升高22.48%±14.42%(P<0.05)、21.42%±5.81%(P<0.01),LipC、ApoC2mRNA相对表达量降低23.08%±15.38%(P<0.05)、55.97%±26.51%(P<0.05),而两组IHHmRNA相对表达量差异无统计学意义(P>0.05) (图5)。
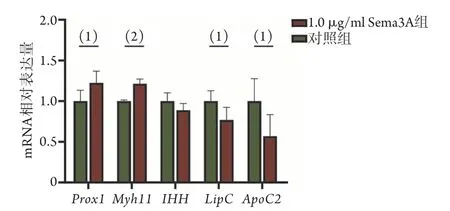
图5 RT-qPCR检测部分差异基因表达水平Fig.5 Expression levels of partial differentially expressed genes detected by RT-qPCR
3 讨 论
骨骼肌承担着机体运动与能量代谢等多种重要功能,结构表浅且力学负荷高,易受损伤[13-14]。损伤后骨骼肌纤维的再生修复主要依赖骨骼肌卫星细胞,其功能改变或缺失可使骨骼肌发生纤维化、脂肪沉积等一系列病理改变,严重损害骨骼肌的收缩、代谢等功能,导致肌力下降、衰弱,严重时可致残,导致社会劳动力损失[15-16]。有研究发现,Sema3A与卫星细胞功能和骨骼肌损伤之间存在密切联系[6]。Sema3A在成肌细胞早期分化阶段表达上调,且对于特定的卫星细胞亚群具有迁移导向作用[7,17-18];当骨骼肌发生损伤时,卫星细胞受局部微环境调控可上调Sema3A的表达及自分泌水平,并进一步参与再生骨骼肌纤维类型的分布等[3,19];Sema3A对骨骼与骨骼肌内血管、神经和免疫细胞等组织均具有调控能力,可能是促进肌、骨损伤后结构再生与功能恢复的重要潜在靶点[20-22]。
本研究使用重组Sema3A蛋白在体外刺激成肌细胞,发现Sema3A蛋白可促进成肌细胞的增殖与迁移,且在0.01~1.0 µg/ml浓度区间呈浓度依赖性。既往研究发现,卫星细胞微环境中的肝细胞生长因子(hepatocyte growth factor,HGF)、成纤维细胞生长因子2(fibroblast growth factor 2,FGF2)均可促使卫星细胞激活后Sema3A表达上调,而转化生长因子-β(transforming growth factor-β,TGF-β)可抑制成肌细胞融合与肌纤维再生,同时下调卫星细胞中Sema3A的表达[23-24]。使用Sema3A-siRNA转染后成肌细胞增殖能力下降,而Sema3A过表达可使Pax7+/MyoD+增殖型成肌细胞增多[25],与本研究结果趋势相符。Sema3A由于可调控细胞骨架的解聚而影响多种细胞的迁移能力,如肿瘤细胞转移、树突状细胞迁移和血管通透性等[26-28]。既往研究发现,Sema3A对特定骨骼肌前体细胞亚群具有迁移导向作用[7]。Sema3A在Ⅰ、Ⅱa型肌纤维中呈高表达,并可作为排斥因子使扭曲蛋白2阳性(Twist2+)骨骼肌干细胞亚群避免与Ⅰ、Ⅱa型肌纤维相融合,发挥与在神经系统中相似的排斥功能[7]。
为探讨Sema3A对成肌细胞分化能力的影响,本研究使用含有梯度浓度重组Sema3A蛋白的分化培养基诱导培养成肌细胞,发现成肌细胞中Myf5、MyoG基因表达较对照组明显升高,MyoD基因表达呈上升趋势,但与对照组无明显差异。Myf5、MyoD及MyoG的基本结构相同,均属于成肌调节因子家族(myogenic regulatory factor family)中的转录因子成员,在胚胎发生过程中及出生后协同调控骨骼肌的发育,且各转录因子间相互调节[29]。既往研究显示,特异性敲除Sema3A可使卫星细胞中部分分化相关基因表达下调,但不影响成肌细胞的融合;过表达Sema3A可使Myf5表达上调,但不影响MyoD的表达[19]。在肌细胞分化过程中,成肌调节因子可被顺序激活,其中MyoD在分化中晚期表达上调而发挥转录调节作用[30],因此,本研究在成肌细胞体外培养过程中未发现Sema3A对其表达水平的显著影响。
本研究生物信息学分析发现,Sema3A可使成肌细胞转录表达谱发生明显改变,其中上调基因显著富集于肌细胞与肌纤维发育、细胞与解剖结构成熟等相关通路,与细胞增殖实验结果相符;下调基因主要富集于调控脂蛋白、乳糜微粒等脂代谢相关通路。有研究发现,脂肪细胞在肌肉中异位沉积可干扰骨骼肌的再生质量并使其功能受损[31]。
本研究对部分富集通路中的差异表达基因在mRNA水平进行验证,结果显示,1.0 µg/ml Sema3A组Prox1、Myh11基因表达上调。在小鼠及人类骨骼肌中,Prox1基因是成肌细胞分化和Ⅰ型肌纤维形成的重要因子,在卫星细胞Sema3A特异性敲除小鼠骨骼肌中Ⅰ型肌纤维比例减少且卫星细胞成肌分化受损[32]。由此可见,Prox1可能作为Sema3A干预成肌细胞后激活的转录因子,参与调控成肌细胞的分化及骨骼肌纤维类型的分布。不同于Prox1,Myh11主要在平滑肌中表达,参与血管、尿道等器官中肌组织的形成[33]。MYH家族参与机体所有肌肉组织的形成及再生,但Myh11基因对骨骼肌功能的影响鲜见报道,其在1.0 µg/ml Sema3A组中表达升高可能与骨骼肌血管再生存在联系。
本研究发现,ApoC2、LipC基因在1.0 µg/ml Sema3A组中表达下调。ApoC2基因编码一种脂质结合蛋白,可促进三酰甘油水解以为细胞提供游离脂肪酸,有研究报道,ApoC2基因表达水平与骨骼肌质量呈负相关[34];在二甲双胍促进脂肪酸氧化的过程中,成肌细胞中ApoC2表达呈下调趋势[35]。LipC基因编码肝三酰甘油脂肪酶,在乳糜微粒及脂蛋白代谢中起重要作用,参与骨骼肌脂肪酸的代谢[36]。损伤骨骼肌中脂肪累积可严重损害再生骨骼肌的结构与功能[31]。Sema3A下调成肌细胞中ApoC2、LipC基因的表达或可减少游离脂肪酸的形成,从而避免再生骨骼肌中的脂肪异位沉积[37]。间充质干细胞及肌源性前体细胞均具有成脂分化的潜能,脂代谢相关通路及ApoC2、LipC基因表达下调是否与再生肌组织中干细胞的成脂分化减少相关尚有待进一步探索。
IHH是一种重要的骨源性因子,在骨骼代谢稳态中不可或缺。作为骨骼的附着组织,肌肉在其发生及发育过程中依赖骨骼,而当IHH过表达时,肌肉质量明显增高而不影响长骨长度,表明IHH可独立于骨骼长度的变化而调节肌肉质量[38]。在胚胎发生过程中,肌肉与骨骼发育的时间和空间接近,当IHH表达缺失时,骨骼肌发育在胚胎期约第14天出现异常,至胚胎期约第21天后肢体肌肉发生明显缺失[38]。也有研究发现,IHH在损伤骨骼肌的血管再生中发挥重要功能,高度参与肌骨运动系统的功能稳态[39]。本研究转录组测序分析发现IHH基因表达上调,这可能是Sema3A参与调控成肌细胞功能的重要机制,但后续RT-qPCR检测未观察到1.0 µg/ml Sema3A组与对照组间存在转录水平的差异,需要进一步研究加以验证。此外,《自然》等杂志多次发文揭示Sema3A通过调控感觉神经长入、促进成骨细胞趋化及活性、抑制破骨细胞分化与成熟等机制发挥骨保护作用[40-42]。本研究发现,Sema3A可上调成肌细胞中与骨细胞增殖、分化及骨矿化成熟相关的功能通路,与本课题组前期研究结果一致[20,43]。既往有研究提出,Sema3A可能通过延迟损伤骨骼肌的早期神经再支配而调节骨骼肌神经、血管等组织的协调再生,促进骨骼肌损伤修复[44],为Sema3A在骨骼肌中的相关研究提供了新的思路。
综上所述,本研究发现,Sema3A可提高成肌细胞的增殖、迁移能力且呈浓度依赖性,并能上调部分成肌分化相关基因的表达。Sema3A可上调肌、骨细胞发育及成熟等相关功能通路,下调部分脂蛋白代谢相关通路,表明外源性Sema3A可能通过促进肌纤维修复,调节损伤局部组织结构微环境,以及减少损伤骨骼肌的脂质异位沉积而改善再生骨骼肌的质量。但目前Sema3A调控成肌细胞功能关键基因的具体机制及其在体内的具体作用仍有待进一步探索。

