纤细裸藻共栖细菌的分离鉴定及其对藻细胞生长的影响
汪笑宇,任舒天,吴雅婷,武尊,高浩峰,邵蓬
纤细裸藻共栖细菌的分离鉴定及其对藻细胞生长的影响
汪笑宇1,任舒天2,吴雅婷2,武尊2,高浩峰2,邵蓬2,通信作者
(1. 天津市水产研究所,天津 300221;2. 天津农学院水产学院,天津 300392)
以纤细裸藻()为研究对象,对纤细裸藻共栖细菌进行分离及鉴定,并探究可培养共栖细菌对纤细裸藻生长的影响。采用平板划线法和16S rDNA基因测序对藻共栖细菌进行分离鉴定,得到5种纤细裸藻的可培养藻际细菌,E1-、E3-、E5-、E6-和ET2-,分别属于α-变形菌纲、β-变形菌纲和放线菌门三大门类。将纤细裸藻分别与五株菌共培养,通过测定纤细裸藻的藻细胞密度与叶绿素a含量,发现E1、E3与E5对纤细裸藻的生长均有促进作用,其中E5的促进效果最好;E5初始接种浓度为107cfu/mL、纤细裸藻初始藻细胞密度为1×105cells/mL时对纤细裸藻的生长促进效果最佳。
纤细裸藻;藻际细菌;藻菌共培养
水环境中的微藻与其共栖细菌,也称为藻际细菌,共同组成了浮游生物群落[1],这些浮游生物之间的相互作用影响着碳循环,进而影响了水生生态系统。藻类在生长繁殖过程中不断向其周围环境分泌多种代谢产物如脂质、多糖、氨基酸等有机物,细菌受这些藻生长过程中释放的代谢产物影响及诱导,存留在藻细胞周围,形成了藻菌共栖群落[2]。而细菌通过分解有机物质提供给藻类碳源,调节藻类生长。因此探究藻类和细菌之间的相互作用关系,以促进微藻生长为目的构建藻类与细菌共培养体系十分有意义。
纤细裸藻()是一种单细胞真核微藻,主要存活于淡水中,能够进行光合自养、异养以及光照条件下兼性异养[3]。纤细裸藻具有丰富的营养物质如维生素、矿物质元素、脂肪酸和氨基酸,能够在光合自养条件下合成裸藻特有的由不溶性β-1,3-葡聚糖聚合的裸藻多糖,在医疗、保健、工业及可再生能源等领域都有较高的研究价值[4]。纤细裸藻没有细胞壁,作为水产动物的生物饵料,内含的丰富营养物质更容易被消化吸收[5]。目前鲜有关于纤细裸藻藻际细菌的研究报道,本研究分离了纤细裸藻藻际细菌,并对细菌进行了鉴定,同时研究了细菌对纤细裸藻生长的影响,以期为藻菌共培养体系的构建提供理论基础。
1 材料与方法
1.1 试验材料
本试验所用纤细裸藻藻种由天津市水产生态及养殖重点实验室藻种库提供。采用AF-6培养基培养。
1.2 纤细裸藻可培养藻际细菌分离鉴定
1.2.1 纤细裸藻藻际细菌分离
在无菌条件下,吸取处于平台期的纤细裸藻藻液1 mL,用梯度稀释法将藻液进行稀释,稀释倍数为10-1~10-6,分别取10-3~10-6的4个梯度稀释液各200 μL涂布于TSA培养皿中,后将培养皿置于28 ℃恒温培养箱中培养。培养5~7 d后,利用平板划线法挑取不同形态的单菌落于TSA培养皿上进行分离纯化培养。
1.2.2 可培养藻际细菌分子鉴定
通过16S rDNA基因序列分析鉴定菌株,PCR扩增后将PCR产物送至生工生物工程股份有限公司进行纯化及测序。测序序列进行拼接后得到细菌 16S rDNA全长序列,将其提交至GenBank(https://www.ncbi.nlm.nih.gov/genbank/),在NCBI上通过BLAST进行比对,选取同源性高的16S rRNA序列下载,用Clustalx进行多序列比对分析后,用MEGA 7.0采用邻接法(N-J)构建系统发育树,自举值(Bootstrap)为1 000。
1.3 可培养藻际细菌对纤细裸藻生长的影响
1.3.1 纤细裸藻纯化
利用平板划线及抗生素处理的培养方法对纤细裸藻进行分离和纯化。无菌条件下,将终浓度为200 μg/mL的青霉素溶液加入到对数生长期的纤细裸藻藻液中[6],置于设定条件为光照强度55 μmol/(m2•s)、光周期12 D∶12 L、温度25 ℃的光照培养箱中进行培养。7 d后用接种针蘸取藻液,平板划线至AF-6固体培养基中,待长出微藻藻落后,挑取单藻落至灭菌的AF-6液体培养基中,放置于相同条件光照培养箱中扩大培养。
1.3.2 纤细裸藻与不同藻际细菌共培养
分别取OD600=0.5的五种细菌菌液各1 mL,接种于含99 mL对数生长期的纤细裸藻藻液中,纤细裸藻初始细胞密度为1×105cells/mL。向藻液中加入无菌AF-6液体培养基1 mL作为对照组,每组设3个平行。通过对纤细裸藻细胞密度与叶绿素a含量测定来反应纤细裸藻的生长情况。该试验的总周期为10 d,每隔2 d进行取样并对试验指标进行测定。藻细胞密度测定采用血球计数法;叶绿素a测定采用丙酮法。
1.3.3 纤细裸藻生长优势菌初始接种浓度优化
取对纤细裸藻生长有正向影响且效果最好的细菌为试验菌株。菌体的初始接种终浓度分别设为108、107、106、105、104cfu/mL 5个不同梯度,各取1 mL接种到含99 mL对数生长期的纤细裸藻藻液中,纤细裸藻初始细胞密度为1×105cells/mL。将向藻液中加入无菌AF-6培养基的处理组设为对照组,每组设3个平行。试验周期共计10 d,每隔2 d取样,测定纤细裸藻细胞密度及叶绿素a含量。
1.4 数据统计
数据采用SPSS 19.0软件进行单因素方差分析(ANOVA),采用SigmaPlot 10.0绘制图形。
2 结果与分析
2.1 纤细裸藻藻际细菌分离鉴定
从纤细裸藻藻液中共分离出细菌12株,分别扩增其16S rDNA 序列并测序。测序结果通过Blast进行比对,并去除重复序列后共累计得到5株不同的细菌,E1为(MG_576012),E3为s(NR_036824),E5为(NR_043612),E6为(AF_ 488779),ET2为(MH_497612)。纤细裸藻中分离出的5株细菌在TSA平板上形成的单菌落形态,见图1。

图1 细菌纯化培养菌落图
2.2 可培养藻际细菌系统发育树建立
将从纤细裸藻藻液中分离得到的5株细菌经过16S rDNA测序后得到的序列分别与NCBI上相似度最高的16S rDNA细菌基因组序列进行比对后,用邻接法(N-J)为细菌构建系统进化树,见图2。经过各序列之间比对和分析后,藻液中分离得出的细菌分别属于α-变形菌纲(α-Proteobacteria)、β-变形菌纲(β-Proteobacteria)和放线菌门(Actinobacteria)三大类。

图2 纤细裸藻藻际细菌16S rDNA 序列与NCBI上相近序列构建的系统进化树
2.3 5种藻菌共培养体系下纤细裸藻细胞密度变化
纤细裸藻分别与分离得到的5株藻际细菌E1、E3、E5、E6、ET2进行共培养,各细菌共培养处理组对纤细裸藻细胞密度的影响如图3所示,以纤细裸藻藻液为对照组CK。试验期间纤细裸藻各处理组的细胞密度均呈现显著上升趋势。在藻与5种细菌共培养的第十天,藻际细菌E1、E3和E5 3个处理组的纤细裸藻细胞密度均与对照组具有显著性差异(<0.05),3个处理组中藻细胞密度比较为E5>E3>E1。E5处理组的藻细胞密度最高达到了4.1×105cells/mL,是对照组的1.4倍。E6、ET2处理组与对照组相比无显著差异。

图3 5种藻菌共培养体系下纤细裸藻细胞密度
注:小写字母分别表示各组数据与0 d对照组差异显著(<0.05)。下同
2.4 5种藻菌共培养体系下纤细裸藻叶绿素a含量的变化
纤细裸藻和5种藻际可培养细菌的共培养体系下藻细胞的叶绿素a含量变化情况见图4。纤细裸藻的藻细胞叶绿素a含量变化趋势与共培养体系下纤细裸藻的细胞密度变化趋势基本相同。试验期间纤细裸藻的叶绿素a含量呈现显著上升趋势。在共培养的第十天,藻际细菌E1、E3和E5处理组均与对照组有显著差异(<0.05),3个处理组藻细胞的叶绿素a含量大小为E5>E3>E1,E6与ET2处理组与对照组无显著性差异。E5处理组对纤细裸藻叶绿素a含量的促进效果最好,是对照组叶绿素a含量的1.38倍。
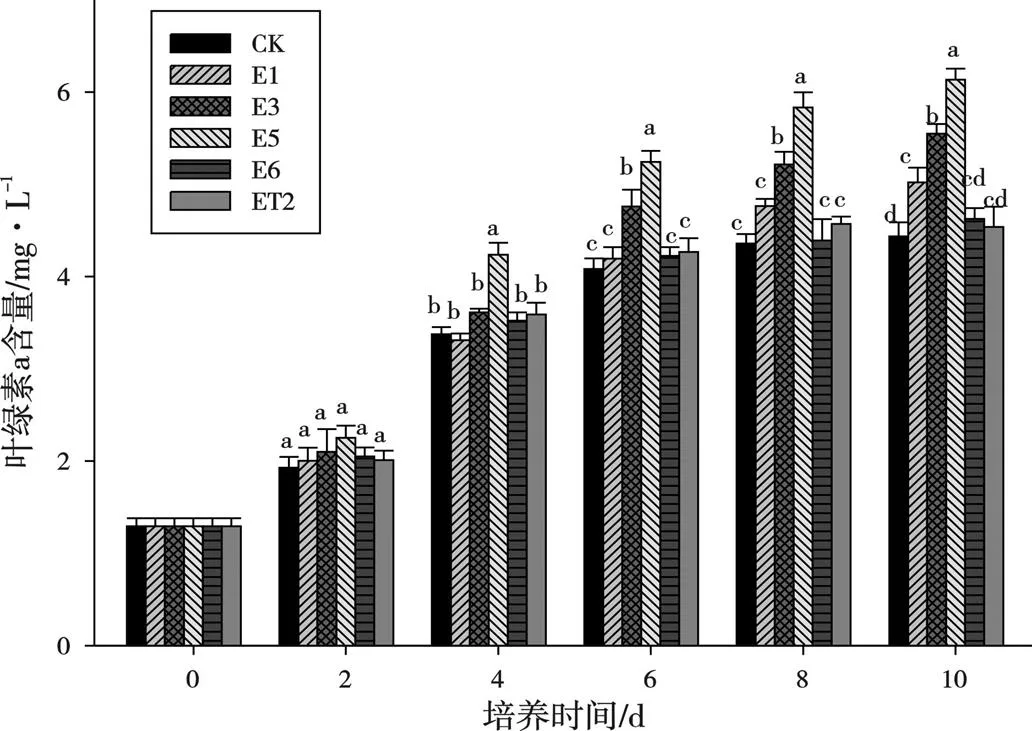
图4 5种藻菌共培养体系下纤细裸藻叶绿素a含量
2.5 不同初始菌接种浓度对纤细裸藻细胞密度的影响
通过2.3与2.4的试验结果综合分析可得,细菌E5对纤细裸藻生长和发育具有最佳的正向影响效果,因此选取E5细菌来构建纤细裸藻与细菌的共培养体系。不同的E5接种初始浓度对纤细裸藻藻细胞密度的影响见图5,在10 d时,各处理组与对照组之间均有显著性差异(<0.05),其中107cfu/mL处理组藻细胞密度与对照组差异最显著(<0.05),达到了5.2×105cells/mL,为对照组的1.6倍。
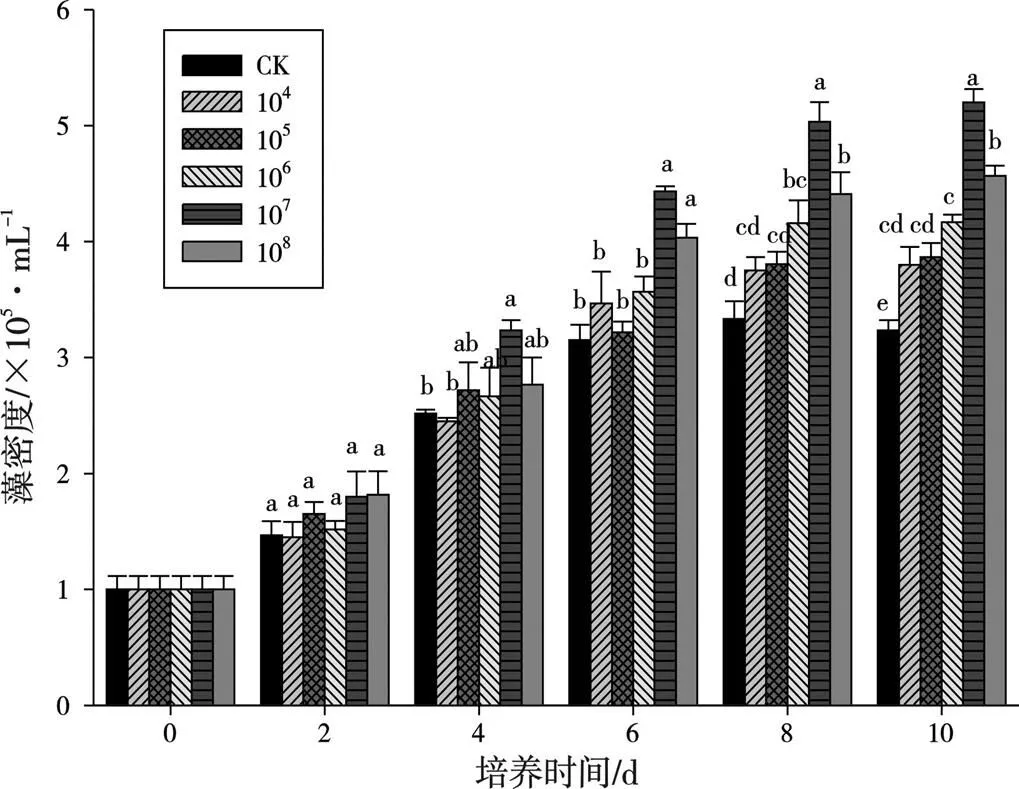
图5 不同E5初始接种浓度下纤细裸藻细胞密度
2.6 不同初始菌接种浓度对纤细裸藻叶绿素a含量的影响
E5细菌的不同初始接种浓度对纤细裸藻的藻细胞叶绿素a含量的影响见图6。藻细胞叶绿素a含量的变化与相同处理下纤细裸藻的藻细胞密度的变化趋势基本相同。第十天时,各处理组的藻细胞叶绿素a含量与空白对照组之间均有显著性差异(<0.05),其中107cfu/mL处理组与空白对照组之间的差异最显著,纤细裸藻叶绿素a含量为对照组的1.5倍。

图6 不同E5初始接种浓度下纤细裸藻叶绿素a含量
3 讨论
3.1 纤细裸藻可培养藻际细菌的分类
自然条件中微藻通过生物群落之间各种群复杂的相互作用维持生态稳定。而实验室条件与天然的水环境完全不同,首先微藻的生长环境是人工模拟的,其营养来源为人工配置的营养成分均衡的培养基。其次微藻在实验室生长环境中是单一藻种,与天然的水环境中生物群落的构成存在很大程度的不同。在实验室培养条件下,纤细裸藻生长环境中产生的代谢物与纤细裸藻高度相关,因此能够留存在纤细裸藻藻液中的细菌也与藻类有着密切的联系,两者之间有着活跃的物质交换。这种特性无形中对藻类相关性强的细菌进行了初步筛选,使得后续分离出的细菌对藻类有明显作用效果的可能性增加,与有着庞大繁杂生物群落的自然环境相比更加高效。
本文从纤细裸藻藻液中分离出可培养的细菌是从未添加有机碳源的纤细裸藻培养液中分离培养得到的,因此我们推测分离出的细菌能够利用纤细裸藻生长过程中释放的有机碳源来进行生长发育。KAZAMIA等[7]共培养了绿藻和细菌,也证实在藻菌共栖群落中,前者给细菌提供碳源以换取其他营养物质。FALKOWSKI等[8]也发现,细菌依赖于浮游植物光合作用产生有机碳,再转化为无机物以支持藻类生长。本研究分离出可培养的细菌共5种,将其归类为α-变形菌纲、β-变形菌纲及放线菌门3个大类。从藻液中分离出的可培养细菌主要分布的类群为变形菌纲。CHEVANTON等[9]也发现杜氏盐藻的藻际可培养细菌分布的类群大致可分为α-变形菌纲、γ-变形菌纲、噬胞菌-黄杆菌-拟杆菌群()及以革兰氏阳性菌为代表的放线菌门。其主要的菌群种类分布与本研究虽略有不同,但仍然具有很高的相似性和重合度。CHO等[10]在研究小球藻的可培养藻际细菌时,共分离出14种不同的藻际细菌。这14种藻际细菌总体分布情况可归类为4个不同的生物门类,放线菌门、α-变形菌门、β-变形菌门及噬胞菌-黄杆菌-拟杆菌群,总体中占比较大的还是α-变形菌门。黄振华等[11]在对角毛藻和扁藻的藻际细菌分布及构成的研究中发现,角毛藻的藻际细菌分布中α-变形菌纲和γ-变形菌纲的数量占总比的一半以上,扁藻藻际细菌也大范围分布在α-变形菌纲、β-变形菌纲和γ-变形菌纲这几大类群中。可见藻际细菌的种类与藻种密切相关。而STEVEN等[12]研究发现,变形菌门中α、β和γ变形菌纲的细菌主要存在于水环境中。因此生活在河水或海洋的微藻,其藻际细菌的主要分布类群为变形菌门这一研究被发现也就不难解释了。
3.2 可培养藻际细菌对纤细裸藻生长的影响
试验发现,分离出的五株纤细裸藻藻际细菌与藻共培养后对藻的细胞密度均没有抑制效果,推测原因可能为实验室所培养的纤细裸藻经过长时间的转代培养,且藻际细菌与藻细胞长期共存,对纤细裸藻生长有抑制效果的菌株在纤细裸藻的培养过程中逐渐消失。E5()、E3(s)和E1()三株细菌对纤细裸藻的细胞密度均具有显著促进效果,其中E5细菌的促进效果是最佳的。E5细菌是鞘氨醇单胞菌属的细菌,目前已明确记录的鞘氨醇单胞菌属细菌大约有131种,是从各种不同的环境如土壤环境[13]、富营养化水体中的沉积物[14]和制药实验室中空气环境[15]等中分离得到的。KIM等[16]通过研究发现了一株鞘氨醇菌属细菌在对水稻的生长发育方面具有促进效果,在一定程度上也支撑了本试验的研究结果。E6()与ET2()两株菌对纤细裸藻的细胞密度没有明显促进作用。不同细菌分泌的代谢物质不同,推测是这些代谢物质的差异导致其对纤细裸藻的细胞密度呈现出不同的作用效果。
不同的E5初始接种浓度对纤细裸藻细胞密度增加均有一定的促进效果。不同的菌浓度对纤细裸藻细胞密度的促进效果不同,在一定范围内促进效果的增加随菌种初始浓度的增加而增加,表现为促进效果在105~107cfu/mL浓度之间是递加的。本试验中对纤细裸藻细胞密度促进效果最佳的E5初始接种浓度为107cfu/mL,在浓度高于这个数值时,促进效果较107cfu/mL浓度时有所下降。JEON等[17]也发现一株假单胞杆菌不同浓度对纤细裸藻的促进效果在一定范围内随菌种浓度增加而增加,在高于最佳促进浓度之后促进结果有所下降,这与本试验结果相同。在10 d时,107cfu/mL浓度组纤细裸藻叶绿素a含量较前一天仍呈增加趋势,对照组却基本没有变化,推测为最佳E5浓度处理组与纤细裸藻共培养体系中藻类的生长周期和对照组相比有所延长。LEE等[18]在关于细菌对绿藻生长影响的研究中也提出了类似的观点。他提出造成这种结果的原因可能是细菌提供了外源生长素,从而对藻生长产生了影响。
4 结论
(1)纤细裸藻可培养藻际细菌共分离出5 株,分别为E1-、E3-、E5-、E6-和ET2-。
(2)E1、E3与E5细菌对纤细裸藻生长均有促进作用,E5的促进效果最好;当E5细菌初始浓度为107cfu/mL、纤细裸藻初始藻细胞密度为 1×105cells/mL时促进效果最佳。
[1] SARMENTO H,GASOL J M. Use of phytoplankton-derived dissolved organic carbon by different types of bacterioplankton[J]. Environmental Microbiology,2012,14(9):2348-2360.
[2] 高亚辉. 海洋微藻分类生态及生物活性物质研究[J]. 厦门大学学报(自然科学版),2001,40(2):566-573.
[3] FUJITA T,AOYAGI H,OGBONNA J C,et al. Effect of mixed organic substrate on α-tocopherol production byphotoheterotrophic culture[J]. Applied Microbiology & Biotechnology,2008,79(3):371-378.
[4] NOVAK M,VETVICKA V. β-Glucans,history,and the present:immunomodulatory aspects and mechanisms of action[J]. Journal of Immunotoxicology,2008,20(5):47-57.
[5] IRINA M,IVANOVA,SERGEY A,et a1. Fluorescentmannosides serve as acceptor substrates for glycosyltransferase and sagar-1-phosphate transferase activities inmembranes[J]. Carbohydrate Research,2017,483:26-38.
[6] 张文慧,窦勇,高金伟,等. 纤细裸藻对5种抗生素的胁迫响应[J]. 水生态学杂志,2017,38(6):48-56.
[7] KAZAMIA E,CZESNICK H,NGUYEN T V,et al. Mutualistic interactions between vitamin B12-dependent algae and heterotrophic bacteria exhibit regulation[J]. Environmental Microbiology,2012,14(483):1466-1476.
[8] FALKOWSKI P G,FENCHEL T,DELONG E F. The microbial enginesthat drive earth’s biogeochemical cycles[J]. Science,2008,320(5879):1034-1039.
[9] CHEVANTON I,GARNIER M,BOUGARAN G,et al. Screening and selection of growth-promoting bacteria forcultures[J]. Algal Research,2013,2(3):212-222.
[10] CHO D H,RAMANAN R,HEO J,et al. Enhancing microalgal biomass productivity by engineering a microalgal– bacterial community[J]. Bioresource Technology,2015,175(7):578-585.
[11] 黄振华,陈星星,柯爱英,等. 2种海洋饵料微藻藻际环境的细菌多样性研究[J]. 水生态学杂志,2018,39(1):44-49.
[12] STEVEN S H,STOBNER M,SIMON M,et al. Phylogeny ofandfrom oxic habitats of a tidal flat ecosystem[J]. FEMS Microbiology Ecology,2005,54(7):351-365.
[13] KIM S J,MOON J Y,LIM J M,et al.sp. nov. andsp. nov. isolated from air and soil,respectively[J]. International Journal of Systematic & Evolutionary Microbiology,2014,64(3):926-932.
[14] HUY H,JIN L,LEE K C,et al.sp. nov.,isolated from sediment of a eutrophic reservoir[J]. Int J Syst Evol Microbiol,2014,64(8):1412-1418.
[15] PARK H K,HAN J H,KIM T S,et al.sp. nov. from indoor air of a pharmaceutical environment[J]. Antonie van Leeuwenhoek,2015,107(1):47-53.
[16] KIM Y J,LIM J,SUKWEENADHI J,et al. Genomic characterization of a newly isolatedpanacis reveals plant growth promoting effect to rice[J]. Biotechnology and Bioprocess Engineering,2019,24(2):119-125.
[17] JEON M S,OH J J,Kim J Y,et al. Enhancement of growth and paramylon production ofby co-cultivation withsp. MEBiC 03485[J]. Bioresource Technology,2019,288(9):1-8.
[18] LEE C,JEON M S,KIM J Y,et al. Effects of an auxin-producing symbiotic bacterium on cell growth of the microalga:Elevation of cell density and prolongation of exponential stage[J]. Algal Research,2019,41(8):1-8.
Isolation of symbiotic bacteria ofand effects on the growth of algal cells
Wang Xiaoyu1, Ren Shutian2, Wu Yating2, Wu Zun2, Gao Haofeng2, Shao Peng2, Corresponding Author
(1. Tianjin Fisheries Research Institute, Tianjin 300221, China; 2. College of Fisheries, Tianjin Agricultural University, Tianjin 300392, China)
The symbiotic bacteria ofwere isolated, and the influence of symbiotic bacteria on the growth ofwas studied. The symbiotic bacteria were isolated by plate scribing and identified by 16S rDNA gene sequencing. Five species of symbiotic bacteria were obtained, E1-, E3-, E5-, E6-and ET2-, which belong to α-Proteobacteria, β-Proteobacteria and Actinobacteria, respectively. The results demonstrated that E1, E3 and E5 could enhance the growth ofby measuring the cell density and chlorophyll content of algae in co-culture systems of bacteria and algae, and that E5 had the best effect. The promoting effect ofwas best when initial inoculation concentration of E5 bacterium was 107cfu/mL and the initial cell density ofwas 1×105cells/mL.
; symbiotic bacteria; co-culture of bacteria and algae
1008-5394(2022)02-0057-06
10.19640/j.cnki.jtau.2022.02.012
S917.1
A
责任编辑:张爱婷

