α-半乳糖苷酶A基因敲除猪胎儿成纤维细胞系的建立
冷允俊,刘晓蕊,李琳,王盈,杨海元,戴一凡
(南京医科大学江苏省异种移植重点实验室,南京 211166)
Fabry病,又称弥漫性血管角质瘤,是一种X连锁隐性遗传的溶酶体贮积病,致病基因为α-半乳糖苷酶A(α-galactosidase A,GLA)基因,位于Xq22.1,由7个外显子和6个内含子构成[1]。GLA基因编码α-Gal A,该酶位于溶酶体内,是一种同源二聚体蛋白,为神经酰胺三己糖苷(globotriaosylceramide,Gb3)分解代谢所必须。GLA基因的突变可引起α-Gal A功能部分或完全丧失,导致其代谢底物Gb3和相关鞘糖脂在人体的各器官、组织内积聚,造成多系统损害[2]。流行病学研究[3]显示,Fabry病的患病率为1 ∶117 000~1 ∶40 000,但这一患病率可能被低估,在一些国家的新生儿筛查中,患病率在1 ∶8 882~1 ∶1 368之间[4]。一项荷兰的队列研究[5]显示,受影响男性和女性的预期寿命的中位数分别为57岁和72岁。目前,Fabry病尚无治愈方法,主要采用人工重组α-Gal A治疗[6-7]。
目前,Fabry病的动物模型只有小鼠和大鼠,而小鼠和大鼠距离人类的亲缘关系较远,不能很好地复制Fabry病的病理过程。猪是除灵长类动物外与人类亲缘关系最近的物种之一,其解剖结构、生理生化指标、药物代谢和疾病发生发展等与人类十分相似。因此,猪是Fabry病模型的良好选择。建立人类Fabry病猪模型,有助于研究该病的病理过程,筛选药物和寻找特异性的生物标志等[8-9]。本研究通过生物信息学分析,比较了人/猪α-Gal A的相似性,并鉴别了猪α-Gal A的催化残基位置,为Fabry病猪模型的构建提供了理论支持;利用CRISPR/Cas9技术构建了GLA基因敲除的巴马公猪胎儿成纤维细胞(porcine fetal fibroblasts,PFFs),为构建Fabry病动物模型提供实验材料。
1 材料与方法
1.1 材料
1.1.1 细胞:35 d的巴马公猪PFFs为本实验室留存。
1.1.2 主要试剂与仪器:pX330质粒(货号42230)购自美国Addgene公司;DH5α感受态细胞和质粒抽提试剂盒均购自天根生化科技(北京)有限公司;BbsⅠ限制性内切酶、T4 DNA连接酶和T7E1酶均购自美国New England Biolabs公司;Basic NucleofectorTMKits购自德国Lonza公司;DMEM培养液、G418药物、胎牛血清、0.25%胰蛋白酶、青链霉素双抗和DPBS缓冲液均购自美国赛默飞世尔科技公司。单孔细胞核转染仪购自德国Lonza公司;生物安全柜购自美国赛默飞世尔科技公司。引物合成与DNA测序由生工生物工程(上海)股份有限公司完成。
1.2 方法
1.2.1 人/猪α-Gal A的生物信息学分析:在NCBI数据库(https://www.ncbi.nlm.nih.gov/)中下载包括人和猪在内的16个物种的α-Gal A的氨基酸序列,采用MEGA X软件绘制系统进化树。采用DNAMAN软件对人和猪α-Gal A氨基酸序列进行比对,再用BLAST在线工具(http://blast.ncbi.nlm.nih.gov/Blast.cgi)中的Global Align程序计算二者的一致性和相似性。采用DNASTAR软件中的Protein模块,对人/猪α-Gal A进行二级结构分析,使用Chou-Fasman算法预测人/猪α-Gal A的α螺旋、β折叠、β转角的比例。使用 Swiss Model在线工具(https://swissmodel.expasy.org/)对人/猪α-Gal A进行三维结构模拟,然后采用PyMOL软件比较两者三维结构的相似度,计算均方根偏差(root mean square displacement,RMSD)值。
1.2.2 猪α-Gal A催化残基的鉴别:使用在线工具BLAST中的CD-search程序,寻找猪α-Gal A的结构域和催化残基。输入猪α-Gal A的氨基酸序列,数据库选择保守结构域数据库(conserved domain database,CDD),为避免假阳性的出现,E值选择默认值0.01。
1.2.3 CRISPR/Cas9的靶点设计和打靶载体构建:根据NCBI数据库中的GLA基因序列,针对第三外显子设计扩增引物(反向引物序列为CCTGCCTGGAG TGTTTTTCTC;正向引物序列为TACTGAGGAAAGC CAGGGATG),进行PCR扩增测序,确定真实序列与数据库中GLA基因的差异。为确保酶完全失活,根据在线工具CRISPOR(http://crispor.tefor.net/),在编码催化残基前的区域设计单链向导RNA(single guide RNA,sgRNA),并设计Oligo合成(GLA_sgRNA反向引物序列为CACCGTTGATCTGCTCAAATTCGA,GLA_sgRNA正向引物序列为AAACTCGAATTTGAGCAGA TCAAC)。载体构建的步骤包括引物退火、载体酶切和连接。用去离子水将sgRNA Oligo稀释至100 μmol/L。反应体系包括正链Oligo 1 μL,负链Oligo 1 μL,去离子水8 μL。37℃ 30 min,95 ℃ 5 min,再以-5 ℃/min的速度降至25 ℃。用BbsⅠ限制性内切酶对pX330质粒进行线性化,连接退火产物,转化入DH5α感受态细胞。挑取单菌落,测序鉴定。对连接成功的菌株进行扩增,利用试剂盒提取质粒。
1.2.4 细胞转染与单克隆细胞的筛选:在6 cm培养皿内复苏原代巴马猪PFFs(约2.6×106个),用含16%胎牛血清的全培养基(42 mL DMEM培养液、8 mL胎牛血清和500 μL青链霉素双抗),38.5 ℃、5% CO2的条件下培养约24 h,至细胞融合度达到90%以上。用0.05%胰酶消化2 min,1 200 r/min离心收集细胞。取5 μg打靶载体pX330-GLA和1 μg抗性质粒pHY54 SV40-neo,按照Lonza核转染试剂盒说明书转染细胞,程序为U-023。转染结束后,将细胞分盘至10 cm培养皿中,密度控制在4倍镜视野下细胞数约为30~40个。细胞培养24 h后,加1 mg/mL G418进行筛选。根据细胞状态降低药物浓度,药物筛选约9~12 d,四倍镜下观察细胞状态,单克隆长满1个四倍镜视野时,用记号笔在皿底圈出。DPBS清洗2遍,在标记处放置克隆环,加入0.25%胰蛋白酶,消化约2 min。无药全培养基终止消化,细胞悬液移至24孔板中,待细胞长满后,消化至12孔板中培养。留部分细胞在24孔板中继续培养,长满后消化并用NP40裂解细胞,提取基因组DNA用于PCR测序鉴定。
1.2.5 T7E1酶切法检测突变效率:将转染后未分盘的细胞放入6 cm培养皿中,24 h后换药培养,待细胞长满后,消化提取基因组。PCR扩增并回收目的片段。T7E1酶切体系包括纯化产物200 ng,10×NEB Buffer 2 2 μL,去离子水补至19 μL。PCR仪中退火,95 ℃ 5 min,-2 ℃/s,降至85 ℃;-0.1 ℃/s,降至25℃;4 ℃保存。体系中加入1 μL T7E1酶,37 ℃孵育15 min。之后每管加入4 μL 6×loading buffer,2%琼脂糖凝胶电泳1.5 h。计算突变效率,InDel(%)=[1-(1-裂解产物占比)1/2]×100。
2 结果
2.1 人/猪α-Gal A的相似性
用MEGA X软件绘制系统进化树,结果显示,与小鼠、大鼠和多种常见家畜相比,猪的进化距离与人更近(图1)。二者的氨基酸序列一致性为81%,相似性为89%。使用Chou-Fasman算法预测的人/猪α-Gal A的二级结构比例结果显示,人α-Gal A的α螺旋占29.4%,β折叠占19.8%,β转角占35.4%;猪α-Gal A的α螺旋占28.9%,β折叠占21.5%,β转角占35.1%(图2B)。二级结构的比例和排布十分相似,提示其三维结构也可能极其相似。采用Swiss Model在线工具对人/猪α-Gal A进行三维建模,再利用PyMOL软件比较两者三维结构的相似度,结果显示,RMSD值为0.012,亦说明其三维结构极其相似(图2C)。通过生物信息学分析发现人/猪α-Gal A在结构上高度相似,推测猪α-Gal A的功能和特征也可能与人高度相似,还需在体水平进一步验证。
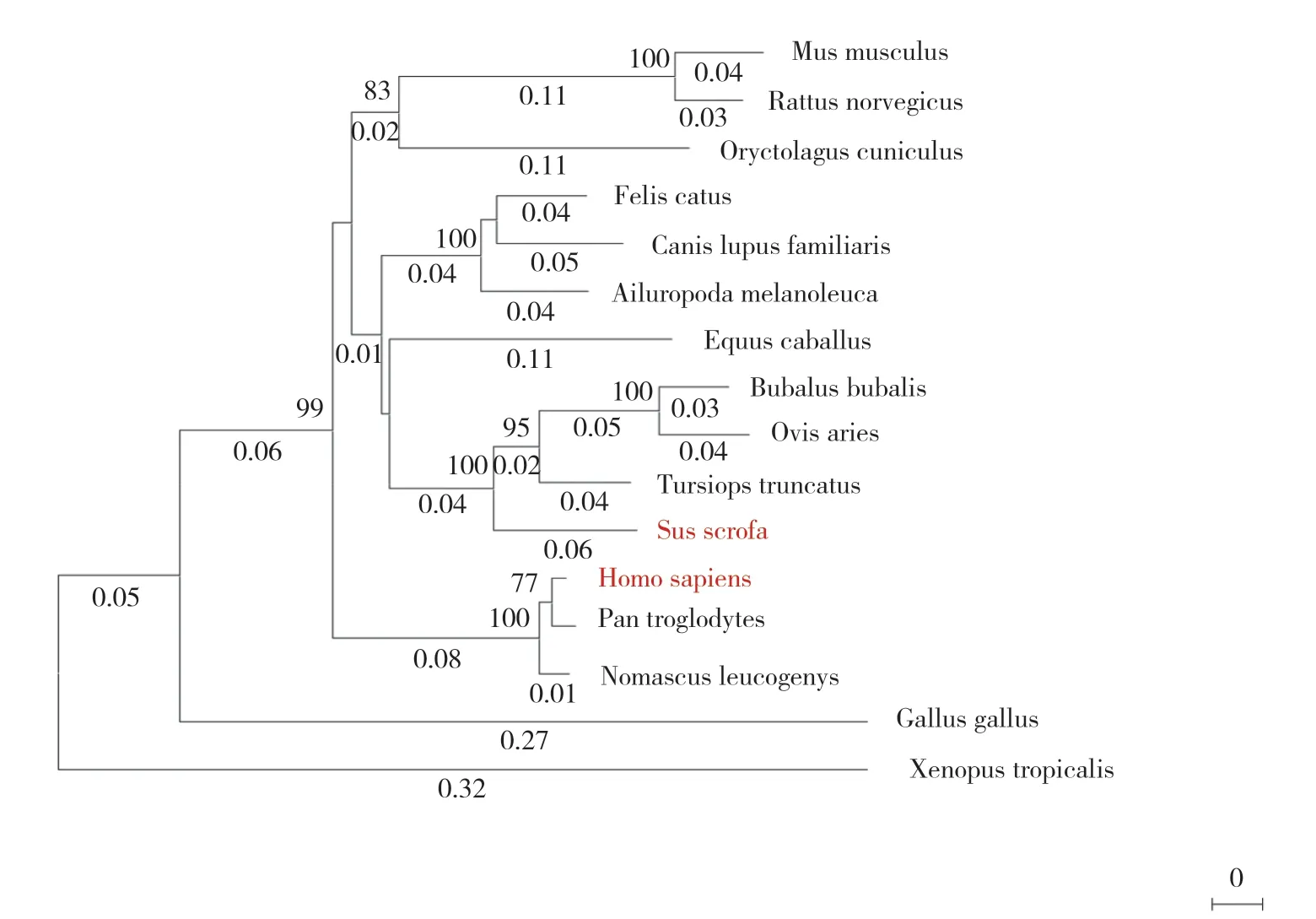
图1 不同物种α-Gal A的系统进化树Fig.1 Phylogenetic tree of α-Gal A in different species

图2 人/猪α-Gal A的一级、二级和三级结构分析Fig.2 Analysis of α-galactosidase A primary,secondary,and three-dimensional structures between human and pig
2.2 猪α-Gal A催化残基的鉴别
人α-Gal A的结构已被揭示,是一种同源二聚体蛋白,每个单体由2个结构域组成,分别是含有活性位点的一个(β/α)8桶状结构域和一个靠近C端含8条反向平行β折叠的结构域[10]。通过BLAST的CDsearch程序查询,找到猪α-Gal A的结构域也有2个,分别是43~326位残基的含活性位点的结构域和靠近C端的329~415位残基的结构域(图3A)。糖苷酶的催化机制是通过双重置换催化机制实现的,其中人α-Gal A的2次亲核攻击来自于第170位和第231位的天冬氨酸,对应于猪则是第174位和第235位的天冬氨酸(图3B)[10-11]。

图3 猪α-Gal A的结构域和催化残基的鉴别Fig.3 Identification of domains and catalytic residues of pig α-Gal A
2.3 CRISPR/Cas9打靶载体的构建
为确保猪GLA基因编码的α-Gal A完全失活,选择在编码第174位催化残基前的外显子区设计sgRNA[12]。测序结果如图4所示,pX330载体中成功插入了猪GLA基因靶点的sgRNA序列。
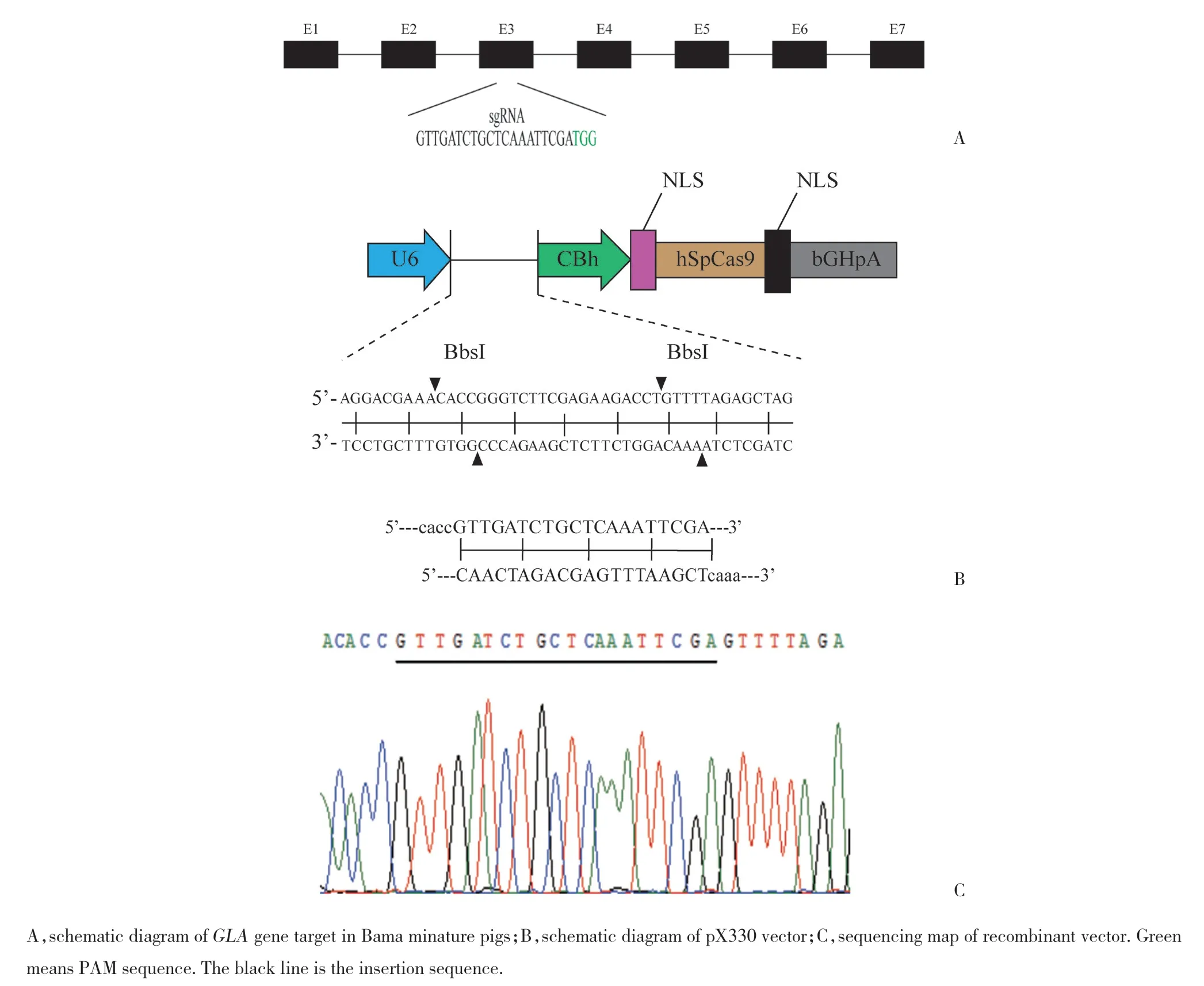
图4 GLA基因靶点和重组载体测序Fig.4 Target of GLA gene and sequencing of recombinant vectors
2.4 GLA基因敲除细胞系的鉴定
经测序鉴定,共获得52个阳性单克隆细胞。图5和表1展示了5种突变型,均造成移码突变,导致编码催化残基的区域被破坏。

表1 GLA敲除PFFs的基因型Tab.1 Genotypes of GLA-knockout PFFs

图5 GLA敲除PFFs的测序结果Fig.5 Sequencing results of GLA-knockout PFFs
2.5 T7E1酶切实验验证sgRNA的突变效率
PCR产物退火,再经过T7E1酶切后行凝胶电泳,结果显示目的片段被切成2段(图6)。通过公式计算得出突变效率为17.17%。
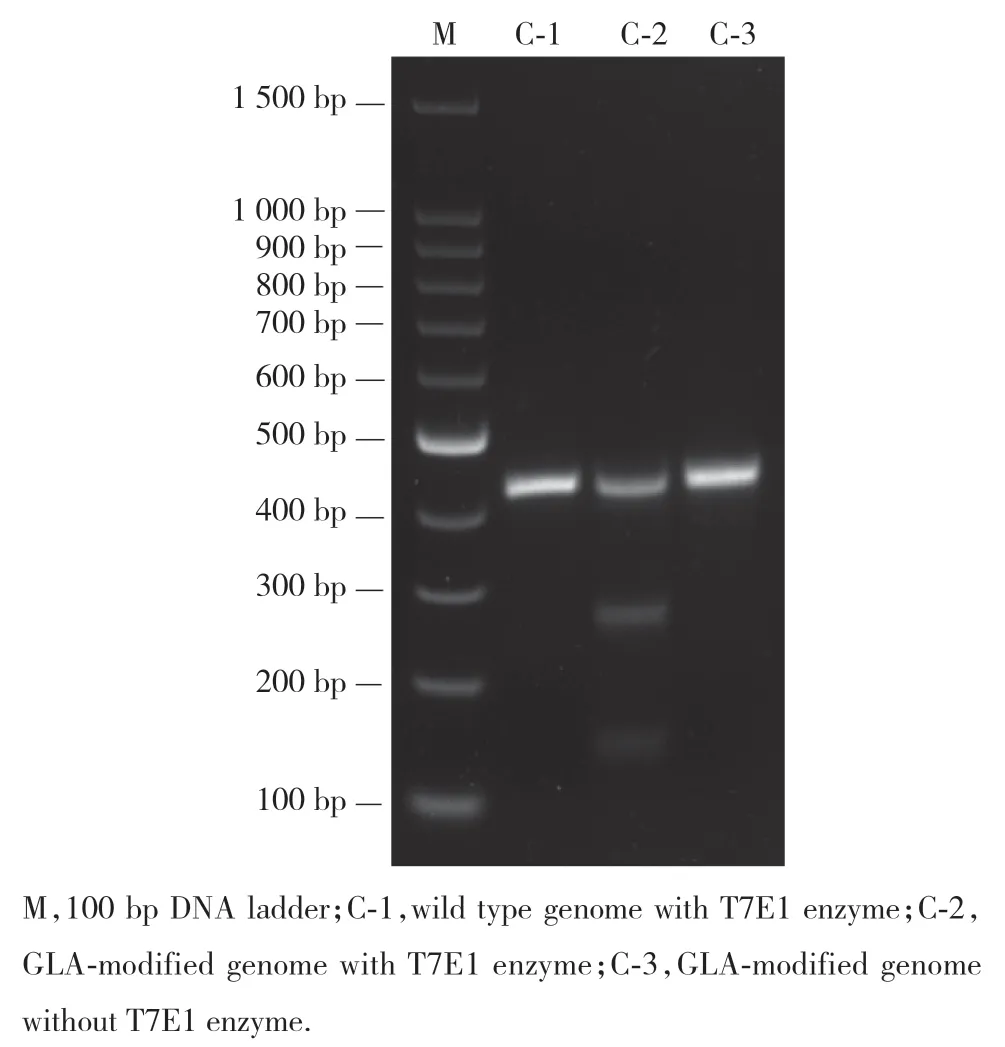
图6 sgRNA突变效率的T7E1酶切验证Fig.6 T7E1 cleavage assay of sgRNA mutation efficiency
3 讨论
Fabry病是一种X连锁的溶酶体贮积病。目前,Fabry病的动物模型只有小鼠和大鼠,但其病理表现,如血管角质瘤、眼部和脑血管等并发症均表现不完全[13-15]。因此,开发一种更好的动物模型有助于深入研究Fabry病的病理机制和诊疗策略。猪的心血管系统、消化系统、皮肤、营养需要、骨骼发育及矿物质代谢等与人相似,体型大小与人接近,繁殖数量多,周期短,是极佳的模型动物[16]。猪模型不仅能很好地复制多种小鼠不能准确和全面体现的人类疾病,还能提供更好的后期实验或试药条件[17-18]。本实验室已制备了ApoE基因敲除猪,成功复制了动脉粥样硬化模型[19]。还实现了GGTA1、β4GalNT2和CMAH三基因敲除的猪,为异种移植提供了可能[20]。
由于GLA基因位于X染色体,本研究选择巴马公猪的细胞进行敲除,以避免杂合敲除的情况。本研究利用生物信息学方法对人/猪GLA基因编码的α-Gal A相似性进行分析,并鉴定出猪α-Gal A的催化残基位置。为确保酶完全失活,通过在线工具在猪α-Gal A编码催化残基前的外显子区制造移码突变,成功构建CRISPR/Cas9打靶载体,将打靶载体与抗性质粒共转染至巴马公猪胎儿PFFs,用G418药物筛选出单克隆细胞,并行PCR测序鉴定其基因型。结果显示,人/猪α-Gal A的氨基酸序列一致性为81%,相似性为89%;三维结构的RMSD值为0.012。猪α-Gal A的催化残基是第174位和第235位的天冬氨酸。
综上所述,本研究成功地构建了GLA基因敲除的巴马公猪PFFs,为后续体细胞核移植和胚胎移植提供了供体细胞,为构建人类Fabry病猪模型奠定了研究基础,为人类Fabry病的进一步探索提供了合适的动物模型。
——一道江苏高考题的奥秘解读和拓展

