大豆肽缓解小鼠体力疲劳的功能评价
于亚莉,蒲奕灵,高绿莎,孙冰玉,仲大业,高 峰*
(1 吉林大学食品科学与工程学院 长春 130062 2 吉林省四平市粮食物资管理中心 吉林四平 136000 3 吉林大学体育学院 长春 130062)
疲劳(Fatigue)是一种普遍的医学和神经学上的症状[1],指躯体在生理活动过程中不能开始或持续某一特定强度的活动状态[2],包括神经性疲劳、运动性疲劳及心理性疲劳。其中,运动性疲劳又称体力疲劳,多指人在进行重体力劳动、大运动量锻炼时,由于时间过长,肌肉过度紧张,生物能源消耗过多,导致机体产生疲劳感,表现为全身或局部酸、软、痛,疲乏无力和“力不从心”。长期的体力疲劳会危害人体正常生理机能,导致内分泌紊乱,免疫力下降,继而出现器质性疾病,影响健康[3]。近些年,国内外学者研究表明,肽、多糖、氨基酸、维生素、多酚类物质、生物碱等天然活性物质具有缓解体力疲劳的功效。
大豆是中国重要粮食作物之一,其中含有30%~60%的蛋白质[4]。大豆蛋白质经蛋白酶作用即可获得大豆蛋白质的水解产物——大豆多肽。大豆多肽的必需氨基酸含量丰富且平衡,具有易被人体消化吸收的优点[5]。研究表明,大豆多肽具有抗氧化、降血糖、调节血脂等多种生物活性[6-7],然而,对于缓解小鼠体力疲劳方面的研究尚未见报道。本文以大豆多肽为研究对象,构建急性疲劳与D-半乳糖亚急性衰老2 种动物实验模型。在2种模型下,开展大豆肽对小鼠负重游泳(WLS)时间、小鼠血清或肝脏中血清尿素氮 (Serum urea nitrogen,BUN)、血乳酸(Blood lactic acid,LD)、糖原、糖原合成酶(Glycogen synthetase,GS)、总过氧化物酶(Total peroxidase,T-SOD)、丙二醛(Malondialdehyde,MDA)、磷酸肌酸激酶(Creatine phosphate kinase,CPK)生化指标的影响研究,以期为大豆多肽在功能食品中的应用及产品开发提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
1.1.1 试剂 大豆肽(相对分子质量为875)由吉林大学食品科学与工程学院营养与功能食品实验室制备,ICR 小鼠(雄性)由长春亿斯实验动物中心提供。谷胱甘肽(GSH)溶液,上海复旦复华药业有限公司;人参肽(西洋参蛋白口服液),广东长兴生物科技有限公司。尿素氮(BUN)测试盒、乳酸(LD)测试盒、糖原测试盒、总过氧化物歧化酶(TSOD)测试盒、丙二醛(MDA)测试盒,南京建成生物工程研究所;糖原合成酶(GS)测试盒,上海江莱生物科技有限公司;磷酸肌酸激酶(CPK)测试盒,上海邦奕生物科技有限公司。以上测试盒均于4 ℃保存。冰醋酸、浓硫酸,天津市津东天正精细化学试剂厂,以上试剂均为分析纯级。
1.1.2 实验动物及饲养条件 健康SPF 级ICR雄性小鼠,体重(18±2)g,长春亿斯实验动物中心,实验动物生产许可证编号SCXK 2014-0007;实验环境温度20~25 ℃,湿度40%~50%,人工照明12 h/d,通风良好,小鼠自由摄食与饮水,每隔2 d对鼠笼垫料进行彻底更换,保持环境干燥、清洁。
1.1.3 实验动物饲料 “益生”牌小鼠生长繁殖用配合颗粒饲料,成分分析见表1;饮水为煮沸冷却后蒸馏水。

表1 小鼠饲料成分分析(%)Table 1 Ingredients analysis of mice feed(%)
1.1.4 仪器与设备 AG204 电子天平,瑞士METTLER TOLEDO;CR20B2 超速冷冻离心机,日本日立公司;FD-1 型真空冷冻干燥机,北京博医康技术公司;CS501 超级恒温水浴锅,上海锦屏仪器有限公司;Synergy HT 多功能酶标仪,美国伯腾仪器有限公司。
1.2 方法
1.2.1 动物分组与喂养 实验前,小鼠在动物房进行适应性喂养3~4 d。
急性疲劳小鼠模型的建立:实验选取66 只ICR 雄性小鼠,共设6 组,每组小鼠11 只,将自适应喂养后的小鼠进行力竭式游泳训练,于小鼠尾部负体重6%的铅皮,每天游2 h,如发现力竭表现(小鼠从入水至头部没入水中7 s 不能上浮),捞出水面休息5 min 后继续训练至满2 h,实验进行5周,注射和灌胃在每天上午8 点钟准时开始,实验结束后按动物试验3R 原则以小鼠人道关怀。详细情况见表2。

表2 急性疲劳模型实验动物分组Table 2 Experimental animal grouping of acute fatigue model
D-半乳糖亚急性衰老小鼠模型的建立:实验选取77 只ICR 雄性小鼠,共设7 组,每组小鼠11只,将自适应性喂养后的小鼠除阴性对照组外均采用腹腔注射灭菌D-半乳糖,以构建衰老模型小鼠,阴性对照组注射等体积的蒸馏水,实验进行5周,注射和灌胃在每天上午8 点钟准时开始,实验结束后按动物试验3R 原则以小鼠人道关怀。详细情况见表3。

表3 D-半乳糖亚急性衰老模型实验动物分组Table 3 Experimental animal grouping of D-galactose subacute aging model
两模型中的GSH 组和人参肽组均为阳性对照组。GSH 作为一种良好的抗氧化剂,可以帮助机体清除自由基和过氧化物,从而达到维持生物体的相对稳定。人参肽属于生物活性肽(BAP)的一种,对生物机体的生命活动或具有生理作用[8]。经研究证实,人参肽具有耐缺氧作用,并且能在一定程度上延缓实验小鼠疲劳的产生和加速疲劳的消除[9-11]。
1.2.2 负重游泳实验 实验5 周后,于末次处理30 min 后,在6 组小鼠尾部分别绑上体重6%的铅皮,进行负重游泳实验。泳池规格为50 cm×50 cm×40 cm,水深30 cm,水温25 ℃,记录小鼠从入水至头部没入水中7 s 内不再浮出水面的时间,为力竭游泳时间。
1.2.3 小鼠血液生化指标测定 小鼠游泳实验结束后,立即对其进行眼球静脉丛取血,血样在室温下静置2 h 后离心(4 000 r/min,10 min)仔细收集上层血清,冻存用于血清生化指标检测或立即进行血清生化指标检测;取出肝脏在冰水浴中用生理盐水将浮血洗去后冻存备用。用试剂盒测定血清中BUN、LD、MDA 含量以及T-SOD、GS 和CPK活力,并取小鼠肝脏测定其肝糖原含量。
1.3 统计学分析
采用SPSS 19.0 进行统计分析,统计结果以“平均数±标准差”表示,组间比较采用单因素方差分析,P<0.05 为显著差异,有统计学意义。
2 结果与分析
2.1 大豆肽对小鼠力竭游泳时间的影响
力竭游泳时间是抗疲劳实验中常用的评价指标。力竭游泳时间越长,疲劳产生越慢,抗疲劳效果越强。由表4可知,急性疲劳模型中,与阴性对照组比较,剂量组(SP-L、SP-M、SP-H)小鼠力竭游泳时间均显著延长(P<0.05),分别增长了31.7%,42.7%,128.2%;与阳性对照组比较无显著差异(P>0.05);3 组剂量组间也无显著性差异,说明不同大豆肽剂量对小鼠负重游泳时间影响不大。如表5可知,D-半乳糖亚急性衰老模型中,3 组剂量组间无显著差异,与阳性对照组GSH 差异显著,表明此模型下大豆肽依然可以提高机体的运动耐力,使疲劳产生减缓。模型组与阴性对照组没有明显差异,表明在此模型下,小鼠运动耐力不受影响。
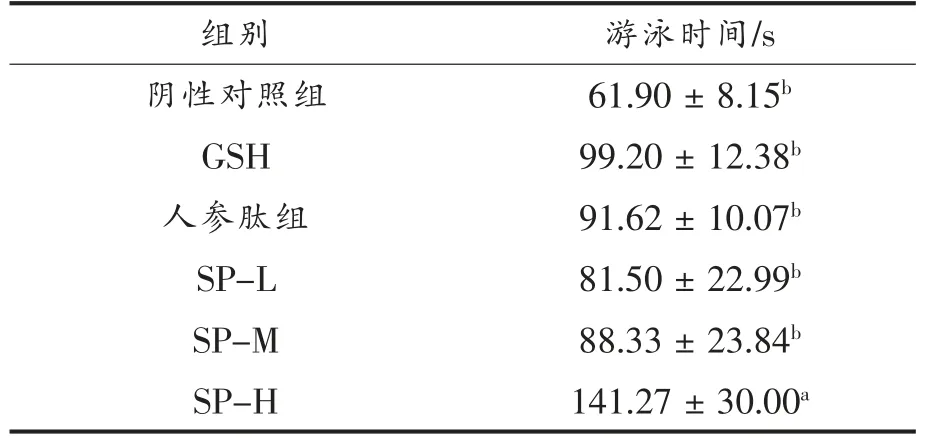
表4 急性疲劳模型实验中大豆肽对小鼠游泳时间的影响Table 4 Effect of soybean peptide on swimming time in mice in acute fatigue model experiment
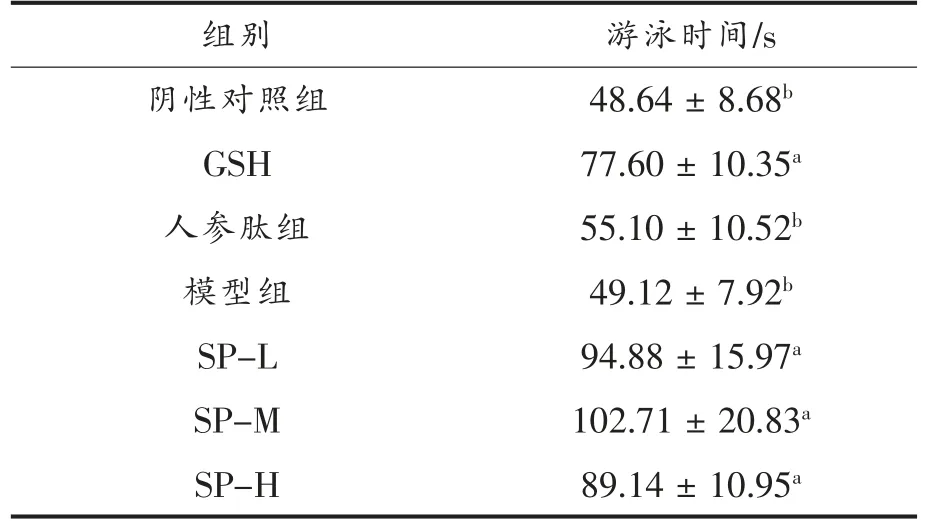
表5 D-半乳糖亚急性衰老模型实验中大豆肽对小鼠游泳时间的影响Table 5 Effect of soybean peptide on swimming time of mice in D-galactose subacute aging model experiment
2.2 大豆肽对小鼠血清尿素氮(BUN)含量的影响
在剧烈运动后,机体中蛋白质分解产生的含氮物质在肝脏中合成尿素,小鼠BUN 含量升高[12]。两模型实验中,结果如图1、图2所示,与阴性对照组相比,GSH、人参肽、SP-L、SP-M、SP-H 组小鼠血清BUN 含量均有所减少,这说明,谷胱甘肽、人参蛋白肽、大豆肽都能减少疲劳产物血清尿素氮的产生。急性疲劳模型中,SP-H 组BUN 含量与阴性对照组相比降低了61.7%(P<0.05),其它组间均无显著性差异。D-半乳糖亚急性衰老模型中,SP-M、SP-H 组的BUN 含量显著低于阴性对照组与阳性对照组,其它组与阴性对照组无显著性差异。这说明大豆肽在高剂量时,能有效抑制蛋白质作为供能物质进行分解,从而减缓疲劳的产生,其中D-半乳糖亚急性衰老模型中模型组BUN 含量与阴性对照组无显著差异,说明D-半乳糖对运动过程中尿素氮的产生没有影响。

图1 大豆肽对急性疲劳模型下小鼠血清尿素氮(BUN)的影响Fig.1 Effects of soybean peptide on bloodurea nitrogen (BUN) in mice with acute fatigue model
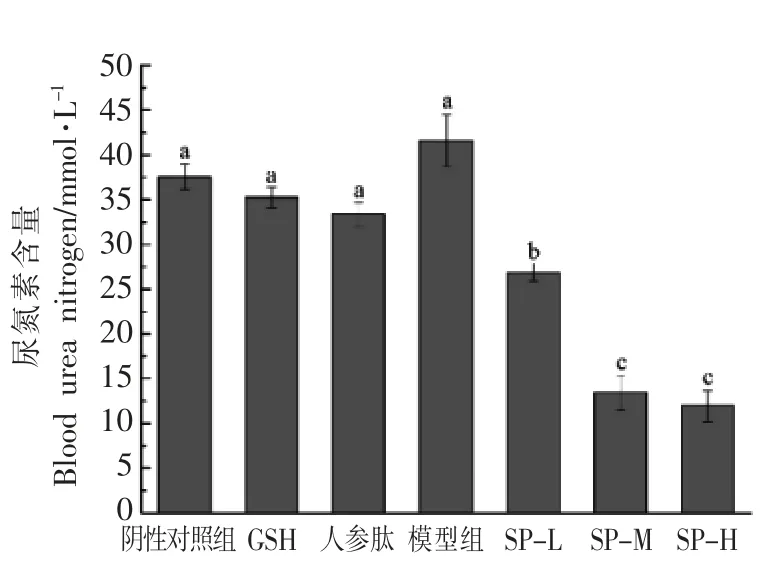
图2 大豆肽对D-半乳糖亚急性衰老模型下小鼠血清尿素氮(BUN)的影响Fig.2 The effect of soybean peptide on blood urea nitrogen of mice in D-galactose subacute aging model
2.3 大豆肽对小鼠血乳酸(LD)含量影响
机体内糖原(葡萄糖)在有氧条件下充分氧化分解产生二氧化碳和水,而在缺氧条件下氧化分解产生乳酸[13]。实验中,小鼠随着运动强度的增加,糖原进行无氧分解,产生大量的乳酸。乳酸在肌肉内堆积,供能反应变缓,肌肉能量供应不足,产生疲劳[14-16]。因此可以通过检测运动后血乳酸水平,判断运动强度或肌肉耐受力及疲劳程度。
急性疲劳模型实验结果如图3所示。小鼠力竭游泳后,其中阳性对照GSH 组、SP-H 组小鼠LD 含量显著低于阴性对照组,分别降低了44.6%和55.1%。其它组间没有显著性差异(P>0.05)。这说明大豆肽在低剂量时,对抑制乳酸生成没有显著作用,高剂量时可以明显抑制乳酸的生成或加速乳酸的分解,从而起到增强肌肉耐受力,缓解体力疲劳的作用。
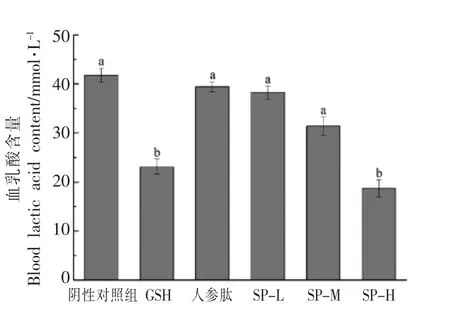
图3 大豆肽对急性疲劳模型下小鼠血乳酸(LD)的影响Fig.3 Effects of soy peptide on blood lactic acid in mice with acute fatigue model
D-半乳糖亚急性衰老模型小鼠力竭游泳后,各组小鼠LD 含量检测结果见图4。模型组血乳酸含量最高,这可能是由于D-半乳糖在体内的大量堆积,导致机体自由基系统失衡,多余的自由基攻击细胞,导致细胞代谢紊乱,功能受限,运动时机体更快地从有氧运动转为无氧运动,从而堆积大量的乳酸。SP-M、SP-H 组小鼠血乳酸含量显著低于阴性对照组和阳性对照组,而SP-L 组与两类对照组基本没有差异,这可能是因为D-半乳糖亚急性衰老模型小鼠机体本身就存在大量多余的自由基,机体更容易产生乳酸堆积,所以小剂量的大豆肽在这样的体系中就体现不出价值,只有当剂量增大到足够程度时,才能起到明显的延缓疲劳产生,缓解体力疲劳的作用。
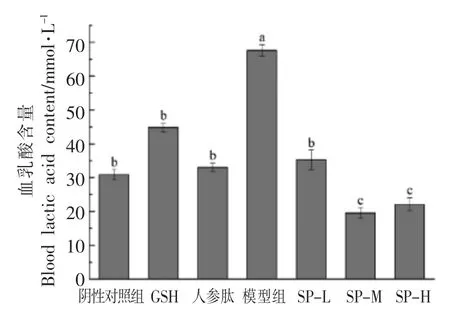
图4 大豆肽对D-半乳糖亚急性衰老模型下小鼠血乳酸(LD)的影响Fig.4 The effect of soybean peptide on blood urea lactic of mice in D-galactose subacute aging model
2.4 大豆肽对小鼠肝糖原含量的影响
糖类物质是机体重要的能源物质,是机体运动时的首要供能物质。肝糖原作为一种能量贮存物质,能够维持血糖的稳定。一般来说,肝糖原含量的高、低受运动强度的影响,运动强度越大,机体消耗的肝糖原越多,肝脏组织中糖原含量越低,疲劳程度越高[17-19]。两模型实验检测不同组小鼠游泳运动后肝糖原的含量,得到结果如图5、图6所示。在急性疲劳模型中,与阴性、阳性对照组相比,SP-L、SP-M、SP-H 组小鼠肝糖原含量均显著提升(P<0.05)。这说明大豆肽可以在一定程度上增加肝糖原的贮存,在高强度运动时,能够释放足够的能量,增强机体耐受强度,从而延缓疲劳的产生,起到缓解体力疲劳的作用。D-半乳糖亚急性模型与急性疲劳模型下,各组小鼠肝糖原含量不同,各组D-半乳糖模型小鼠力竭游泳后,肝糖原含量基本无差异,这说明可能受D-半乳糖影响,GSH、人参蛋白肽及大豆肽对小鼠肝糖原的贮存影响不大。
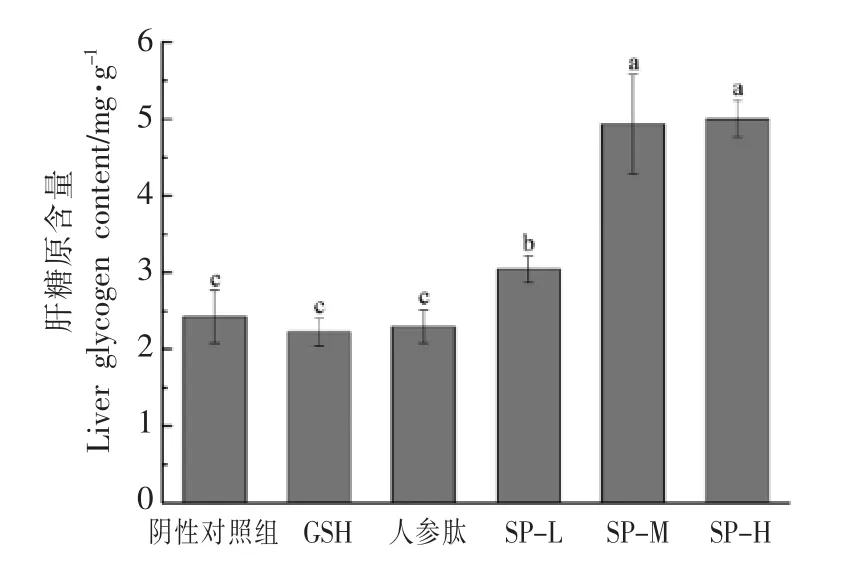
图5 大豆肽对急性疲劳模型下小鼠肝糖原的影响Fig.5 Effects of soybean peptide on liver glycogen in mice with acute fatigue model

图6 大豆肽对D-半乳糖亚急性衰老模型下小鼠肝糖原的影响Fig.6 The effect of soybean peptide on liver glycogen of mice in D-galactose subacute aging model
2.5 大豆肽对小鼠糖原合成酶(GS)含量的影响
研究发现,运动过程中及运动结束后,糖原合成酶(GS)的活性与肌糖原的变化呈正相关[20]。因此,GS 是考察大豆肽影响机体疲劳的重要指标之一。所得结果如图7、图8所示。在急性疲劳模型实验中,SP-L、SP-M、SP-H 组中GS 含量升高不显著,与阴性对照组相比无显著性差异(P>0.05),阳性对照组GSH 及人参肽组小鼠GS 含量与阴性对照组结果也没有显著性差异,这说明大豆肽能够在一定程度上提高机体GS 的含量。在D-半乳糖亚急性衰老模型实验中,各组小鼠GS 含量差异甚微,这一结果与急性疲劳模型下小鼠GS 的检测结果一致,综合2 次实验结果,GS 受外援源自由基清除剂的影响很小,不会参与其缓解体力疲劳的过程,也可能是由于GS 在疲劳产生的过程中并不发生明显改变,因此不适合于直接或间接反映疲劳的程度。

图7 大豆肽对急性疲劳模型下小鼠糖原合成酶(GS)含量的影响Fig.7 Effects of soybean peptide on glycogen synthase(GS) content in mice under acute fatigue model
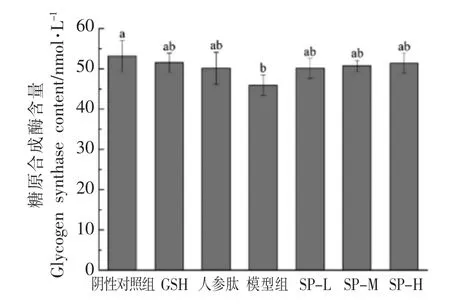
图8 大豆肽对D-半乳糖亚急性衰老模型下小鼠糖原合成酶(GS)的影响Fig.8 The effect of soybean peptide on glycogen synthetase of mice in D-galactose subacute aging model
2.6 大豆肽对小鼠总过氧化物歧化酶(T-SOD)活性的影响
过氧化物歧化酶(SOD)是生物体内数千种酶中,底物为氧自由基的唯一的酶,它对底物氧自由基有绝对专一性,而且催化效率很高,可以催化·O2-歧化为H2和O2[21]。机体内SOD 活性的大小与机体的运动耐受力呈正相关,SOD 活力越强,机体运动耐受力越大,越不容易产生疲劳或越容易消除疲劳[22]。急性疲劳模型实验结果如图9所示,GSH、人参肽组、SP-L 组小鼠血清中T-SOD 的活力高于阴性对照组,然而没有显著性差异(P>0.05);SP-M、SP-H 组小鼠血清中T-SOD 的活力显著高于阴性对照组(P<0.05),SP-M、SP-H 组之间差异不显著。实验结果表明,大豆肽灌胃剂量分别为0.5 g/(kg·d)和5 g/(kg·d)时,其辅助消除体内自由基的能力高于目前公认的消除体内自由基效果较好的小分子肽GSH,可以明显提高T-SOD活力,达到缓解体力疲劳的作用。
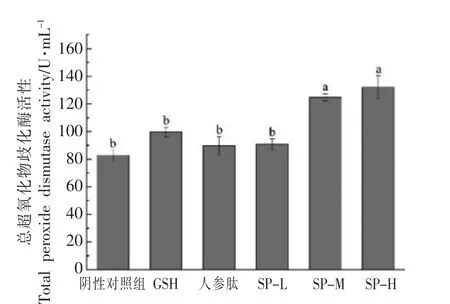
图9 大豆肽对急性疲劳模型下小鼠总过氧化物歧化酶(T-SOD)活力的影响Fig.9 Effects of soybean peptide on total peroxide dismutase (T-SOD) activity in mice under acute fatigue model
D-半乳糖模型是模拟衰老的一种模型,这种模型下的动物体内多种具有防御自由基攻击作用的酶类,如过氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性会显著下降,与衰老过程相似。然而,当生物体运动到一定程度时,机体会产生大量多余的自由基,引起机体内SOD、GSH-Px活性本能性的提高,以此消除多余的自由基,维持机体的正常生理状态。D-半乳糖亚急性衰老模型实验结果见图10。模型组T-SOD 活性最低,且显著低于其它各组,这说明此模型下小鼠肝脏TSOD 活性比正常状态下低,与正常衰老状态下相似,该模型造型成功。SP-L、SP-M、SP-H 组TSOD 的活性依然比阴性对照组的大,而结果没有急性疲劳模型实验中差异明显。这说明在D-半乳糖模型下,大豆肽依然可以提高机体T-SOD 的活性,而提高程度有所下降。这与这一模型下动物机体的特征有关。
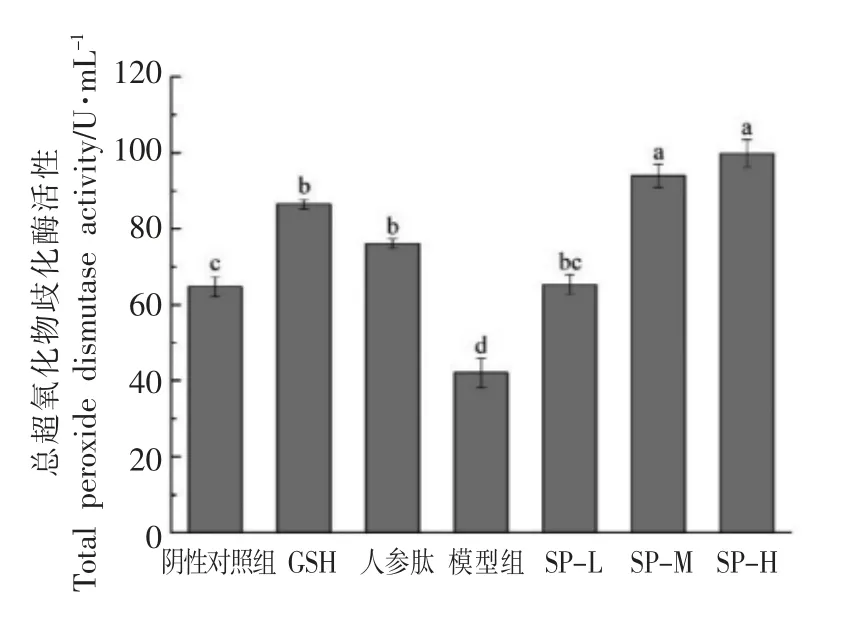
图10 大豆肽对D-半乳糖亚急性衰老模型下小鼠总过氧化物歧化酶(T-SOD)的影响Fig.10 The effect of soybean peptide on the total superoxide dismutase of mice in D-galactose subacute aging model
2.7 大豆肽对小鼠丙二醛(MDA)含量的影响
丙二醛(MDA)是机体内发生脂质过氧化作用形成的产物之一,会攻击细胞引起细胞代谢紊乱及功能障碍[23-24],从而造成肌肉损伤产生疲劳。因此,MDA 含量的高低可以间接反应机体受自由基攻击的严重程度,在一定程度上反映出机体细胞的疲劳程度。两模型实验后小鼠血清中MDA 含量如图11、图12所示。在急性疲劳模型中,GSH 组小鼠血清中MDA 含量低于阴性组小鼠,效果较显著(P<0.05),人参肽组、SP-L、SP-M、SP-H 组小鼠血清中MDA 含量虽然也低于阴性组小鼠,但效果不显著。这说明不同剂量的大豆肽对脂质过氧化反应的产物MDA 的含量基本没有影响,大豆肽缓解体力疲劳的功效可能不是通过抑制MDA 的产生来起作用的。D-半乳糖亚急性衰老模型实验中,各组小鼠血清中MDA 含量基本持平,这一结果与急性疲劳模型实验结果相似,而SP-L、SPM、SP-H 组MDA 的含量相比阴性对照组有一定程度的提高,这说明在D-半乳糖亚急性衰老模型下,大豆肽对其清除作用变弱。
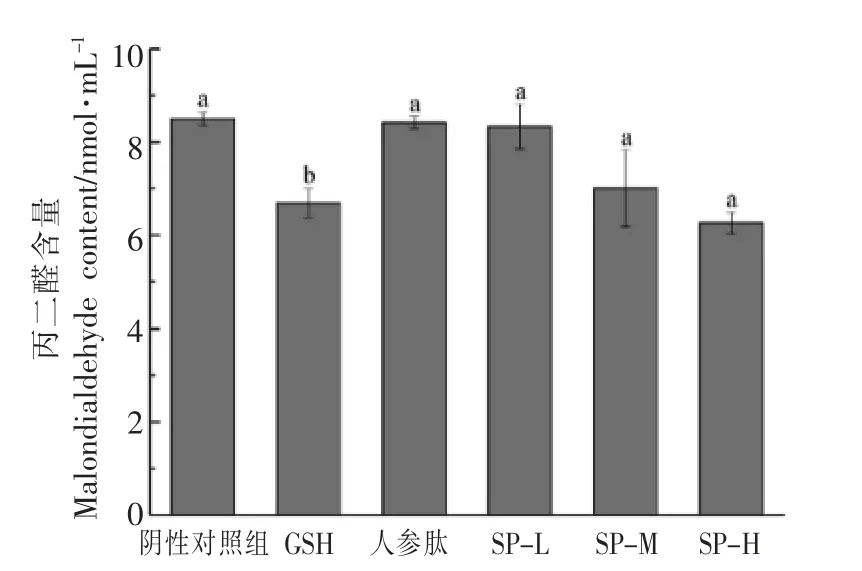
图11 大豆肽对急性疲劳模型下小鼠丙二醛(MDA)含量的影响Fig.11 Effects of soybean peptide on malondialdehyde(MDA) content in mice under acute fatigue model
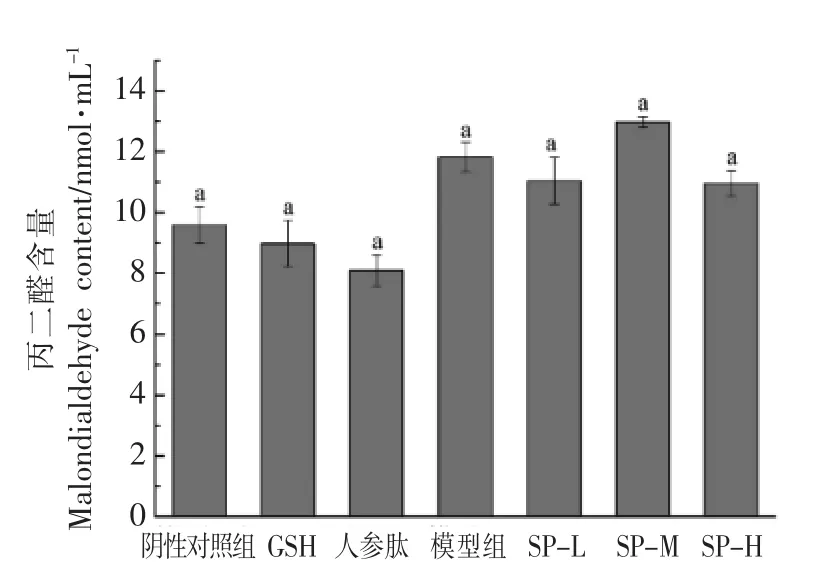
图12 大豆肽对D-半乳糖亚急性衰老模型下小鼠丙二醛(MDA)的影响Fig.12 The effect of soybean peptide on MDA of mice in D-galactose subacute aging model
2.8 大豆肽对小鼠血清磷酸肌酸激酶 (CPK)活性的影响
磷酸肌酸激酶又称CPK,主要存在于人体骨骼肌和心肌中,脑组织中也有一定分布。其参与糖酵解的控制、线粒体的呼吸和肌肉的收缩供能,是机体ATP-CP 供能系统代谢的关键酶,可作为评定肌肉承受刺激、骨骼肌细微损伤及适应与恢复的重要敏感指标[25]。运动时肌肉缺氧,使K+浓度升高,膜通透性加强,导致细胞膜内CPK 向细胞外释放,使CPK 的渗透量增加,引起血清CPK 活性升高[26-27]。两模型实验所测得CPK 含量如图13、图14所示。在急性疲劳模型实验中,各组与阴性对照组相比,结果基本没有差异。这说明大豆肽并不能影响小鼠血清CPK 的活性,也可能是因为小鼠力竭游泳后立即处死,影响了CPK 活性的恢复。在D-半乳糖亚急性衰老模型实验中,模型组CPK活性与阴性对照组结果基本无差异,而SP-L、SPM、SP-H 组CPK 的活性与阴性对照组相比结果偏低,与急性疲劳模型实验结果有一定差异,差异不显著。这可能是因为D-半乳糖的过量摄入使得机体细胞衰老,CPK 活性降低,而大豆肽对CPK 的活性基本没有影响,不能起到弥补作用。
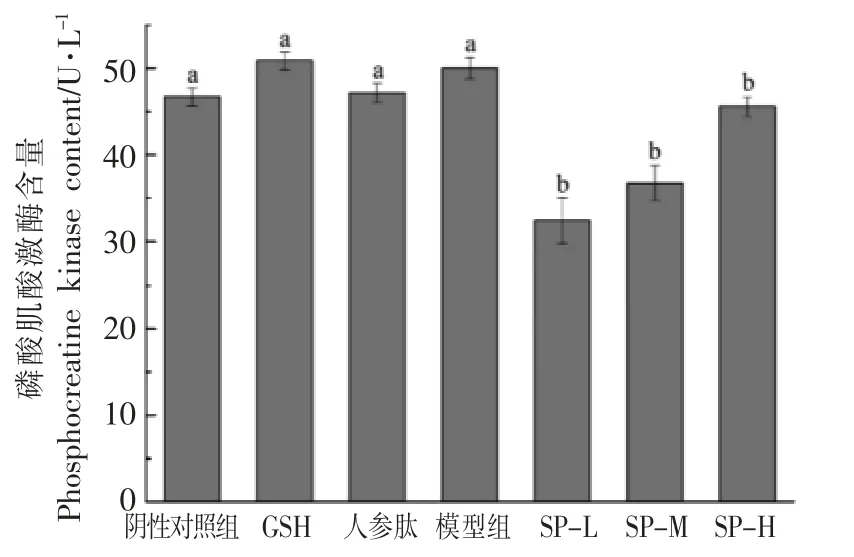
图13 大豆肽对急性疲劳模型下小鼠血清磷酸肌酸激酶(CPK)含量的影响Fig.13 Effects of soybean peptides on serum phosphocreatine kinase (CPK) content in mice with acute fatigue model

图14 大豆肽对D-半乳糖亚急性衰老模型下小鼠血清磷酸肌酸激酶(CPK)含量的影响Fig.14 The effect of soybean peptide on blood urea CPK of mice in D-galactose subacute aging model
3 结论
本研究通过构建急性疲劳模型与D-半乳糖亚急性衰老模型,考察了大豆肽在小鼠运动过程中对能源物质、产物及相关酶类的影响。结果表明2 种模型下,大豆肽可以显著提高小鼠的力竭游泳时间,其机制可能体现在大豆肽通过提高TSOD 活性,减少疲劳产物BUN、LD 的产生,并增加能源物质肝糖原的积累,达到缓解疲劳的目的。此外,本研究还为研发缓解疲劳的产品提供了一定的理论基础和参考依据。

