加工条件及体外消化对大米低聚肽结构和抗氧化活性的影响
刘文颖,张江涛,王 憬,毕 园,冯晓文,谷瑞增,侯俊财
(1 中国农业大学工学院 北京 100083 2 中国食品发酵工业研究院有限公司 北京市蛋白功能肽工程技术研究中心 北京 100015 3 东北农业大学食品学院 哈尔滨 150030)
我国大米产量丰富,其产量和消费量位居全球第一位。大米蛋白可以从大米淀粉生产中获得,也可从米糠和碎米中直接提取[1]。大米蛋白氨基酸组成平衡合理,含有8 种人体必需氨基酸,近似“完全蛋白”,生物价高达77%,与牛肉和虾仁等相似[2],营养价值非常高。此外,与其它谷物蛋白质相比,大米蛋白还具有低过敏性,不含抗营养因子,消化率高,无色素干扰及味道柔和等特点[1-2]。近年来,动、植物源生物活性肽的制备、活性鉴定与机理研究已成为食品科学研究领域的一个热点。采用温和的酶法水解大米蛋白,可以提高大米蛋白的附加值,实现对大米蛋白的精深加工与利用,并有效改善其功能属性,更易消化吸收[3-4]。
大米低聚肽是大米蛋白经酶解、分离、浓缩、干燥等工艺得到的小分子肽类物质。大米低聚肽具有极其丰富的生物活性,且食用安全性高,具有抗氧化,抗高血压,降胆固醇,预防慢性疾病,缓解疲劳,美容养颜以及免疫调节等生物活性[2]。无论是在医疗健康方面,还是在食品和化妆品方面,抗氧化活性都发挥着重要作用,对于机体而言,蛋白质、核酸和脂质等生物大分子的氧化损伤会造成机体紊乱,从而引发多种疾病[5]。对于食品来说,抗氧化剂可以减缓食品氧化腐败,延长食品的货架期。对于化妆品来说,抗氧化剂可以防止自由基对皮肤造成的氧化损伤,减缓皮肤衰老。大米低聚肽作为一种天然、安全的抗氧化物质具有良好的应用潜力。大米低聚肽的溶解性好,在较宽的pH 值范围能完全溶于水,并且无浑浊现象和沉淀物产生,是研制功能性饮料的理想原料之一。然而,在生产、储存和应用过程中,肽类物质存在因脱酰胺、氧化、水解或环化等作用而引起的降解风险,可能会造成多肽结构发生变化,其抗氧化活性也可能降低或丧失[6]。目前对这方面的研究鲜有报道。有必要考察加工处理过程中温度和pH 值对大米低聚肽抗氧化活性的影响,以及大米低聚肽在人体胃肠道环境下抗氧化活性的变化,这对其在功能性饮料中的应用有重要参考价值。
本文以大米蛋白粉为原料制备大米低聚肽,在对其扫描电镜、理化性质以及肽段序列分析的基础上,以分子质量分布、二级结构和氧自由基吸收能力(ORAC)为指标,研究不同温度、pH 值和消化方式对大米低聚肽结构和抗氧化活性的影响,为研发具有抗氧化活性的大米低聚肽功能性饮料奠定基础。
1 材料与方法
1.1 材料与仪器
大米蛋白粉,北京中食海氏生物技术有限公司;碱性蛋白酶(≥400 000 DU/g)、中性蛋白酶(≥1 600 AU/g),杜邦丹尼斯克公司;胃蛋白酶(≥250 units/mg)、偶氮二异丁脒盐酸盐(AAPH)、Fluorescein(荧光指示剂)、分子量标准品、Trolox(水溶性维生素E)均为色谱纯级,美国Sigma 公司;胰蛋白酶(≥250 NFU/mg),美国Solarbio 公司;乙腈、三氟乙酸均为色谱纯级,美国Fisher 公司。
HH-4 数显恒温水浴锅,普瑞斯机械有限公司;FE20K 型pH 计,瑞士梅特勒-托利多公司;KQ-250E 超声波振荡器,昆山市超声仪器有限公司;Phenom Prox 台式扫描电子显微镜,FEI 公司;J-810 圆二色谱仪,美国Jasco 公司;LC-20A 高效液相色谱仪,日本Shimadzu 公司;Spectra MR 多功能酶标仪,美国Dynex 公司;SpectraMax i3x 多功能酶标仪,美国MD 公司。
1.2 试验方法
1.2.1 大米低聚肽的制备 称取500 g 大米蛋白粉,溶解于蒸馏水中,置于50 ℃水浴锅中,用NaOH 溶液(0.1 mol/L)将pH 值调节至8.5,然后进行碱性蛋白酶酶解处理2 h,加酶量以2 500 units/g 原料为参考,再用盐酸(0.1 mol/L)将水解液pH 值调节为6.0,继续用中性蛋白酶酶解,加酶量以3 000 units/g 原料为参考,酶解时间为2 h。整个过程用0.1 mol/L 的HCl 和NaOH 调节水解液pH值,使pH 值保持不变。酶解完成将水解液于沸水浴中进行灭酶10 min,然后冷却至室温离心,离心力为6 000×g,离心时间为10 min,离心完成取上清液,用孔径为200 nm 的陶瓷膜过滤,再将过滤清液用截留分子质量为1 000 u 的超滤膜超滤,将滤过液浓缩并冷冻干燥,得到大米低聚肽粉[7]。
1.2.2 热稳定性测定 称取1.2 g 大米低聚肽,用去离子水将大米低聚肽配制为6 管20 mL 质量浓度为10 mg/mL 的大米低聚肽水溶液,将其分别放置在室温(25 ℃)以及30,40,60,80,100 ℃水浴条件下水浴2 h 之后,冷却至室温,再分别进行分子质量分布、圆二色光谱和ORAC 值测定[8]。
1.2.3 酸、碱稳定性测定 取6 支50 mL 离心管,分别称取0.1 g 大米低聚肽于离心管中,溶解于蒸馏水中,用盐酸(1 mol/L)和NaOH 溶液(1 mol/L)将5 管大米低聚肽溶液的pH 值依次调为2,4,6,8,10,另外1 管保持初始pH 值,作为对照,然后各管分别定容到10 mL,使其最终质量浓度为10 mg/mL,然后在37 ℃水浴条件下水浴2 h,再进行分子质量分布、圆二色光谱和ORAC 值测定[8]。
1.2.4 体外模拟消化稳定性测定
1.2.4.1 胃蛋白酶消化 分别称取5 g 大米低聚肽和0.2 g NaCl,溶解于蒸馏水中,用浓度为1 mol/L 的盐酸将pH 值调节为2.0,在37 ℃水浴条件下水浴片刻,再加入0.05 g 胃蛋白酶,消化1 h,消化完成后将溶液放置在100 ℃沸水浴中灭酶10 min,调节pH 值为7.5,定容到20 mL,质量浓度为10 mg/mL。胃蛋白酶消化处理完成后,在对其进行分子质量分布、圆二色光谱和ORAC 值测定[8-9]。
1.2.4.2 胰蛋白酶消化 分别称取5 g 大米低聚肽和0.68 g KH2PO4,溶解于蒸馏水中,用浓度为1 mol/L 的NaOH 溶液将pH 值调节为7.5,在37 ℃水浴条件下水浴片刻,然后立即用0.05 g 胰蛋白酶消化4 h,消化完成后将溶液放置在沸水浴中灭酶10 min,定容到20 mL,质量浓度为10 mg/mL。胰蛋白酶消化处理完成后,再进行分子质量分布、圆二色光谱和ORAC 值测定[8-9]。
1.2.4.3 胃蛋白酶消化后再胰蛋白酶消化 按照1.2.4.1 的方法进行胃蛋白酶消化、加热灭酶活后,用浓度为1 mol/L 的NaOH 溶液将pH 值调节为7.5,在37 ℃水浴条件下水浴片刻,然后立即用0.05 g 胰蛋白酶消化4 h,消化完成后将溶液放置在沸水浴中灭酶10 min,定容到20 mL,质量浓度为10 mg/mL。同时,以不加入消化酶的样品作为对照。胃蛋白酶消化后再用胰蛋白酶消化处理,再对其进行分子质量分布、圆二色光谱和ORAC 值测定[8-9]。
1.2.5 分子质量分布测定 使用反相高效液相凝胶色谱法进行分子质量分布测定。流动相:乙腈∶水∶三氟乙酸为45∶55∶0.1 (体积比);色谱柱:TSKgel G2000 SWXL 300 mm×7.8 mm;流速:0.5 mL/min;样品质量浓度:1.0 mg/mL;进样体积:10 μL;检测器:紫外检测器;检测波长:220 nm;柱温:30 ℃。将样品溶液用孔径0.2 μm 的聚四氟乙烯滤膜过滤,然后上机进行凝胶过滤。相对分子质量标准曲线的绘制是利用乙氨酸-乙氨酸-乙氨酸、乙氨酸-乙氨酸-酪氨酸-精氨酸、杆菌酶和细胞色素C 配制成0.001 g/mL 的溶液[10]。
1.2.6 圆二色光谱扫描 利用圆二色光谱仪测量样品(质量浓度0.25 mg/mL)的圆二色光谱,对于波长分析,设置的参数为步长0.2 nm,带宽2.0 nm,光谱范围185~260 nm,扫描速度200 nm/min。原始数据处理是将样品的光谱减去缓冲液的基线光谱,再使用Jasco 软件将得到的数值转换为摩尔椭圆率(θ)[11]。
1.2.7 ORAC 值的测定 将25 μL 样品溶液和100 μL 的0.8 μmol/L 荧光指示剂Fluorescein 混合于96 孔板中,然后加入75 μL 偶氮类化合物AAPH(150 mmol/L),此为试验组。然后用25 μL各种浓度梯度的Trolox 标准品(6.25,12.5,25,50,100,250,500 μmol/L)绘制标准曲线,用25 μL 磷酸缓冲液(pH=7.4,75 mmol/L)作为空白对照,在37 ℃下孵育20 min,最后用荧光酶标仪测定,其激发波长为485 nm,发射波长为530 nm,总测定时间为150 min,每隔2 min 测定1 次。同时以磷酸缓冲液代替AAPH 作为对照。以样品和标准品的荧光衰退曲线的保护面积之比计算样品的ORAC值,最终结果用μmol/g Trolox 表示[12]。
1.3 数据处理
每个试验平行测定3 次,试验结果用“平均值±标准差”表示,采用SPSS 20.0 软件对试验数据进行分析,用Duncan0.05进行平均数之间显著性差异分析,P<0.05 表示差异显著,P>0.05 表示差异不显著,并使用Origin 8.0 软件作图。
2 结果与分析
2.1 温度对大米低聚肽结构和抗氧化活性的影响
2.1.1 分子质量分布 大米低聚肽分别在室温(25 ℃) 以及30,40,60,80,100 ℃条件下水浴2 h后,其分子质量分布如表1所示。可以看出,大米低聚肽主要是分子质量较小的肽段,其小于1 000 u 分子质量的组分高达90%以上。相关研究指出分子质量大小直接关系着肽的抗氧化性强弱,分子质量较小的肽抗氧化活性较强,并且此类肽段的氨基酸残基数目一般在20 个以内[13]。因此,从分子质量来看,大米低聚肽是具有抗氧化活性潜力的物质。在不同温度下水浴2 h 后,各个分子质量范围的大米低聚肽比例变化很小,不同温度下小于1 000 u 分子质量的大米低聚肽含量都在91%左右,其中大部分大米低聚肽分子质量集中在480 u 左右,与25 ℃条件下相比,变化不超过3.07%。热处理显著降低大米低聚肽的在2 000~3 000 u,3 000~5 000 u 和>5 000 u 范围内的分子质量(P<0.05),显著提高<150 u 范围内的分子质量(P<0.05),然而对范围在1 000~2 000 u,150~1 000 u,1 000 u 以下总计和重均分子质量无显著影响(P>0.05)。这表明在大米低聚肽加工过程中,温度因素对其组分分布的影响较小。这与陈亮等[14]研究不同温度条件对玉米低聚肽的热稳定性影响的结果相同,也得出了温度因素对各分子质量区间的玉米低聚肽的含量基本没有影响的结论。
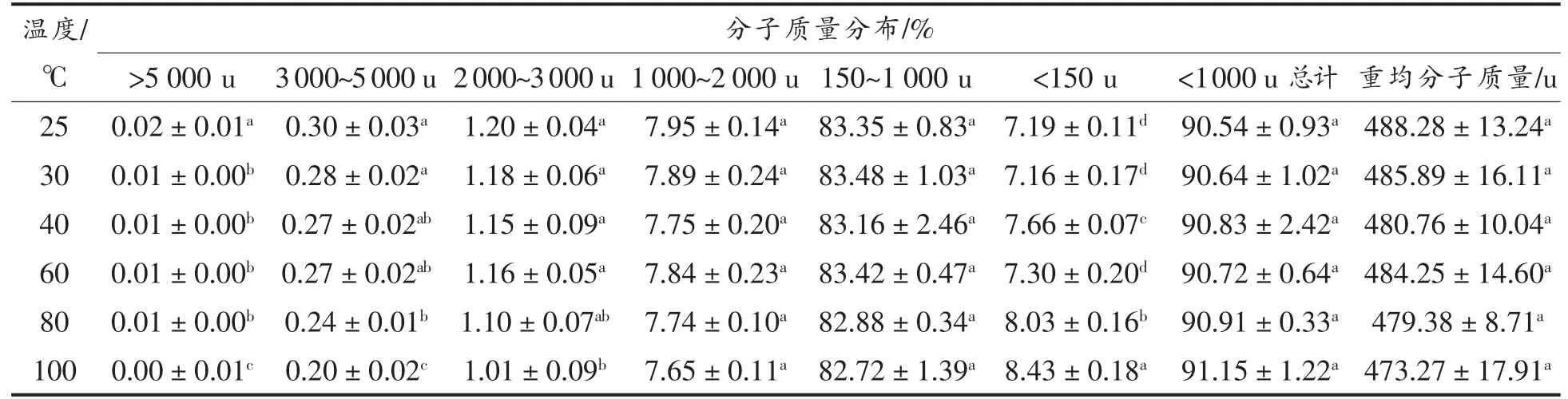
表1 不同温度下大米低聚肽的分子质量分布Table 1 Molecular weight distribution of rice oligopeptides at different temperatures
2.1.2 二级结构 结构决定功能,分析肽的二级或高级结构,对研究其抗氧化活性非常重要[15]。因此,进一步对大米低聚肽在不同温度下的二级结构进行分析。肽的二级结构改变,会使圆二色光谱的位置、吸收的强弱发生改变[11]。通过圆二色谱分析,解析出大米低聚肽二级结构中的α-螺旋、平行式β-折叠、反平行式β-折叠、β-转角和不规则卷曲的比例。图1显示,不同温度处理的大米低聚肽均在远紫外区190 nm 附近有一负峰,在远紫外区225 nm 附近有一正峰。与25 ℃条件下相比,40 ℃下大米低聚肽的圆二色光谱变化最大。由表2可知,反平行式β-折叠比例最高,其次是不规则卷曲、β-转角、α-螺旋、平行式β-折叠。不同温度对大米低聚肽的二级结构尤其是反平行式β-折叠、β-转角和不规则卷曲比例稍有影响,而变化不大,与25 ℃条件下相比,变化不超过1.24%。不同温度下大米低聚肽的二级结构均无显著差异(P>0.05)。其原因可能是与蛋白质相比,肽的结构较为简单,主要具有肽链一级结构及二级结构,不具有对热敏感的更高级结构,温度对其形态结构破坏作用很小[15]。
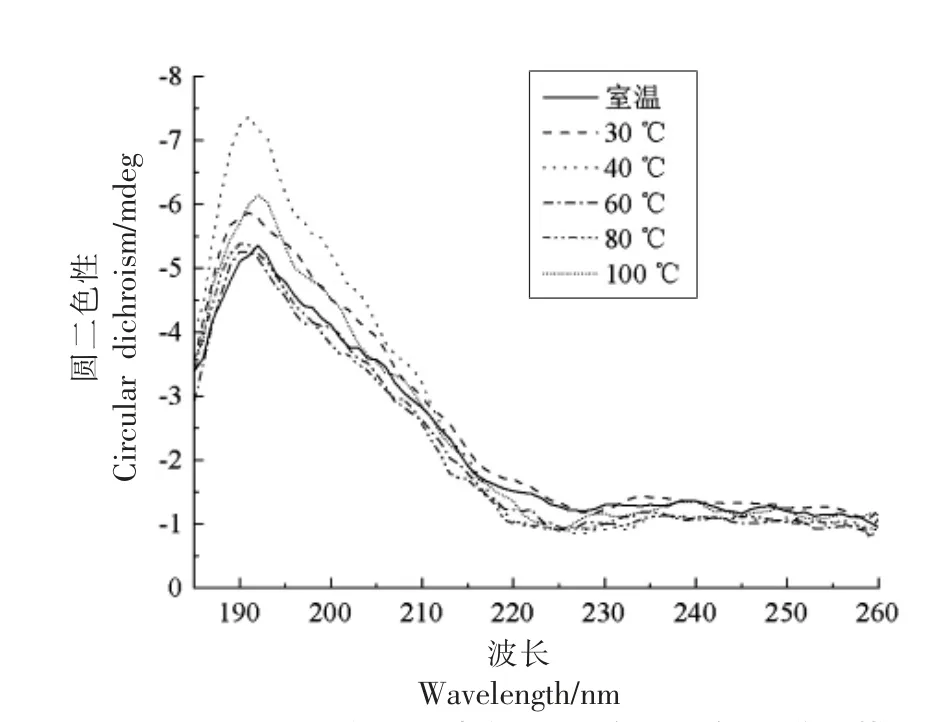
图1 不同温度下大米低聚肽的圆二色光谱扫描Fig.1 Circular dichroism spectrum of rice oligopeptides at different temperatures
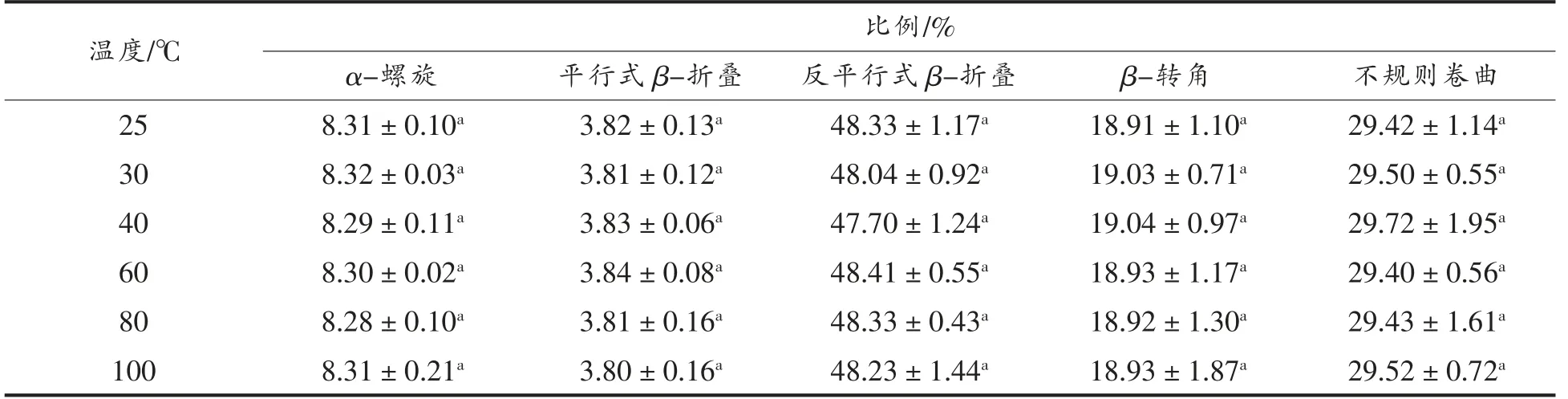
表2 不同温度下大米低聚肽的二级结构Table 2 Secondary structures of rice oligopeptides at different temperatures
2.1.3 氧自由基吸收能力 氧自由基吸收能力(Oxygen radical absorbance capacity,ORAC)是检测抗氧化能力强弱的一个常用指标,ORAC 值越高,抗氧化活性越强[12]。不同浓度Trolox 标准液的动态荧光衰减曲线如图2所示。经计算,不同温度下,大米低聚肽的ORAC 值见图3,从图中可以看出ORAC 值随着温度升高呈先升高后下降的趋势,40 ℃下ORAC 值为(1 084.78±31.60)μmol/g,显著高于其它温度下的ORAC 值(P<0.05),与25℃下相比(884.42 ± 27.17)μmol/g,抗氧化活性提高了22.65%。这可能是由于此温度下热处理改变了大米低聚肽的结构及空间构象,增强了氢转移的抑制能力,进而使自由基链式反应终止,从而ORAC 值增加。这与40 ℃下大米低聚肽的二级结构变化一致。其余温度下,ORAC 值均保持在805.14~890.88 μmol/g 之间,没有显著性变化(P>0.05),说明在此浓度范围内,抗氧化活性较稳定。大米低聚肽的结构使其对热处理的敏感性较低,从而使得热处理对其抗氧化活性的影响较小。许英一等[16]研究了加热处理(20,40,60,80,100 ℃)对燕麦蛋白肽抗氧化活性的影响,结果与本研究一致,随着温度的升高,燕麦蛋白肽抗氧化活性先升高后降低,40 ℃下抗氧化活性最强。因为食品生产中热处理是常见的操作,所以大米低聚肽的低热敏感性有利于将其在饮料加工过程中作为原料使用。

图2 不同浓度Trolox 的动态荧光衰减曲线Fig.2 Dynamic fluorescence attenuation curve of Trolox at different concentrations
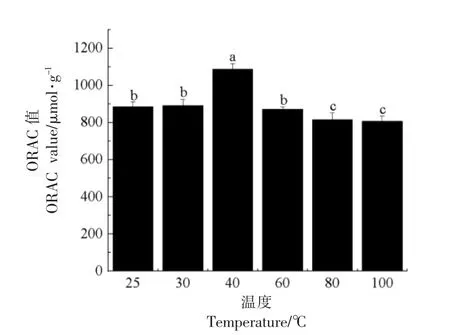
图3 不同温度下大米低聚肽的ORAC 值Fig.3 ORAC values of rice oligopeptides at different temperatures
2.2 pH 值对大米低聚肽结构和抗氧化活性的影响
2.2.1 分子质量分布 大米低聚肽在初始pH 值以及pH 值分别为2,4,6,8,10 的条件下,在37℃水浴2 h,得到其分子质量分布情况如表3所示。在不同pH 值条件下,各个分子质量范围的大米低聚肽比例变化很小,小于1 000 u 分子质量的大米低聚肽总含量均在91%左右,其中大部分大米低聚肽的分子质量集中在480 u 左右,变化不超过2.52%。pH 值为10 的大米低聚肽的分子质量,在2 000~3 000 u 范围内的含量与其它pH 值条件下有显著差异(P<0.05)。与其它pH 值条件相比,在pH 2 和pH 10 条件下,大米低聚肽的重均分子质量变化稍大,这表明强酸和强碱环境对大米低聚的稳定性有一定影响,加工过程中,应避免强酸和强碱环境。综上所述,大米低聚肽具有较好的pH 稳定性,这与王若敏等[17]研究不同酸碱性环境下大豆肽的分子质量分布没有显著性变化的结果相似。陈亮等[14]在玉米低聚肽稳定性的研究中也得出相同结论。

表3 不同pH 值下大米低聚肽的分子质量分布Table 3 Molecular weight distribution of rice oligopeptides at different pH values
2.2.2 二级结构 不同pH 值下大米低聚肽的圆二色光谱分析结果如图4所示,与热处理结果一致,不同pH 值下大米低聚肽均在远紫外区190 nm 附近有一负峰,在远紫外区225 nm 附近有一正峰。与对照相比,不同pH 值下大米低聚肽190 nm 处的负峰增加,225 nm 处的正峰也略有增加,其中pH 4 下两处圆二色光谱峰增加最多。由表4可知,二级结构中,反平行式β-折叠比例最高,其次是不规则卷曲、β-转角、α-螺旋、平行式β-折叠。不同pH 值下大米低聚肽的二级结构比例稍有变化,其中α-螺旋、反平行式β-折叠和不规则卷曲有显著影响(P<0.05),可能是肽分子上氢质子分布发生变化所引起[18]。此外,肽在碱性环境下发生外消旋反应,一定程度上改变了肽链的构象和结构[19-20]。然而与对照组相比,变化不超过10.88%。因此,不同pH 值下,大米低聚肽二级结构较为稳定。
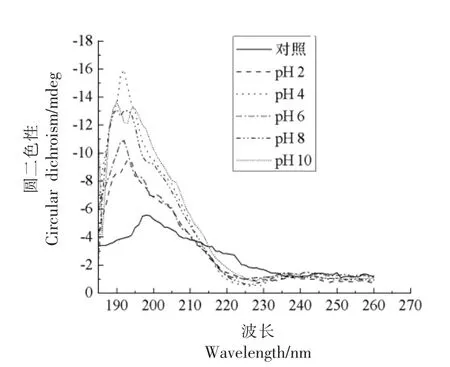
图4 不同pH 值下大米低聚肽的圆二色光谱扫描Fig.4 Circular dichroism spectrum of rice oligopeptides at different pH values

表4 不同pH 值下大米低聚肽的二级结构Table 4 Secondary structures of rice oligopeptides at different pH values
2.2.3 氧自由基吸收能力 不同pH 值下大米低聚肽的ORAC 值见图5。与对照相比 (834.16±27.82)μmol/g,pH 6 下大米低聚肽的ORAC 值为(930.31 ± 39.28)μmol/g,提高了11.53%,有显著性变化(P<0.05)。其余pH 值下,大米低聚肽的ORAC 值有所降低,其中pH 2 和pH 4 下ORAC值分别为(714.56±58.14)μmol/g 和(599.69± 30.90)μmol/g,与对照相比,分别降低了14.34%和28.11%,有显著性变化(P<0.05)。推测原因可能是此酸碱环境下引起疏水性氨基酸的结构及空间构象发生变化,从而降低大米低聚肽阻断或打破自由基链式反应的抗氧化能力,由上述圆二色光谱分析结果可知,pH 4 下大米低聚肽的光谱峰变化最大,这可能是导致其ORAC 值变化最大的原因之一。碱性条件下,ORAC 值大于强酸性环境,可能是由碱性环境促使疏水性氨基酸残基增多所引起,从而提高了其抗氧化活性。陈庆华等[21]研究了花生蛋白肽在酸碱性环境下的抗氧化能力稳定性,其结论和本研究结论相一致。因此,应尽量避免大米低聚肽在酸性很强的环境下加工处理。

图5 不同pH 值下大米低聚肽的ORAC 值Fig.5 ORAC values of rice oligopeptides at different pH values
2.3 体外消化对大米低聚肽结构和抗氧化活性的影响
2.3.1 分子质量分布 大米低聚肽分别经胃蛋白酶、胰蛋白酶和先胃蛋白酶再胰蛋白酶3 种消化模式消化后,测定出其分子质量分布情况。从表6可以得出大米低聚肽经过3 种消化模式消化后,分子质量小于1 000 u 的大米低聚肽的组分总含量略有升高,重均分子质量稍有降低,而不超过8.32%。综上得出大米低聚肽对胃肠道中胃蛋白酶和胰蛋白酶具有耐受作用。与未消化组相比,经过消化后,分子质量在1 000~2 000 u,2 000~3 000 u,3 000~5 000 u,大于5 000 u 和重均分子质量的组分显著下降(P<0.05),而小于150 u 所占比例显著升高(P<0.05)。表明经过消化后分子质量相对较大的肽段分解成了分子质量较小的肽段或氨基酸。从表5可知,对大米低聚肽的消化作用,胰蛋白酶要略强于胃蛋白酶,并且在这3 种消化模式中,先胃蛋白酶再胰蛋白酶消化模式使大米低聚肽中分子质量小于1 000 u 的组分含量升高的最多。杜枘宣[22]研究了体外模拟胃肠消化酪蛋白,得出酪蛋白在模拟肠液消化模式下的水解度显著高于胃液消化模式。
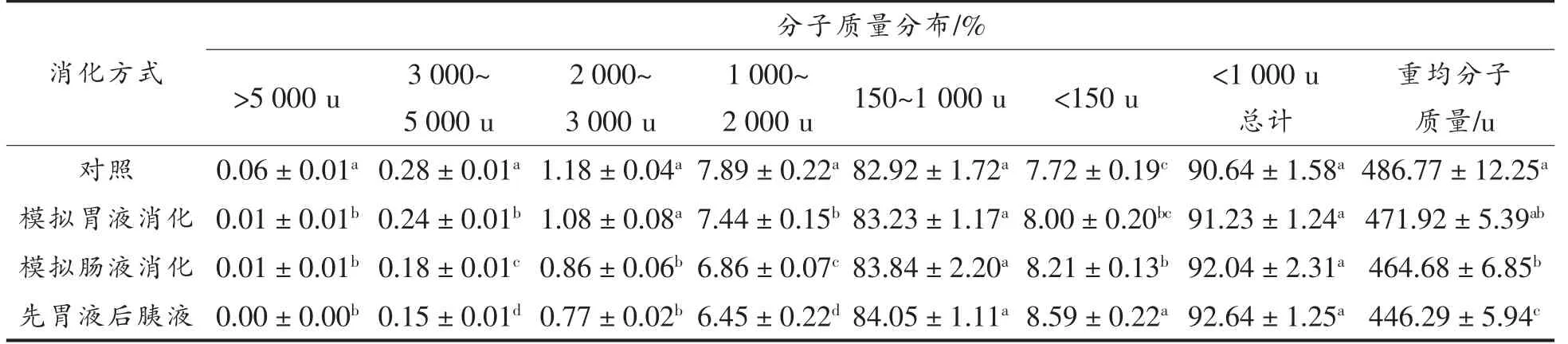
表5 不同消化方式下大米低聚肽的分子质量分布Table 5 Molecular weight distribution of rice oligopeptides in different digestion modes
2.3.2 二级结构 不同消化模式下,大米低聚肽的圆二色光谱分析结果如图6所示,消化前、后大米低聚肽均在远紫外区190 nm 附近有一负峰,在远紫外区225 nm 附近有一正峰。由表6可知,二级结构中,反平行式β-折叠比例最高,其次是不规则卷曲、β-转角、α-螺旋、平行式β-折叠。不同消化模式对大米低聚肽的二级结构尤其是反平行式β-折叠和不规则卷曲比例稍有影响,然而变化不大,与对照相比,变化不超过1.06%。因此,不同消化模式下,大米低聚肽二级结构较为稳定。在3种消化模式下,胃蛋白酶和胰蛋白酶的作用位点和作用机理不同可能是造成大米低聚肽二级结构差异的原因,并且胃蛋白酶和胰蛋白酶具有不同的酶解特性会使大米低聚肽水解成不同的肽段,从而在一定程度上引起二级结构的变化[23]。
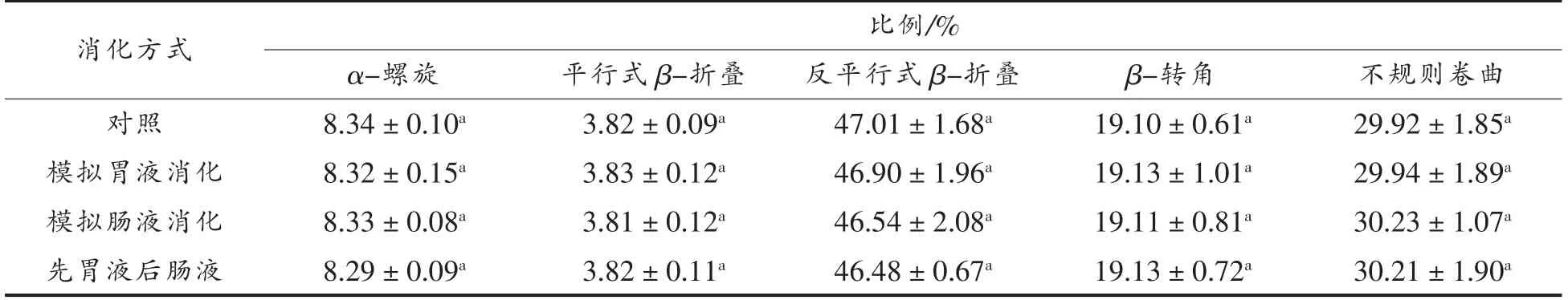
表6 不同消化模式下大米低聚肽的二级结构Table 6 Secondary structures of rice oligopeptides in different digestion modes

图6 不同消化模式下大米低聚肽的圆二色光谱扫描Fig.6 Circular dichroism spectrum of rice oligopeptides in different digestion modes
2.3.3 氧自由基吸收能力 不同消化模式下,大米低聚肽的ORAC 值见图7。胃蛋白酶消化1 h后,大米低聚肽ORAC 值显著低于对照组(P<0.05),降低了11.09%;胰蛋白酶消化4 h 后,ORAC 值提高了0.65%,先胃蛋白酶消化1 h 再胰蛋白酶消化4 h,ORAC 值显著高于对照组(P<0.05),提高了17.78%。这与Schmelzer 等[24]研究的β-酪蛋白和刘珊珊等[25]研究的酪蛋白肽经模拟胃肠消化后的降解规律一致。推测原因可能是由于胃蛋白酶将部分高活性肽段酶切降解,阻碍了肽段与自由基的反应,使低聚肽对自由基的清除能力略有下降。在消化能力方面胰蛋白酶要优于胃蛋白酶,能够将大米低聚肽酶解成更小分子质量的肽段,从而引起一些疏水性基团暴露,使得肽段表面疏水性增强,并且相关研究指出自由基清除活性与疏水性氨基酸或肽的含量有关[25]。体外模拟人体胃肠消化,先胃蛋白酶再胰蛋白酶消化模式下,大米低聚肽进一步生成小肽(主要为二肽、三肽等),暴露更多活性基团,大大增加与自由基反应的机会,从而增强对自由基的清除能力,并且对大米低聚肽的抗氧化活性提高具有较好的促进作用[26]。

图7 不同消化模式下大米低聚肽的ORAC 值Fig.7 ORAC values of rice oligopeptides in different digestion modes
3 结论
大米低聚肽具有球体颗粒状和弧形片状结构,总蛋白质含量为(95.75±1.72)%,低聚肽含量为(89.11±0.94)%,富含抗氧化性氨基酸。热处理显著改变大米低聚肽在3 000~5 000 u、2 000~3 000 u 和>5 000 u 的分子质量(P<0.05),显著提高<150 u 分子质量(P<0.05),然而对重均分子质量、二级结构无显著影响(P>0.05),40 ℃下大米低聚肽的ORAC 值显著高于其它温度(P<0.05);pH值对大米低聚肽的重均分子质量、α-螺旋和平行式β-折叠无显著影响(P>0.05),pH 值变化可显著改变大米低聚肽ORAC 值(P<0.05);体外模拟消化显著改变大米低聚肽的分子质量分布(P<0.05),然而对大米低聚肽的二级结构无显著影响(P>0.05),先胃蛋白酶后胰蛋白酶消化可显著提高大米低聚肽的ORAC 值(P<0.05)。
通过研究不同加工条件和消化方式对大米低聚肽结构和抗氧化活性的影响,证明其在生产加工过程以及人体胃肠道环境下,大米低聚肽能保持较强的结构稳定性和抗氧化活性,因此在饮料工业中具有广阔的应用前景。本试验结果为大米低聚肽在抗氧化功能性饮料的开发和应用提供了理论参考。

