低温等离子体对杨梅采后致病菌
——桔青霉的抑制作用
张 禾,陈烨芝,孙 翠,曹锦萍,孙崇德
(浙江大学农业与生物技术学院 果实品质生物学实验室 园艺产品冷链物流工艺与装备国家地方联合工程实验室浙江省园艺植物整合生物学研究与应用重点实验室 杭州 310058)
杨梅(Myrica rubra Sieb.et Zucc.)是原产于我国的特色水果,其果实色泽艳丽、柔软多汁、酸甜适口,深受消费者喜爱。目前杨梅产区集中分布于长江流域以南各地,包括浙江、江苏、福建等省,其中浙江省是目前我国最大的杨梅产区。杨梅上市期短,浙江地区集中于6月中旬至7月初大量上市。
杨梅果实极其不耐贮运,民间素有“一日味变,二日色变,三日色味皆变”之说[1]。一方面,杨梅果实成熟期恰逢长江中、下游地区的高温多雨季节,加上产地和上市期均较为集中,采收期短,给杨梅销售造成巨大的压力;另一方面,杨梅果实为浆果状核果,无外果皮包被,果肉呈柱状排列,肉柱柔嫩呈辐射状,易受病虫害和机械损伤[2]。除杨梅果实本身结构造成其不耐贮运外,杨梅成熟期容易引来果蝇产卵于果实中,采收后果蝇幼虫活动造成的果实伤口易受细菌和真菌的侵染。此外,杨梅果实采后代谢旺盛,在完熟期呼吸速率达到高峰,导致采后品质快速劣变。以上各因素给杨梅的采后贮运和销售带来巨大的挑战。
杨梅果实采后侵染性病害主要由真菌引起[3]。从常温贮藏的杨梅病果中分离出桔青霉(Penicillium citrinum)、绿色木霉(Trichoderma viride)、杨梅轮帚霉(Verticiladiella abielinga (Peck) Hugh es)和尖孢镰刀菌(Fusarium oxysporum)等病原菌[4-5]。其中,由桔青霉侵染引起的绿霉病是杨梅中较为常见的采后病害,病果表面布满白色菌丝,果实硬度降低。杨梅果实果肉柔软且裸露,一般不用液态的化学保鲜剂处理。目前常用的采后保鲜方式是低温保鲜或低温结合气调保鲜。
对于难以运用杀菌剂处理的浆果类水果,人们一直在积极寻求无残留和无损伤的采后防腐手段。近年来,低温等离子体技术在食品防腐领域被大量报道,也逐渐向果蔬保鲜领域渗透。等离子体被称为物质的第4 种状态[6]。等离子体中包含大量带电粒子(电子和离子)、自由基、中性物种(激发原子和分子)、光子(可见光、UV-A 和UV-B)和电磁场等[7-8]。低温等离子体是等离子体的其中一种形式,其通过在气体中放电获得,主要通过产生的电子、离子、自由基、活性粒子以及UV 射线等对病原菌起杀灭作用[9]。
低温等离子体作为一种物理杀菌方法,具有无残留、无污染等优点,在杨梅果实采后病原菌的防治方面具有应用价值。本文通过研究低温等离子体处理的杨梅果实贮藏和货架期腐烂率变化,以及低温等离子体的抗真菌活性测定,评估低温等离子体对杨梅果实桔青霉的抑制作用;通过孢子活性氧(ROS)水平、线粒体膜电位和膜完整性测定,探索低温等离子体对桔青霉抑制作用的机理,以期为低温等离子体在杨梅果实采后病害防治中的应用提供理论支撑。
1 材料和方法
1.1 材料与试剂
杨梅果实(‘荸荠“品种),2020年6月15日采于浙江省台州市仙居县;桔青霉(Penicillium citrinum),上海生物保藏中心。马铃薯葡萄糖琼脂培养基(PDA)、碘化丙啶(PI)、Hoechst 33342 试剂,上海源叶生物科技有限公司;活性氧(ROS)检测试剂盒,杭州杨雅生物科技有限公司。其它试剂均为分析纯级。
1.2 仪器与设备
低温等离子体制备设备,南京苏曼等离子科技有限公司;激光共聚焦显微镜(LSM780),德国ZEISS 公司;临界点干燥仪(HCP-2 型)、扫描电镜(SU-8010 型)、透射电镜(H-7650 型),日本日立(Hitachi)株式会社;超薄切片机(EM UC7 型),德国LEICA 公司;超净工作台,苏州安泰空气技术有限公司;生化恒温培养箱,上海一恒科学仪器有限公司。
1.3 低温等离子体的制备
低温等离子体制备设备由低温等离子体脉冲电源和低温等离子体发生装置两部分构成。低温等离子体脉冲电源的输出电压范围为10~25 kV,功率范围为300~1 500 W。低温等离子气体发生装置由不锈钢和聚乙烯四氟等制作而成,外电极为外径25 mm,内径20 mm 的石英管,内电极是凹槽直径为11 mm 的齿形不锈钢电极。本研究以空气为发生气体,通过介质阻挡放电产生等离子体,等离子放电宽度为150 mm,单边放电间隙为3 mm。
杨梅果实低温等离子体处理流程如图1所示。将设备各部件连接,依次打开气泵和等离子脉冲电源的开关并调节电流强度,即可在低温等离子气体发生装置的出气口获得等离子体。将等离子体通入杨梅果实容器中,按照设定时间进行密闭处理。
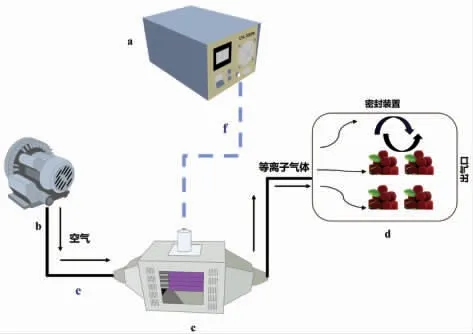
图1 低温等离子体处理流程Fig.1 Schematic diagram on the cold plasma treatment process of Chinese bayberry
1.4 病原菌培养和菌悬液制备
桔青霉孢子的收集根据前人方法[10]稍作改进,将桔青霉在PDA 平板培养基中培养7~10 d(25 ℃,RH 95%),待产孢后向平板中加入无菌蒸馏水,用涂布棒反复刮取病原菌孢子,收集孢子悬液于涡旋振荡器中涡旋1 min 后,用4 层无菌纱布过滤去除孢子菌丝,收集滤液并于光学显微镜下计数,稀释获得浓度为1×106spores/mL 的菌悬液待用。
1.5 杨梅果实采收
杨梅果实于清晨采摘后,当天运输至浙江大学农业与生物技术学院果树所实验室。挑选大小均一、成熟度一致、无机械损伤和病虫害的杨梅果实放置于经过消毒的杨梅果筐中待用。
1.6 低温等离子气体对杨梅果实贮藏性的影响
将挑选后的杨梅果实分组后放置于经过消毒的密闭容器中,每组设置120 个杨梅果实,通入6 A 电流产生的低温等离子体处理3 min 后取出,对照组(CK)中通入空气。设置不同时间间隔处理,分别为每隔12,24,48 h 处理1 次。处理结束后将果实取出,置于恒温冷库中(4 ℃,RH 90%)。从贮藏的第2 天开始计算果实腐烂率,每2 d 计算1次,共计观察2 周。
1.7 低温等离子体体外抑菌处理
向PDA 平板培养基中加入100 μL 浓度为1×106spores/mL 的桔青霉悬液,使用涂布棒涂布均匀后,静置于超净工作台使水分被培养基吸收。随后将平板放入密闭乐扣盒中,通入低温等离子体进行处理,设置不同电流强度产生的低温等离子体处理以及不同处理时间的对比,具体分组如下:3 A-1 min,4 A-1 min,5 A-1 min,6 A-1 min,3 A-3 min,4 A-3 min,5 A-3 min,6 A-3 min,对照组(CK)中通入空气,每组设置6 个平板重复。处理结束后将平板取出,置于25 ℃的恒温箱中(RH 95%)培养,每隔24 h 拍照记录菌体生长情况,并用Image J 软件测定菌落面积。
1.8 低温等离子体体内抑菌活性分析
将杨梅果实在2%(体积分数) 次氯酸钠中浸泡2 min 进行表面消毒,无菌冲洗并风干后接种病原菌。由于杨梅果实果肉裸露,因此接种时无需另外制造伤口,直接将10 μL 的桔青霉的孢子悬浮液(1×106spores/mL)滴加至杨梅果实赤道部位果肉表面,风干后置于密闭容器中,通入6 A 电流产生的低温等离子体,处理3 min 后取出。设置不同时间间隔处理,分别为每隔12,24,48 h 处理1次,对照组(CK)中通入空气。处理结束后将果实取出,置于恒温库中(20 ℃,RH 90%),从第2 天开始每天用Image J 软件测定病斑面积。每组设置120 个果实。
1.9 孢子坏死和凋亡分析
采用PI 和Hoechst 33342 染色法评估低温等离子体对桔青霉细胞膜完整性和细胞凋亡的作用,具体方法参照前人的方法[11-12]稍作修改。将桔青霉在PDA 平板培养基中培养7~10 d(25 ℃,RH 95%),待产孢后通入3 A 电流产生的低温等离子体进行处理,处理时间分别为1 min 和3 min,每组设置6 个平板重复,处理结束后取出,刮取孢子制备悬液。在1 mL 菌悬液中加入10 μL 质量浓度为20 mg/L 的PI 染液或10 μL 质量浓度为20 mg/L 的Hoechst 33342 染液,于黑暗条件下室温孵育15 min 后,用激光共聚焦显微镜观察、检测细胞膜的完整性和细胞凋亡情况。
1.10 孢子ROS 检测
采用DCFH-DA 染色法评估低温等离子体对桔青霉孢子ROS 的诱导作用。等离子体处理和孢子悬液的制备方法同1.7 节,每组设置6 个平板重复。染色方法参照前人的方法[13]稍作修改。将孢子悬液进行离心收集孢子,用磷酸缓冲液(0.1 mol/L,pH 7.0) 漂洗2 次后,重悬于20 μmol/LDCFH-DA 中,在28 ℃黑暗条件下孵育20 min 后,再次用磷酸缓冲液(0.1 mol/L,pH 7.0)漂洗去除多余的染料,用激光共聚焦显微镜观测ROS 水平。
1.11 扫描电子显微镜(SEM)和透射电子显微镜(TEM)观测
分别采用SEM 和TEM 评估低温等离子体对桔青霉孢子形态和超微结构的影响。每组设置6个平板重复。扫描电镜孢子样品的获取方法同1.7节,样品在2.5%的戊二醛溶液中4 ℃固定过夜;倒掉固定液,用磷酸缓冲液(0.1 mol/L,pH 7.0)漂洗样品3 次;用1%的锇酸溶液固定样品;去除锇酸废液,用磷酸缓冲液(0.1 mol/L,pH 7.0)漂洗样品3 次;依次用体积分数30%,50%,70%,80%,90%,95%的乙醇和无水乙醇对样品进行脱水处理,最后样品用无水乙醇重悬后,在临界点干燥仪中进行干燥。干燥后的样品进行镀膜处理,置于扫描电镜下观察。
透射电镜样品的固定和漂洗处理与扫描电镜
的样品处理类似,之后依次用体积分数30%,50%,70%,80%的乙醇溶液对样品进行脱水处理,随后过渡到90%和95%的丙酮溶液中,最后用纯丙酮处理2 次。依次先后用Spurr 包埋剂与丙酮1∶1(体积比)和1∶3(体积比)混合液对样品进行渗透处理;最后在室温下纯包埋剂处理样品过夜。将经过渗透处理的样品包埋起来,70 ℃加热过夜,即得到包埋好的样品;在超薄切片机中切片,经柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液各染色5~10 min;最后在透射电镜下观察。
1.12 数据分析
数据采用“平均值± 标准差”表示,采用SPSS 19.0 统计软件(SPSS 公司,美国)对数据进行方差(One-way ANOVA)分析,并用Duncan 检验进行多重比较差异显著性检验。
2 结果
2.1 低温等离子体对杨梅果实腐烂率的影响
杨梅果实在4 ℃贮藏条件下的腐烂率随着贮藏时间的延长而增加。对照组在贮藏到第15 天时腐烂率达到了34.67%,而经等离子气体处理的杨梅果实腐烂率与对照组相比有了明显降低,处理时间间隔为12,24,36,48 h 的处理组腐烂率分别为11.33%,12.00%,15.33%,28.67%,较对照组分别降低了23.34%,22.67%,19.34%,6.00%(图2)。由此可见,低温等离子气体对杨梅果实有较好的降腐效果,并且处理时间的间隔越短,效果越明显。

图2 低温等离子体对杨梅果实腐烂率的影响Fig.2 Effect of cold plasma on the decay rate of Chinese bayberry
2.2 低温等离子体对桔青霉侵染的杨梅果实病程的影响
桔青霉侵染杨梅果实后,病斑扩展迅速。如图3a 所示,接菌24 h 后对照组果实的菌斑面积就已经达到果面面积的52.00%,菌斑呈不规则形状,表面产生大量深绿色的孢子,外沿可见一圈白色菌丝。6 A 电流所产生的低温等离子体显著抑制了杨梅果实桔青霉病斑的扩展,并且其抑制效果随处理频次的增加而增强。处理时间间隔越短,病斑的面积越小且病程明显减缓,如图3b 所示,在接种后第2 天,等离子体处理间隔为48,24,12 h组的果实病斑面积与对照组相比分别缩小了20%,45%,49%(P<0.05),其中,间隔24 h 处理组与间隔12 h 处理组之间病斑面积无显著性差异(P>0.05)。因此,采用6 A 电流所产生的低温等离子体每24 h 处理果实1 次对于桔青霉引起的杨梅果实病害防控最为经济、有效。桔青霉在杨梅果实中的发病似乎有一定的自限性,各处理组的病斑面积随着时间的推移并无明显扩散迹象。
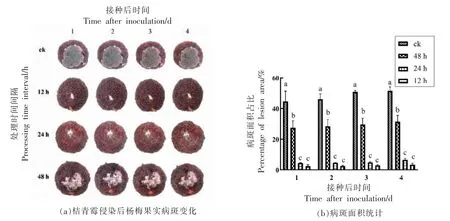
图3 低温等离子体对桔青霉侵染的杨梅果实病程的影响Fig.3 The inhibition effects of cold plasma treatment on the disease progression of P.citrinum inoculated Chinese bayberry
2.3 低温等离子体对桔青霉的体外抑制作用
低温等离子体可以显著抑制桔青霉在平板上的生长,并且其抑制作用与制备低温等离子体的电流强度呈正相关。此外,低温等离子体的处理时间越长,对桔青霉的抑制效果越好(图4a 和4c)。3~6 A 电流所产生的低温等离子体处理1 min,能抑制绝大多数桔青霉菌体生长,而仍有少量菌体未被杀灭,在平板中可见零星生长的菌落;而将处理时间延长至3 min 时,5 A 和6 A 电流所产生的低温等离子体处理组的桔青霉生长完全被抑制,培养第4 天平板中仍未有肉眼可见的菌落(图4b 和4d)。因此,5 A 以上的电流强度下产生的等离子体处理3 min 以上,对桔青霉能起到较为彻底的抑制效果。

图4 低温等离子气体对桔青霉的体外抑制作用Fig.4 The inhibition effects of cold plasma treatment on the growth of P.citrinum in vitro
2.4 低温等离子体对桔青霉孢子坏死和凋亡的诱导作用
进一步采用PI 和Hoechst 33342 两种荧光指示剂联合评估低温等离子体对桔青霉孢子的坏死和凋亡的诱导作用。PI 虽不能通过活细胞膜,但它可以穿过受损的细胞膜并使细胞核物质染色。如图5a 和图5b 所示,经过3 A 电流所产生的低温等离子气体处理1 min 后,有38.46%的孢子被PI染色,处理3 min 后则有91.33%的孢子被染色,表明低温等离子体处理后桔青霉孢子的细胞膜出现了损伤,而且处理时间越长其效果越强。
荧光染料Hoechst 33342 能少许进入正常细胞膜,使其染上的蓝色荧光强度较低,而凋亡细胞的膜通透性增强,因此进入凋亡细胞中的Hoechst 33342 比正常细胞中的多,荧光强度要比正常细胞中要高,此外,凋亡细胞的染色体DNA 的结构发生了改变,从而使该染料能更有效地与DNA 结合,并且凋亡细胞膜上的p-糖蛋白泵功能受到损伤,不能有效地将Hoechst 33342 排出到细胞外,使之在细胞内积累增加等,都使凋亡细胞的蓝色荧光增强。如图5c 和图5d 所示,经过3 A 电流所产生的低温等离子气体处理1 min 和3 min 后,Hoechst 33342 染色阳性的细胞分别达到84.44%和92.09%,处理1 min 和3 min 的效果无显著差异(P<0.05)。由此可以推测,在低强度的等离子体短时间处理条件下,可以造成桔青霉孢子的凋亡。
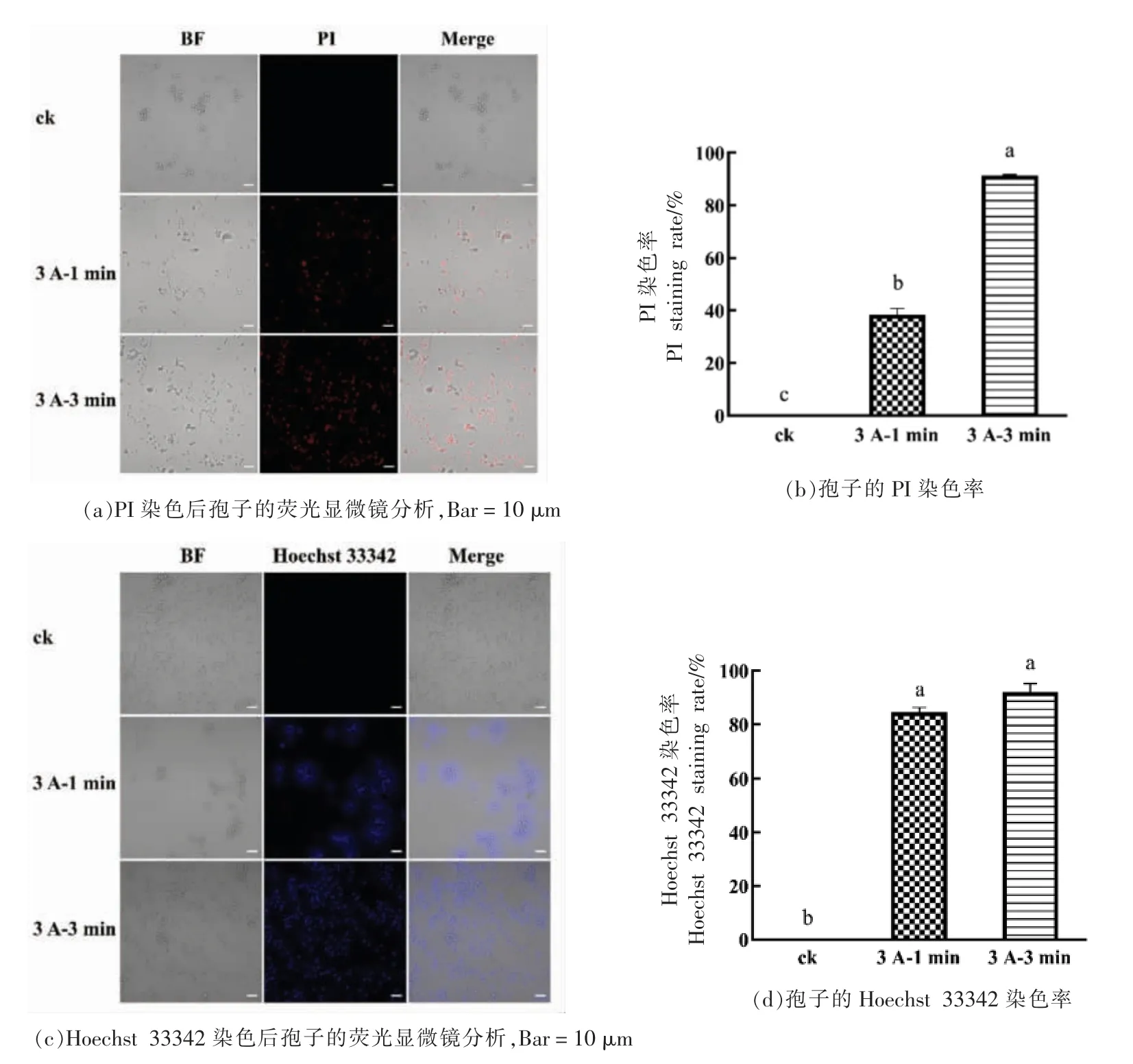
图5 低温等离子体对桔青霉孢子坏死和凋亡的诱导作用Fig.5 The induction effects of cold plasma on the necrosis and apoptosis of P.citrinum spore
2.5 低温等离子气体对桔青霉孢子ROS 积累的诱导作用
采用DCFH-DA 荧光染料评估低温等离子体对桔青霉孢子ROS 水平的影响。如图6a 所示,等离子体处理后,带绿色荧光信号的桔青霉孢子数量显著增加(P<0.05),而对照组孢子未见绿色荧光信号,表明等离子体处理显著诱导了桔青霉孢子内ROS 的积累。统计结果表明,等离子气体处理1 min 后DCFH-DA 染色阳性的孢子比例为26.79%,而当处理时间延长至3 min,这一比例上升至82.28%,组间差异显著(P<0.05)(图6b)。该结果表明,等离子体处理对桔青霉孢子内ROS 的诱导作用随着处理时间的延长而增强。

图6 低温等离子气体对桔青霉孢子ROS 积累的诱导作用Fig.6 The induction effects of cold plasma on ROS accumulation in P.citrinum spores
2.6 低温等离子体对桔青霉孢子形态和超微结构的影响
经低温等离子体处理后的桔青霉孢子的超微结构发生了明显的变化。SEM 观测结果显示,未经处理的桔青霉孢子呈饱满的规则椭圆球状,3 A电流产生的低温等离子体处理1 min 后,孢子表面虽出现破裂的痕迹,但仍保持着基本形状。而当处理时间延长至3 min,孢子发生破裂,结构被完全破坏(图7)。
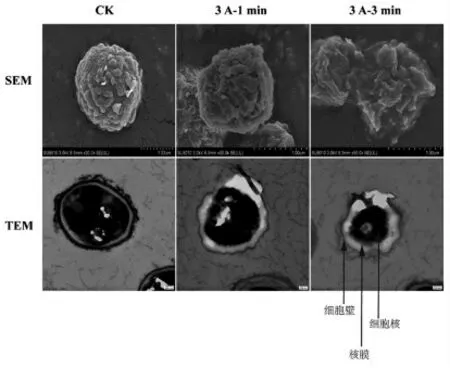
图7 低温等离子体处理后桔青霉孢子形态和超微结构的变化Fig.7 Changes of morphology and ultrastructure of P.citrinum spore after cold plasma treatment
进而采用TEM 对孢子的超微结构进行观察。结果显示,未经处理的孢子细胞壁完整光滑,细胞核也呈现规则的圆形,而经过3 A 电流产生的低温等离子体1 min 和3 min 处理的孢子均出现了明显的形态变化,如细胞壁破裂,细胞核萎缩,胞质外泄,核膜和细胞器模糊等。
3 讨论
针对杨梅采后问题,前人开展了低温贮藏技术、气调贮藏技术、热处理技术、外源物质保鲜技术等方面的研究[14-15]。在实际生产中,目前最常使用的技术为低温贮藏结合减压保鲜技术。王威等[16]通过预冷与1-MCP 处理结合的方式能在5 d 内维持杨梅果实货架期腐烂率低于10%;龙杰[15]采用减压处理的方法对杨梅果实进行保鲜,发现处理9 d 后果实腐烂率与对照差异不显著。本研究采用低温等离子体对杨梅果实进行采后贮藏期间间歇性处理的方法,使果实在贮藏第7 天的腐烂率仍维持4%以下,远低于对照组(10.67%)。处理间歇时间越短,防腐效果越好,并且随着贮藏时间的延长,处理组与对照组之间的差异显著。其中,间歇12 h 处理组贮藏第13 天的腐烂率低于10%,显著优于对照组(32%),也优于前人所报道的预冷结合1-MCP 处理和减压处理。前人也尝试利用等离子体的其它形态对杨梅进行保鲜研究。Ma 等[17]利用低温等离子活化水(介质阻挡放电)浸泡杨梅果实,发现浸泡2 min 后的果实在3 ℃贮藏8 d 后腐烂率为21.05%,较清水浸泡的对照组腐烂率(45.67%)显著下降。然而浸泡处理后还需经过吹干等步骤,考虑到杨梅属于无果皮包被的浆果,不利于其后续处理和防腐保鲜。相较之下,本研究所采用的低温等离子体为气体形态,处理方便且无残留,更加适用于杨梅等易受损伤的浆果类果实。
低温等离子体对果实的防腐保鲜效应与其抑菌效果有关。前人已有大量的研究报道低温等离子体技术对细菌和真菌等具有抑制或杀灭效果。在抑制细菌方面,Kelly-wintenberg 等[18]报道了辉光放电等离子体能有效杀灭聚丙烯表面的嗜热脂肪杆菌、金黄色葡萄球菌、枯草杆菌和大肠杆菌;李振钢等[19]报道了APPJ 氩气常压低温射频等离子体可快速有效地杀灭大肠埃希菌。在抑制真菌方面,季龙飞[20]发现等离子体处理对白色念珠菌具有明显的抑制效果。等离子体对于果蔬病原菌的抑制作用,也有相应的报道。王卓等[21]用低温等离子体处理蓝莓,使果实表面细菌和真菌数量分别下降1.75 lg(CFU/g)和1.77 lg(CFU/g);气体沿面放电低温等离子体对苹果和猕猴桃等果实的主要致病菌扩展青霉(P.expansum)也有非常好的杀灭效果,且等离子体处理时间越长杀菌效果越好[22];张花利[23]的研究发现低温射频等离子体在最佳条件下对灰霉菌(Botrytis cinerea)的杀灭作用几乎达到了100%。目前关于等离子体对杨梅果实病原菌的杀灭作用研究甚少。本研究发现低温等离子体对杨梅果实主要病原菌桔青霉具有良好的杀灭效果,当强度达到一定程度时,能100%抑制桔青霉。该研究结果进一步完善了低温等离子体的抑菌谱,也扩大了低温等离子体的应用范围。
关于等离子体对致病菌的灭活原理,有学者提出细胞膜破裂说,即当等离子体活性组分作用于致病菌细胞膜时,或是氧化细胞膜上的磷脂双分子层、膜蛋白以及膜脂质等,或是积累电荷造成细胞膜破裂,致使细胞膜表现形成结构性缺陷或穿孔。致使更多的等离子体活性组分进入到细胞内部,细胞膜内的细胞质和细胞器泄漏出来[24]。前人的研究主要通过PI 染色检测孢子坏死情况以及电镜观察孢子的超微结构变化来研究等离子体杀菌的作用机理。等离子处理后的白色念珠菌在透射电镜和扫描电镜下可观察到表面皱缩、凹陷,细胞壁和细胞膜破裂,胞内细胞质外溢等现象[25];等离子体处理后的金黄色葡萄球菌PI 染色呈阳性[26];本研究中发现低温等离子体处理后,桔青霉的超微结构变化和PI 染色结果与前人报道的现象一致,表面低温等离子气体能迅速破坏桔青霉细胞结构,严重影响菌体活力。在本研究中,还进一步采用了荧光染料Hoechst 33342 对桔青霉的孢子凋亡情况进行检测,发现等离子体处理1 min就能够诱导大部分的桔青霉孢子凋亡。细胞内ROS(包括超氧阴离子、过氧化氢、羟基自由基和单线态氧等) 的产生和消除失调导致的 “氧化应激”被认为是造成细胞成分被破坏、微生物死亡的重要原因[27-28]。由于等离子体中也存在大量的ROS成分[9],前人的研究发现低温等离子体诱导了黄曲霉孢子中ROS 的产生[29],本研究也采用DCFHDA 染色法检测了等离子体对桔青霉ROS 的诱导作用,发现低温等离子体处理后的桔青霉孢子内积累了大量的ROS,这与前人对黄曲霉的研究结果一致,表明低温等离子体对桔青霉凋亡的诱导作用与ROS 的积累有关。
4 结论
低温等离子体可通过促进细胞内ROS 积累,破坏细胞膜的完整性,诱导孢子凋亡来抑制杨梅果实主要病原菌——桔青霉,从而降低杨梅果实贮藏期间的腐烂率。相较于传统的杨梅保鲜方法,低温等离子体具有处理方法简便、无残留、可与低温贮藏库整合使用等优点,在杨梅果实中具有潜在的应用价值,同时也为其它易损伤、难保鲜的浆果类采后病害防治提供了一种经济、环保的策略。

