核桃根际土壤一株农用抗生素产生菌的筛选和鉴定
卓平清,王 瀚 ,赵淑玲,王弋博,叶文斌,田凤鸣
(1.陇南师范高等专科学校 农林技术学院, 甘肃 陇南 742500;2.陇南特色农业生物资源研究开发中心, 甘肃 陇南 742500;3.天水师范学院 生物工程与技术学院, 甘肃 天水 741000)
农药是农业发展的基本保障之一,化学农药的使用已引发了严重的环境问题.生物农药是指由微生物菌体或微生物产生的代谢产物或植物提取物制备而成的具有农药特性的产品,可分为农用抗生素、植物源农药、微生物农药和动物源农药等[1].生物农药以其安全、高效和环境友好的特点越来越受到人们的重视.抗生素是指一类由微生物等次级代谢活动产生,具有一定抑菌活性的天然产物[2],由于其优良的生物活性,被广泛应用于农业、畜牧业和生物医药等领域[3].农用抗生素[4]是应用于农业生产方面的抗生素,如用于防除病、虫害及杂草的抗生素[4],是由细菌、真菌和放线菌等微生物在发酵过程中产生的能够抑制危害农作物的有害生物的次级代谢产物.
抗生素产生菌有细菌、放线菌和真菌,其中约75%是由放线菌产生的,用于临床和农业生产上的抗生素中60%以上也是来源于放线菌[5].放线菌中的链霉菌更是产生抗生素的重要菌种.链霉菌是一种革兰氏染色阳性的放线菌,细胞结构与细菌相近,没有真菌所含的纤维素和几丁质,细胞核没有核膜,核糖蛋白的亚单位是30 S和50 S,因此和细菌一样均属原核生物界.放线菌主要分布在土壤环境中,因其代谢产物结构新异,在药物开发领域备受关注[6].随着耐药性的不断增加,迫切需要研发出新型抗生素来应对耐药菌[7],而作为农用抗生素的生物农药就显得非常重要.作为绿色农业重点推广使用的新型药剂——微生物农药,将逐渐成为化学农药的替代品.分离并筛选出具有抑菌活性的放线菌,研制开发新型的农用抗生素生防菌剂是当前植物病害防治的重要发展方向[8].本文从陇南成县周边多处核桃根际采集土样筛选能产生农用抗生素的放线菌,结合形态学和分子生物学的方法对具有高抑菌活性的放线菌进行了菌种鉴定,为后期抑菌活性的研究、抗菌活性成分的分离鉴定及生防农药的开发提供一定的理论基础.
1 材料与方法
1.1 材料
1.1.1 供试样品
供试土壤采自甘肃省陇南市成县观光园核桃根际及陇南师专梁山校区核桃树根际土壤.采集核桃根际土,取根际10 cm~30 cm土壤装入无菌袋中并标记.对所采集的土壤样品进行风干和研碎并筛封装于无菌袋中4℃保存备用.
1.1.2 供试菌株
大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus)和枯草芽孢杆菌(Bacillussubtilis)由天水师范学院生物工程与技术学院微生物实验室提供.
1.1.3 培养基
试验中用到的培养基包括:LB液体和固体培养基、高氏一号液体和固体培养基、含3%的重铬酸钾高氏一号固体培养基、察氏琼脂培养基、马铃薯葡萄糖琼脂培养基、淀粉铵琼脂培养基、葡萄糖酵母膏琼脂培养基和克氏一号琼脂培养基.
1.1.4 主要试剂
0.10%吕氏碱性美蓝染色液(麦克林);细菌基因组提取试剂盒(50次/盒),天根生化科技有限公司;PCR 扩增试剂盒及引物购自北京六合华大基因科技有限公司.
1.2 方法
1.2.1 土壤放线菌的分离和纯化
采用传统的梯度稀释涂布法和划线分离法筛选和纯化土壤放线菌.取10.00 g风干过筛处理过的土壤样品加入装有90 mL无菌生理盐水的250 mL锥形瓶中,28℃、150 r/min条件下震荡培养30 min,静置30 min后再用无菌生理盐水稀释到10-3、10-4和10-5备用.各取上述菌悬液200 μL分别涂布于含有3%重铬酸钾的高氏一号固体平板上,28℃恒温培养5 d,挑取单菌落转移到无菌高氏一号平板上,再采用区段划线法进行纯化,重复3次,对获得的稳定菌株进行编号并保存.
1.2.2 农用抗生素产生菌的筛选
以大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌为供试菌株,采用琼脂块法[9]进行初筛.琼脂块法方便简洁且便于观察,适用于大量菌株的初筛,可以大大提高筛选效率.将供试菌株大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌接种于LB液体培养基中活化培养24 h,分离获得的放线菌涂布于高氏一号固体平板上,28℃培养7 d后,用直径9 mm无菌打孔器取放线菌菌块接种于已涂布供试菌株的LB平板上,每块平板放置2块~4块菌块.每种供试菌株做4个平行.28℃恒温培养3 d,观察并测量抑菌圈的大小,采用“十”字法测量抑菌圈直径,取其平均值.
复筛采用改良牛津杯法[8].将上述具有较高抑菌活性的菌株接种到LB液体培养基中,在28℃和180 r/min条件下震荡培养8 d,发酵液4200 r/min离心15 min,再用0.22 μm的滤头将上清液过滤除菌备用.用直径为7 mm的无菌打孔器在已涂布供试菌株的LB平板上打孔,去掉琼脂块,在孔中加入100 μL无菌发酵液,做4个平行,28℃培养24 h,观察抑菌圈大小,采用“十”字法测量抑菌圈直径,取其平均值.
1.2.3 农用抗生素产生菌株的鉴定
1.2.3.1 形态特征观察
将抑菌活性最强的菌株分别划线接种于高氏一号琼脂培养基、察氏琼脂培养基、马铃薯葡萄糖琼脂培养基、淀粉铵琼脂培养基、葡萄糖酵母膏琼脂培养基和克氏一号琼脂培养基上,28℃恒温培养7 d~15 d,观察营养菌丝、气生菌丝颜色及有无可溶性色素.采用插片法观察菌株在高氏一号培养基上的营养菌丝、气生菌丝和孢子丝等特征,其方法为:将菌株涂布接种于高氏一号固体平板上,同时在无菌操作下斜插上3个~4个无菌盖玻片在平板上,置于28℃恒温条件下培养8 d后,将盖玻片取出盖在滴有0.10%美蓝染液上,用显微镜观察其菌丝情况.
1.2.3.2 生理生化特性
生长温度测定:培养在高氏一号培养基上的菌体分别在4℃、12℃、20℃、25℃、30℃、35℃和40℃培养7 d后测定其生长情况.耐盐性:除去NaCl的LB液体培养基中加入2%、3%、5%、7%和10%的NaCl液体培养7 d后测定生长情况.生长曲线测定:将菌株接种于装有150 mL 高氏一号液体培养基的250 mL锥形瓶中,以高氏一号无菌液体培养基为对照,置于28℃和150 r/min条件下培养,每隔6 h用722型可见光分光光度计测其OD600处光密度值.每次实验设三个平行样,每个实验重复3次,取其平均值.
生理生化特征参照文献[10-12]进行碳源利用产酸、淀粉水解、明胶液化、纤维素水解和黑色素产生等试验.
1.2.3.3 分子生物学鉴定
采用细菌基因组提取试剂盒提取其基因组DNA,再用1.00%琼脂糖凝胶电泳检测提取的效果.利用通用引物27F (5′-AGAGTTTGATCCTGGCTCAG -3′) 和1492R (5′-GGTTACCTTGTTACGACTT-3′)进行16 S rRNA基因片段的扩增.PCR扩增体系为30 μL:Super Mix 15 μL,Primer F(10 p)1 μL,Primer R(10 p)1 μL,模板(ng/μL)1 μL,ddH2O 12 μL.PCR扩增条件为:94℃,5 min;94℃,1 min,58℃,45 s,72℃,1.5 min,共30个循环;72℃,10 min.扩增产物用1.00%的琼脂糖凝胶电泳检测,后续的测序工作由北京六合华大基因科技有限公司武汉分公司完成序列测定.将获得的测序结果进行NCBI-BLAST比对,以Blast程序对数据库中已登录的序列进行同源性比较分析,采用MEGA 6.0软件和NJ法构建系统进化树.
2 结果与分析
2.1 产抗生素放线菌的分离和筛选
从多个点采集的9份土壤中共分离纯化获得46株放线菌.利用琼脂块法,经初筛获得20株对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌具有抑菌活性的菌株,经过复筛选,确定具有抑菌活性的菌株有18株,其中,菌株KS7对三株供试菌株的抑菌效果最好,且具有非常高的抑菌活性,其琼脂块对大肠杆菌的平均抑菌圈直径为31.25 mm (菌块直径为9 mm),对金黄色葡萄球菌的平均抑菌圈直径为29.72 mm (菌块直径为9 mm),对枯草杆菌的平均抑菌圈直径为35.10 mm (菌块直径为9 mm);菌株KS7无菌发酵液对三株菌株的平均抑菌圈直径分别为17.00 mm、19.17 mm和15.43 mm,抑菌效果非常显著(如下图1和表1所示),有望用于生物农药的开发.其余菌株的抑菌效果很差,平均抑菌圈直径均小于13 mm.
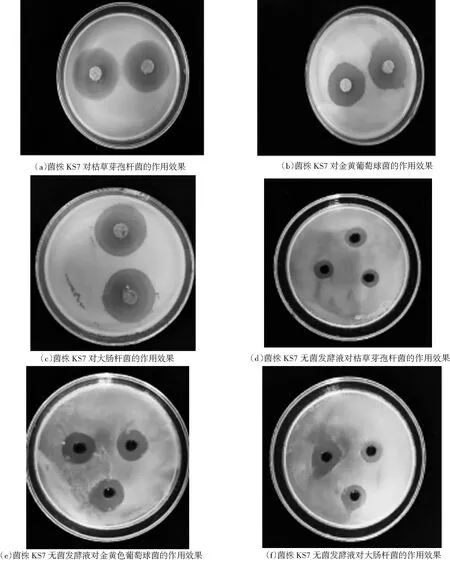
图1 菌株KS7对供试菌株的抑菌效果

表1 菌株KS7对供试菌株的抑菌试验
2.2 农用抗生素产生菌的鉴定
2.2.1 形态学特征
本实验获得一株具有高抑菌活性的菌株,其编号为KS7,该菌株在高氏一号平板上生长迅速,菌落呈白色,圆形或不规则圆形,不易挑起,气生菌丝白色,基内菌丝乳白色,无可溶性色素,显微镜观察菌丝时,可见其气生菌丝发达,孢子丝呈螺旋状(如下图3所示).菌株KS7在不同培养基上的培养特征详见表2、图2和图4.

表2 菌株KS7在不同培养基上的培养特征

图2 菌株KS7培养14 d后的形态特征

图3 菌株KS7的菌丝形态


图4 菌株KS7在不同培养基上培养7 d的形态特征
2.2.2 生理生化特性
KS7菌株可在12℃~40℃下生长,其最适生长温度为25℃~30℃.耐盐性试验中在2% NaCl下生长迅速且最好,在3% NaCl环境中生长较快且良好;在5% NaCl环境中能生长,但生长很慢;在7% NaCl环境中生长极慢,肉眼可见极少生长;在10% NaCl环境中不生长.该菌株在高氏一号液体培养基上生长迅速,在培养100 h时生长量达到顶点,其生长情况见图5.KS7菌株生理生化特征详见表3.
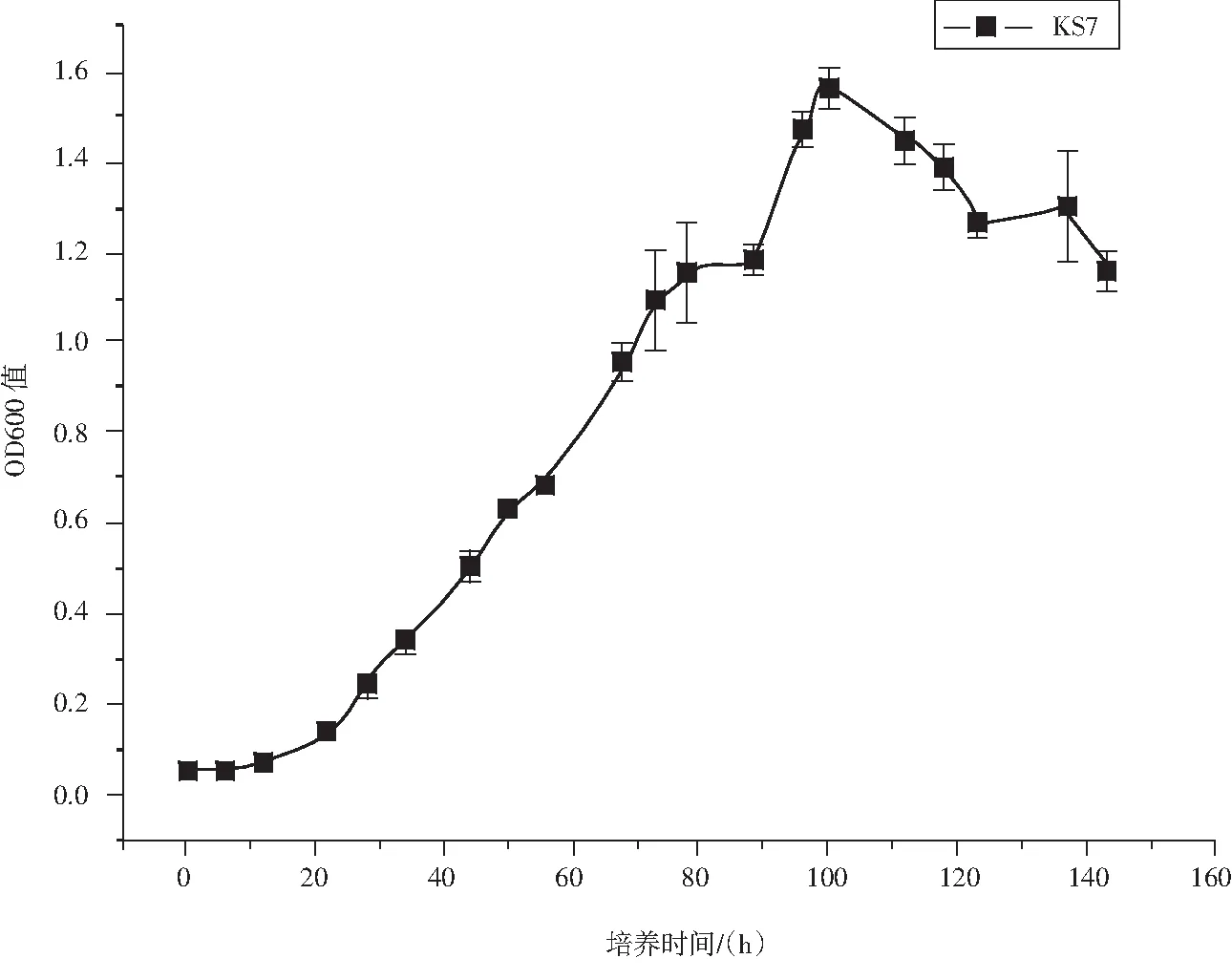
图5 菌株KS7的生长曲线

表3 KS7菌株与Streptomyces coralus SX92菌株[13]的生理生化特征比较
2.2.3 分子生物学分析
将KS7经测序获得的16S rRNA基因序列结果 (1420 bp) 放到NCBI中进行相似性比对,并构建系统进化树 (图6) ,其结果表明,KS7与登录号为MH265970.1的Streptomycescoralus(珊瑚链霉菌)相似性最高,高达99.64%,确定KS7菌株为Streptomyces.
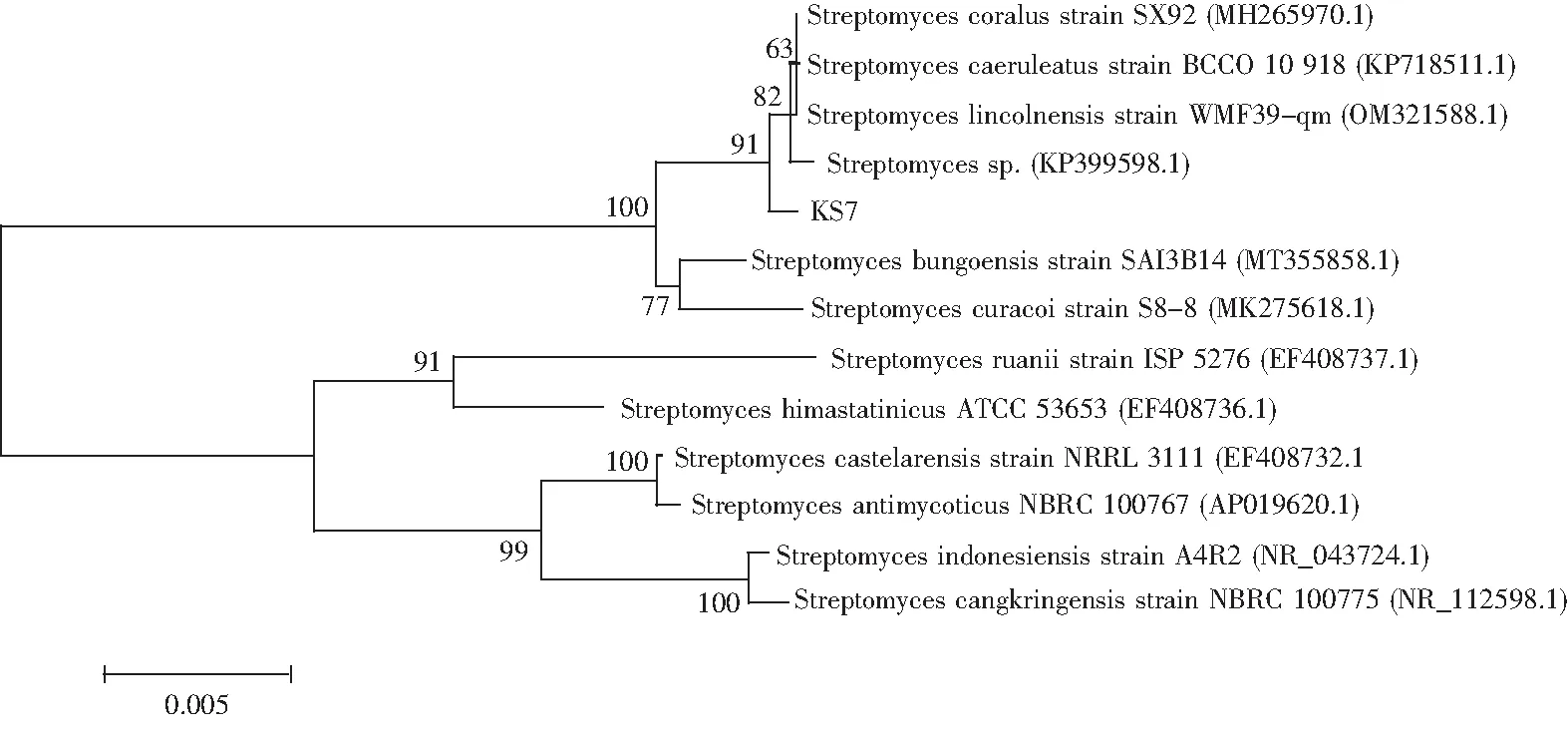
图6 基于菌株KS7的 16S rRNA 基因构建的系统发育树
3 讨论与结论
作为重要生物资源的放线菌,一直备受科研人员们的关注.最先对放线菌进行研究是以挖掘抗生素来解决人类的健康问题,之后才把目光放到农业生产上.目前,对放线菌研究的热点主要为新药的开发、海洋放线菌的抗菌作用和抗肿瘤活性物质[14]、生防菌剂的开发等方面[15],尤其是生防菌剂——拮抗和促生放线菌的研究方面是近年来的一大热点.
本文从陇南成县多点采集土样,共获得46株放线菌,利用琼脂块法和改良牛津杯法经过初筛和复筛,发现能产生抑菌活性的菌株有18株,其中绝大部分放线菌的抑菌活性均很弱,抑菌圈直径均小于13 mm,只有一株KS7菌株抑菌活性最强,且抑菌活性非常高.菌株KS7对枯草芽孢杆菌的抑菌活性最强,平均抑菌圈直径高达35.10 mm;其次是大肠杆菌,平均抑菌圈直径为31.25 mm;对金黄色葡萄球菌的抑菌活性差一些,平均抑菌圈直径也达29.72 mm;该菌株无菌发酵液抑菌活性相较于其菌块弱一些,上述三株供试菌株抑菌圈平均直径分别为15.43 mm、17.00 mm和19.17 mm.可见无菌发酵液对金黄色葡萄球菌抑菌活性最强.综上可见,菌株KS7具有较强的抑菌效果,有望于农用抗生素方面的研究.通过菌种特性、菌落形态特征以及对其基因序列16S rRNA分析,将菌株KS7鉴定为链霉菌属(Streptomyces).该菌株与Streptomycescoralus相似性最高,而目前关于珊瑚链霉菌(Streptomycescoralus)的研究报道比较少.陈奇园等[13]2019年报道了从洛阳烟区烟株根围土壤中分离到的一株珊瑚链霉菌(S.coralusSX92),与本文获得的菌株KS7的16S rRNA基因相似性为99.64%,生理生化特性和菌落特征接近,但在菌落形态和生理生化特性上仍存在部分差异.

