原生质体融合制备三效工程菌HL及其溶藻机理
黄金杰,毛林强,张文艺
(常州大学环境与安全工程学院,江苏常州 213164)
由于人类活动范围的不断扩大与工农业的快速发展,导致大量含有氮、磷等营养元素的污水排入水体,造成水体富营养化程度加深,这会诱导蓝藻的暴发频率加快与持续周期变长。近年来,如何有效地治理蓝藻水华问题成为研究热点。相比于传统物理、化学法治理蓝藻,溶藻细菌因其成本低、安全环保等优点更受国内外学者的关注,但在菌株溶藻过程中往往随着藻细胞的破裂,藻细胞内氮、磷等营养元素会二次释放,使原本的环境水体富营养化程度加重,继而会再度成为藻类的“温床”。通过溶藻菌单一的溶藻作用去处理蓝藻问题难以治本,因此寻找一种兼备溶藻、脱氮、除磷菌株成为解决问题的关键。
目前,在微生物领域原生质体融合已有较为成熟的技术。利用原生质体融合将亲本优势基因发生重组,使获得兼备双亲优良性状的融合菌株获得成为可能。这不仅克服了传统育种方法中的单一特性障碍,还具有传递亲本优势遗传物质完整性的优点。赵晓燕等通过苏云金芽胞杆菌、枯草芽胞杆菌原生质体融合使融合菌株具备双亲的防虫及防病双优势;张安妮等等通过原生质体融合使融合菌株具备双亲的溶藻及降解藻毒素功效。因此利用原生质体融合菌株,既达到溶藻控藻的目的,又能改善水体富营养化,是一种可能实现的想法。
本文通过溶藻菌R1、脱氮除磷菌B8原生质体融合出菌群,经一系列条件比较,挑选出其中1株高效溶藻、脱氮除磷的三效工程菌,对比了其与亲本的溶藻、脱氮、除磷7天的效率。通过考察菌株降解铜绿微囊藻过程中叶绿素a(Chlorophyll-a)浓度与菌株生长速率两者之间的关联关系,建立了该菌株降解铜绿微囊藻的Haldane 模型。利用扫描电镜观察菌株溶藻过程与三维荧光、红外红外光谱分析溶藻产物初步分析菌株溶藻机理,为微生物措施治理蓝藻问题提供一定的理论支撑。
1 材料与方法
1.1 试验材料
1.1.1 样品
(1)菌种 菌株HL 筛选自R1 与B8 原生质体融合的菌群,于4℃冰箱保存。
(2)藻种 铜绿微囊藻购自中国科学院武汉水生生物研究所,藻种编号为FACHB-905。设定培养条件为光照周期比12h∶12h、光照强度3200 Lux、温度25℃。
1.1.2 主要培养基与试剂
(1)培养基 BG-11培养基、牛肉膏蛋白胨培养基:配方详见文献[7],以下简称液培、固培。高渗液体培养基:蛋白胨10g,酵母浸出汁5g,牛肉膏5g,蔗糖170g,加入1000mL 超纯水,调节pH为7.2(固体培养基另加琼脂粉20g/L)。以上培养基均须经高温灭菌(121℃、20min),并冷却至室温后使用。
(2)主要试剂 原生质体稳定液(SMM):依次称取蔗糖71.5g、氯化镁4.273g、顺丁烯二酸2.336g、加入蒸馏水500mL,调节pH至6.5。
1.2 试验方法
1.2.1 三效工程菌制备、纯化与筛选
(1)原生质体融合 分别取10mL 的溶藻细菌R1 和脱氮聚磷菌B8 发酵液于离心机4500r/min 离心10min。弃上清液,收集菌体。用无菌针筒吸取10mL SMM 缓冲液洗涤菌体2 次后,重悬于10mL SMM缓冲液中;酶解、重悬、融合步骤如下。
①酶解 用5mg/L 的溶菌酶对对数生长期R1菌和生长迟滞期B8菌于30℃下酶解45min,将制备的原生质体于45℃热灭活。
②重悬 经离心机3800r/min 离心10min 后,用无菌针筒吸取高渗生理盐水洗涤原生质体2 次后,重悬于10mL高渗生理盐水溶液中。
③融合 将处理后的两个原生质体各取1mL于离心管中,经离心机3800r/min离心10min,弃上清液。加入0.2mL 新生磷酸钙溶液、1.8mL 30%的PEG 4000。经30℃水浴保温40min 后,3800r/min离心10min,弃上清液。用SMM 溶液定容至2mL,再以SMM 溶液梯度分别稀释到10、10、10,吸取25μL 涂布于高渗固体培养基,各梯度做3 个平行,置于25℃恒温培养箱培养48h。
(2)纯化 用接种环挑取分离不同单菌落并培养2~3天,5次平板划线得到纯化菌株。
(3)筛选 将纯化菌株发酵培养,以菌藻比1∶10(体积比)接种,温度为25℃,光照强度为3200Lux,光暗比12h∶12h,光照培养7 天。每天测1 次叶绿素a、总氮(TN)、总磷(TP)含量并计算溶藻率、脱氮率、除磷率,设平行及空白对照3组,比较各组之间的溶藻、脱氮、除磷率。
1.2.2 菌株HL效能与zeta电位变化
将R1、B8、HL 菌液培培养12h,以菌藻比1∶10(体积比)接种于浓度为(1043.28±12.71)mg/m铜绿微囊藻,并在温度为28℃、光照强度为3200Lux、光暗比12h∶12h 的条件下培养7 天。利用乙醇法提取叶绿素,以Chlorophyll-a 浓度表现溶藻效果,每天测1次TN、TP并计算脱氮除磷率,试验重复3次,空白对照组为投加相同比例的灭菌液培。取每天的菌株处理组与对照组各5mL,用Zetasizer(Nano-ZS90,UK)测定其藻细胞表面的zeta电位。
1.2.3 菌株HL降解铜绿微囊藻建模
进行菌株HL 处理不同初始浓度铜绿微囊藻试验来研究藻浓度对菌株生长的影响,并确定菌株降解各浓度铜绿微囊藻的降解曲线。以灭菌接种环挑取纯化5次的菌株HL于液培中活化12h,以菌藻比例为1∶10接种,在28℃、125r/min的摇床中培养,用橡皮塞密封以防止外界因素对铜绿微囊藻污染。同等条件下设平行试验和不接菌空白试验。每天测1次Chlorophyll-a含量。
1.2.4 菌株HL溶藻机理初探
(1)菌株作用组分确定 设置以下5 种处理方式:①培养处于对数增长期菌液(以下皆简称为发酵液);②将步骤①中发酵液经12000r/min处理20min 后的上清液过0.22μm 滤膜,即为除菌发酵液;③将菌液经高温高压(设定121℃、1.0×10Pa)灭活处理20min,即为高温无菌上清液;④收集步骤②滤膜中的菌体,用超纯水洗涤3 遍后,等体积重悬制备菌悬液;⑤液培。将上述5 种菌液按照菌藻体积比1∶10 的比例投加到铜绿微囊藻中,连续观察藻样,并测定各处理组在7 天的溶藻率。
(2)溶藻过程电子显微镜 为观察菌株HL 溶藻过程中藻细胞结构的变化,取对照组与试验组3天、5 天、7 天藻液各10mL,5000r/min 离心5min后,收集藻体,并用2.5%戊二醛固定,经4℃冰箱过夜。弃固定液,用磷酸缓冲液漂洗藻体1次,随后用梯度稀释的乙醇(体积分数50%、60%、70%、80%、90%、95%、100%)依次对藻体进行脱水处理15min,最后冷冻干燥。在扫描电镜(JSM-IT-100,日本电子株式会社)下观察拍照。
(3)溶藻产物的红外光谱 为探究菌株HL 溶藻原理,离心收集对照组和投放菌株HL 的铜绿微囊藻液,对藻体用超纯水洗涤3 次后进行冷冻干燥,取溴化钾(Kbr)固定藻样,傅里叶红外光谱分析仪(FTIR,IS50,美国赛默飞世尔科学公司)上光谱扫描。
(4)溶藻产物三维荧光光谱测定 以不添加菌株的铜绿微囊藻液为对照组,辅以菌株HL 处理第7 天的铜绿微囊藻为实验组,经0.45μm 滤膜过滤后,采用Cary Eclipse 荧光光度计(为220~400nm,增量5nm;为280~550nm,增量2nm;PMT 电压800V,扫描速度1200nm/min))测定溶藻进程的三维荧光谱图,确定菌株HL 溶藻过程中产生溶藻物质及溶藻产物。将三维荧光光谱分为5个区域,每个区域代表一个类型有机物,详见表1。
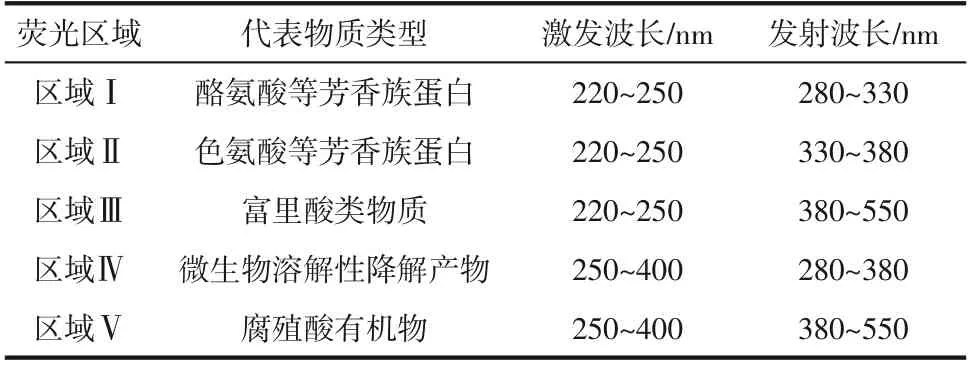
表1 荧光区域划分
2 结果与讨论
2.1 菌株形态及其溶藻、脱氮除磷能力
显微镜观察培养3 天的菌株形态,筛选出5 株性状明显的菌株,各菌株特征如表2 所示。5在7天内溶藻率、脱氮率、除磷率均高于其他菌株,因此选取5作为研究对象,并命名为HL。
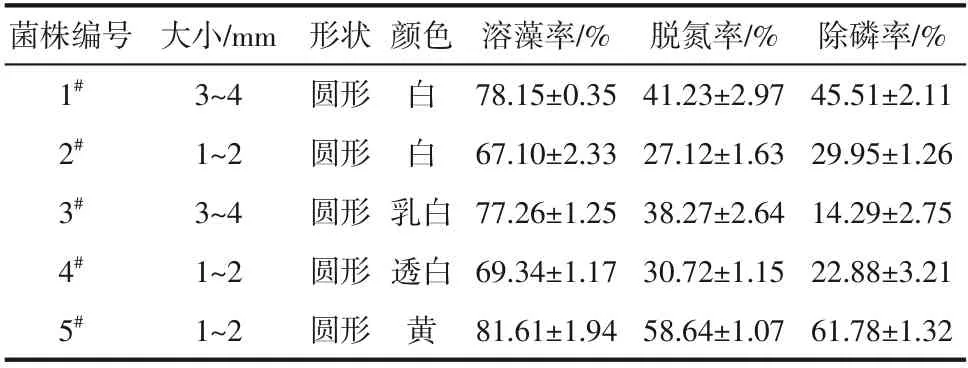
表2 菌株形态特征
2.2 三效工程菌效能与zeta电位
三效工程菌与双亲的溶藻率对比如图1(a),由图1(a)可知,投加B8 菌的7 天内最高溶藻率仅为7.99%±0.70%,推测是液培对铜绿微囊藻的溶藻效果,而B8菌几乎没有溶藻特性;投加R1菌7天的溶藻率总体趋势呈波动上升,在7天时溶藻率显著提升至71.87%±0.45%;投加HL菌的组较双亲每天的溶藻率均显著提升(0.05),7 天的溶藻率达81.61%±1.94%,溶藻效果相较于R1 提升9.84%±1.49%。HL菌在经原生质体融合后,溶藻性能较双亲有着显著提升,从第1天起溶藻率显著大于双亲(0.05),加之本身生长速度极快,故能在相比于双亲更短时间内达到溶藻阈值。三效工程菌与双亲的脱氮率对比如图1(b),由图1(b)可知,投加B8 菌第1 天的脱氮率为14.88%±0.86%,随后呈上升趋势,第7 天时达75.89%±1.50%,展现出较好的脱氮能力;投加R1 菌7 天的脱氮率总体呈缓慢上升趋势,第7 天时达到21.14%±0.64%,说明R1有着一定的脱氮能力,推测R1 是仅为满足自身生长吸收BG-11 培养基中NaNO等盐类作为营养源。投加HL 菌的7 天脱氮率仅在42.14%±1.68%与58.64%±1.07%之间波动,说明HL菌较双亲具有更为稳定的脱氮能力。三效工程菌与双亲的除磷率对比如图1(c),由图1(c)可知,前两天时投加B8菌的除磷率呈现出负增长,第2 天时至-11.25%±2.31%,随后逐渐上升,第7 天时达86.59%±1.26%,说明B8菌适应环境速度较慢,当其发挥除磷作用时,除磷率显著上升(0.05)。投加R1菌的7 天的除磷率总体呈下降趋势,第1 天达到45.36%±1.28%,到第7天时仅为5.50%±0.25%,推测R1 菌本身并不具备除磷特性,仅可能在试验初期大量吸收BG-11 培养基中所添加的磷酸盐作为营养源为满足自身生长需要,故而在试验初期有着较高的除磷率。投加HL 菌的7 天的除磷率相对稳定,最高为第1 天时的69.52%±0.43%,最低为第2 天时(53.30±0.84)%,第7 天时为(61.78±1.32)%,试验说明HL 菌较双亲具有稳定除磷特性。
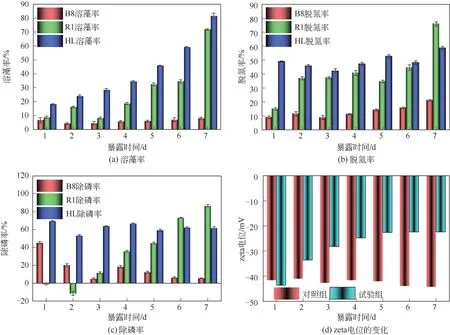
图1 R1菌、B8菌、HL菌的溶藻、脱氮、除磷效率对比与zeta电位的变化
由于藻细胞壁上的羧酸基团或附着藻细胞表面的细胞外聚合物官能团的解离,在天然水体中藻类自带负电荷,而藻细胞团聚和细胞表面的多种胞外聚合物都会影响藻细胞表面电荷。由图1(d)可知,与对照组相比,试验组的zeta电位随试验时间显著增加(<0.05),然后在试验后期逐渐趋于平稳,在试验第7天时,试验组zeta电位为-19.87mV。总体而言,当zeta电位较低时,藻类系统更倾向于凝聚或聚集。具体而言,吸引力大于排斥力,因此分散受到限制并发生凝聚。添加三效工程菌HL 导致了藻细胞表面zeta 电位的降低,在7天时发生了藻类的降解与凝聚沉底的现象,这也与苏俊峰等的研究结果类似。
2.3 菌株降解过程的建模
在生物降解过程中,铜绿微囊藻中初始Chlorophyll-a 浓度起着重要作用,类似于某些底物,如苯酚等会对生物质的降解活性产生抑制作用, 故而进行试验从(486.69±13.89)mg/m至(3135.43±16.27)mg/m的7 个不同初始Chlorophyll-a浓度对菌株降解过程影响的试验。如图2所示,实际上Chlorophyll-a 浓度的降解与时间成线性关系,因此,对于所有初始浓度的Chlorophyll-a降解速率都是恒定的。尽管生物降解率不会随时间变化,但会随着Chlorophyll-a初始浓度的增加而增加,而在(1525.67±27.22)mg/m时达到最大值,当初始Chlorophyll-a 浓度增加并超过此值时都会降低Chlorophyll-a 的去除速率,这可以归因于铜绿微囊藻的抑制作用。另一方面,在低Chlorophyll-a浓度下较低的生物降解速率是受底物浓度的影响,其中可用于微生物降解的Chlorophyll-a较少。
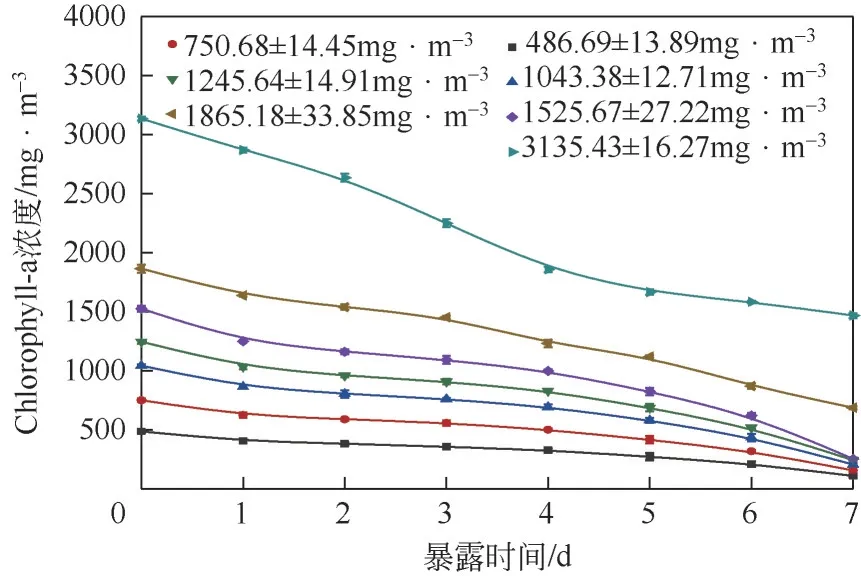
图2 不同初始Chlorophyll-a浓度对菌株降解过程的影响
在任何生物降解过程中都涉及将生物质(菌株)的特定生长速率与底物(Chlorophyll-a)的消耗速率的相互关系。微生物的生长可以解释为活细胞数量的增加或生物量的增加,微生物生长与Chlorophyll-a 浓度之间的关系可被认为是决定微生物处理各种浓度的铜绿微囊藻中降解效率的关键因素。在铜绿微囊藻微生物降解试验中,以藻液中Chlorophyll-a 作为底物,因此推测Chlorophyll-a 浓度与微生物生长速率存在关联性。而根据Chlorophyll-a 浓度范围,可以使用非抑制性或抑制性动力学模型来估算这种非线性关系。Monod模型和Haldane 模型是两种生物降解模型。Monod 模型认为铜绿微囊藻是非抑制性化合物,忽略其对菌株的抑制作用,对底物生物降解,一般采用Monod动力学模型描述微生物的比降解速率,但有的底物本身在被降解的同时会对微生物产生一定的毒性,当浓度达到一定值时会抑制底物的降解。故用Haldane 模型(图3),因其考虑了铜绿微囊藻的抑制作用,见式(1)。
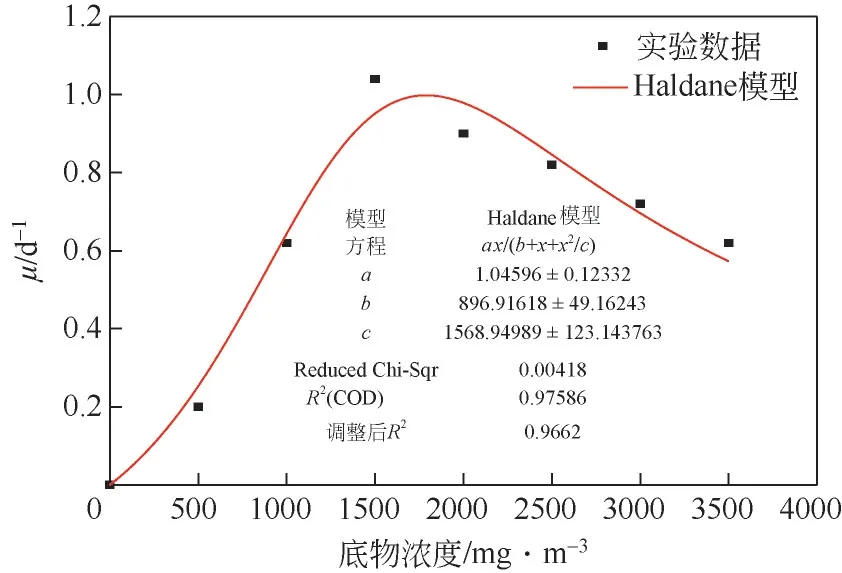
图3 菌株生长速率的实验数据与Haldane模型拟合
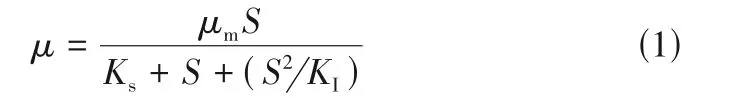
式中,为微生物比增长速率,d;为微生物最大比生长速率,d;为底物浓度,mg/m;为半饱和速率常数,mg/m;为微生物生长抑制常数,mg/m。
利用式(1)中关系,Haldane 模型可预测随着铜绿微囊藻的浓度变化的菌株生物降解率(),其中菌株比生长速率()是由菌体细胞干质量和时间半对数图绘制最小二乘拟合而得。使用Origin非线性回归将实验数据拟合到Haldane 模型,该模型使用Levenberg-Marquardt算法查找在数据与模型方程之间具有最佳拟合的参数。将模型与实验数据进行比较,Haldane 抑制模型具有很好的拟合度,其中最大比生长速率()为(1.046±0.12)d,半饱和常数()为(896.92±49.16)mg/m,抑制常数()为(1568.95±123.14)mg/m。观察到的比生长速率随着底物浓度增加到一定浓度而线性增加,这与裴海燕等的研究结果类似,当铜绿微囊藻中Chlorophyll-a 浓度在0~1568.95mg/m时,菌株HL对藻类降解速度与藻类浓度呈线性关系。然而在该临界浓度之后,在Haldane 模型中观察到急剧下降,尤其当浓度高于1568.95mg/m时,对铜绿微囊藻的生物降解能力具有相当大的抑制作用。
2.4 溶藻效果的电镜观察
采用扫描电镜对菌株作用于铜绿微囊藻细胞进行形态观察,如图4所示,其中图4(a)为对照组藻细胞,直径为2~3μm,藻细胞形态饱满,结构完整,呈现出规则的球形且藻细胞表面完好。图4(b)~(d)为溶藻阶段3天、5天、7天的藻细胞形态。试验中前期(3天、5天)藻细胞经过菌株HL的作用后,形态发生变化,藻细胞细胞壁被破坏,胞内物质外泄,细胞结构较图4(a)而言变得松垮干瘪,细胞质出现空化,藻细胞之间紧密地堆叠在一起,可能是藻细胞表面的黏质胶被破坏,使得细胞周围黏性物质增加,说明菌株HL 能够释放某种或某些物质致使藻细胞破裂死亡。至试验后期(7天)时,图4(d)中藻细胞几乎均破裂,这也印证三效工程菌HL 在7天时的高溶藻率。

图4 菌株HL的溶藻效果电镜图
2.5 菌株的溶藻作用组分
不同菌液处理铜绿微囊藻可能会造成溶藻细菌HL的溶藻效果有所差异,试验结果如图5,由图5可见,发酵液溶藻能力高于其他试验样本,7天溶藻率为80.83%%±0.42%;经0.22μm 针式滤除器除去菌体后的发酵液仍有溶藻效应,7 天溶藻率为76.17%±2.31%,说明HL菌并未因菌体的去除而失去溶藻效应,推测HL 菌主要溶藻方式为间接溶藻,而溶藻细菌发酵液溶藻率比无菌发酵液溶藻率高,可能是发酵液的菌体仍在继续分泌某种活性物质;菌悬液在7天溶藻过程中没有产生明显溶藻效应,7 天溶藻率为6.78%±0.40%,推测菌体在遇到新环境时,能够再次分泌溶藻活性产物,同时也验证了发酵液溶藻率高于无菌发酵液溶藻率的原因;经高温处理的菌体发酵液依旧具有溶藻能力,7天溶藻率为65.9%±0.36%,相较于发酵液的溶藻率有一定的下降,推测有多种溶藻物质,有溶藻物质具有耐高温特性;液培本身具有一定的溶藻能力,7天溶藻率为13.75%±0.21%。
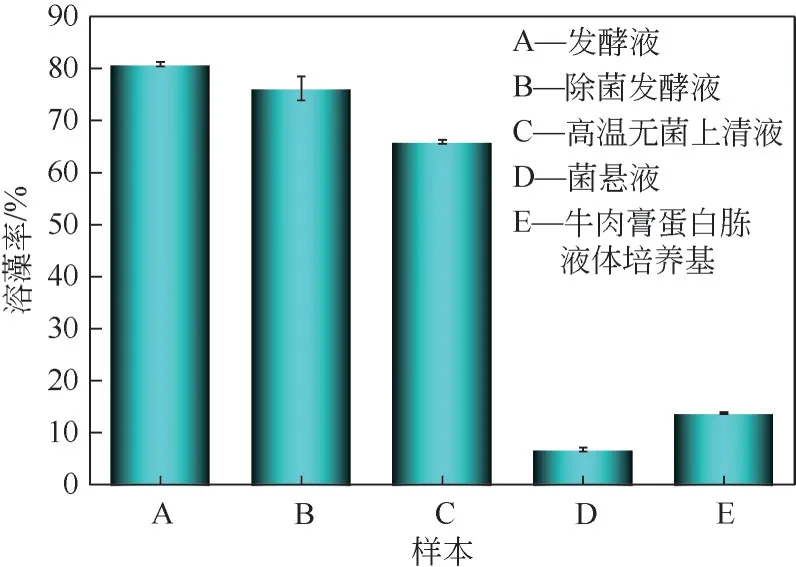
图5 不同处理方式对铜绿微囊藻的效果
2.6 溶藻产物的三维荧光分析
三维荧光光谱可以对荧光化合物进行定性定量分析,菌株HL 溶藻产物的荧光特性如图6 所示。试验主要产生2个明显的荧光基团,主要涉及的是含有类色氨酸的微生物溶解性降解产物、生物来源的类蛋白质物质与类腐殖质荧光峰。从图6中可以看出,在对照组中,峰D 与峰E 清晰可见,而峰A、B、C强度低而不清楚。峰A属于Ⅰ区,主要代表包括酪氨酸等芳香族蛋白。峰B属于Ⅱ区,主要代表包括色氨酸等芳香族蛋白。峰C属于Ⅲ区,主要代表包括富里酸类物质。峰D属于Ⅳ区,主要代表包括微生物溶解性降解产物样品(SMP)。峰E属于Ⅴ区,主要代表包括腐殖酸有机物,该部分物质主要是由藻细胞死亡后所产生的,较低的响应值说明此时藻类活性好。暴露于菌株HL 7 天后,与对照组相比,峰D 的荧光强度减少,而A、B、C、E 的荧光强度增加。该结果表明,在菌株作用下,释放出芳香族氨基酸等活性物质造成铜绿微囊藻藻细胞破裂,继而导致腐殖酸物质的大量释放。
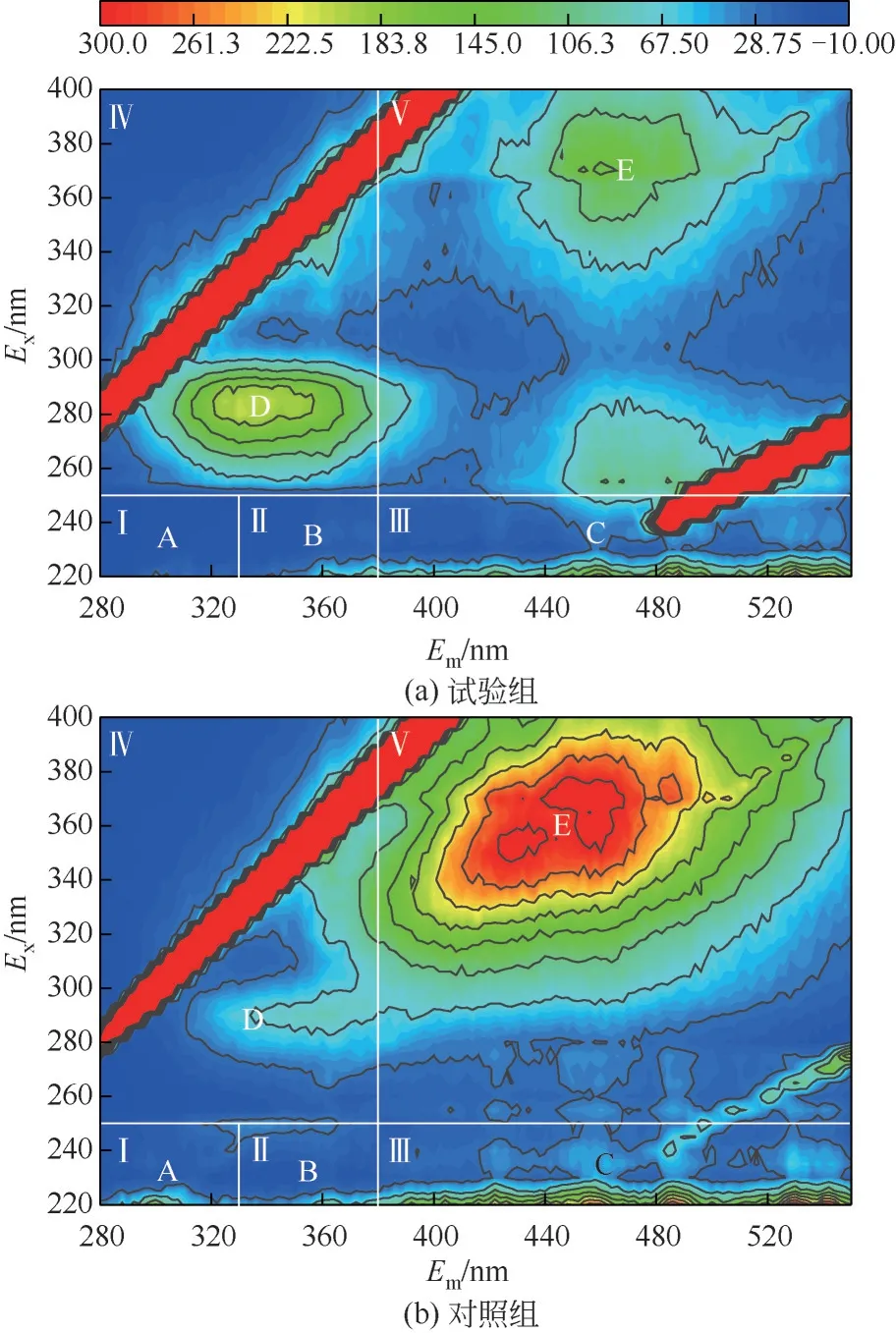
图6 溶藻进程中三维荧光图
2.7 溶藻产物的傅里叶红外光谱分析
应用FTIR对对照组和菌株HL发酵液处理后的产物进行分析,结果见图7。由图7 可见,对照组和处理组的红外光谱主要吸收峰位置大致一致,峰形非常相似,但各吸收峰的相对强度有所差异,用菌株处理铜绿微囊藻的吸收峰强度比空白组弱。溶藻前后的样品光谱图均主要产生3个峰,由于吸收峰强度与化学键之间的极性呈正相关关系而出现不同强度的峰,峰的位置说明溶藻前后的铜绿微囊藻液中存在相同的官能团。从峰的归属看,A 处在3134.24cm吸收峰相对较弱,尖锐峰形,属于—NH 键伸缩振动所在位置,推测是酰胺类化合物存在,可能为类腐殖酸等物质;B 处在1637.27cm为酰胺类Ⅰ带,是C==O 键伸缩振动区,说明对照组与试验组均含有酰胺类物质且铜绿微囊藻的细胞蛋白质被破坏;C 处在1400.58cm处有最强特征峰,强度大,峰尖锐,属于COO键对称伸缩,表明藻液中可能有芳香族氨基酸存在,可能是由于藻细胞结构遭到破坏,溢出的细胞质被吸收。在1083.72cm处的吸收峰是伯醇C—O伸缩振动区。此外,在2935cm附近还存在来自于蛋白质和脂类的—CH、—CH对称、反对称运动产生的峰。结合上述峰分析、SEM图及三维荧光图来看,对照组中藻细胞内含有酰胺类物质,通过菌株HL 间接溶藻的作用,藻液中酰胺类物质浓度发生变化,可能是菌株HL 释放分泌芳香族氨基酸等活性物质破坏藻细胞壁、藻蛋白质,藻细胞破碎死亡,产生类腐殖酸类物质。
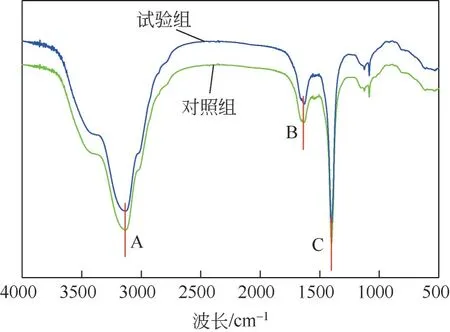
图7 菌株HL溶藻产物红外光谱图
3 结论
(1)经原生质融合出的融合菌株HL 表现出高效溶藻和稳定脱氮除磷能力,在7天的溶藻率、脱氮、除磷率分别为(81.61±1.94)%、(58.64±1.07)%和(61.78±1.32)%。
(2) 菌株HL 降解铜绿微囊藻的过程符合Haldane 模型,其中最大比生长速率() 为(1.046±0.12)d,半饱和常数()为(896.92±49.16)mg/m,抑制常数()为(1568.95±123.14)mg/m。当浓度大于(1568.95±123.14)mg/m时,铜绿微囊藻会对菌株HL降解Chlorophyll-a产生抑制作用。
(3)通过对菌株作用组分判定及扫描电镜可以得出,菌株HL 的溶藻手段为间接溶藻,对铜绿微囊藻细胞壁进行破坏,导致藻细胞失活,藻细胞物质流失而死亡。由三维荧光与红外光谱分析可以初步判断:通过释放芳香族氨基酸等活性物质破坏藻细胞,藻细胞死亡后释放大量腐殖酸物质。

