马疱疹病毒1型gp2基因分子特征
刘建华,吴桂灵,胡 月,加尔肯,贾钦瑞,孙文程,撒瑞雪,张嗣玉,冉多良
(新疆农业大学动物医学学院,新疆 乌鲁木齐 830052)
马疱疹病毒1型(Equine herpesvirs type 1,EHV-1)是马鼻肺炎(Equine rhinopneumonitis,ER)和马疱疹病毒性脑脊髓病(Equine herpesvirus myeloencephalopathy,EHM)的病原体之一,还可引起孕马流产和新生马驹死亡,严重制约着全球马产业的健康发展[1]。EHV-1属于疱疹病毒目(Herpesvirales),疱疹病毒科(Herpesviridae),α疱疹病毒亚科(Alphaherpesvirinae),水痘病毒属(Varicellovirus)。和其他α亚科的疱疹病毒一样,该病毒复制周期短,具有建立周围神经系统潜伏期的独特能力,这使得其具有很强的传染性,可直接或间接接触传播[2]。EHV-1通过病毒外层囊膜与宿主细胞质膜或内体膜融合而进入细胞[3]。其中囊膜糖蛋白在病毒的识别、吸附、侵入等过程中起着重要的作用。目前研究较深入的有gB、gC、gD、gH、gL糖蛋白,与病毒的致病力息息相关[4]。而关于gp2糖蛋白功能的研究较少,值得注意的是,该基因只存在于α疱疹病毒亚科、水痘病毒属的马疱疹病毒上。目前除EHV-1有部分报道外,未见其他马疱疹病毒关于gp2基因功能的研究报道。我国于2015年分离出1株马疱疹病毒流行毒株XJ2015株,对该毒株的进化分析表明,gp2基因为该病毒76个基因中保守性最低的基因[5]。该基因的特殊性决定了其在病毒致病过程中发挥着独特的作用,相关致病机制尚需进一步研究证明。
本试验以EHV-1 XJ2015株为研究对象,设计特异性引物扩增gp2基因完整开放阅读框基因进行测序,对基因序列进行遗传进化分析,对其所推导的氨基酸序列进行差异性分析,并对gp2蛋白进行蛋白质性质分析。以期为深入解析EHV-1gp2基因及其编码蛋白功能、制作新型疫苗和诊断试剂等提供生物信息学依据。
1 材料与方法
1.1 毒株、细胞及试剂 马疱疹病毒1型毒株于2015年分离自新疆伊犁地区,命名为XJ2015。RK-13细胞系由本实验室保存。2 × Primer STAR Max Mix,购自北京全式金生物技术有限公司;DL5 000 DNA Marker,购自TaKaRa宝日医生物技术(北京)有限公司;Viral DNA Kit和Gel Extraction Kit,均购自OMEGA广州飞扬生物工程有限公司。
1.2 引物设计 将EHV-1 XJ2015株接种于RK-13细胞,待病变率达到80%时收获病毒液。按照Viral DNA Kit说明书提取病毒基因组DNA,测定基因组的浓度及纯度,-20 ℃保存备用。参照本实验室已经获得的EHV-1 XJ2015株基因组序列,应用Primer 5.0软件设计1对特异性引物,gp2-F:5′-TCAAGTGCTGCAGAGTCGTC-3′,gp2-R:5′-GAAGTTGAGTGGGC-GTTGGG-3′。
1.3 目的基因的扩增与鉴定 PCR扩增采用50 μL反应体系:2×Primer STAR Max Mix 25 μL,上、下游引物(10 μmol/L)各2 μL,DNA模板1 μL,ddH2O 19 μL。扩增条件:94 ℃预变性5 min;94 ℃变性30 s,54.7 ℃退火30 s,72 ℃延伸30 s,35个循环;继续72 ℃延伸10 min,72 ℃加A尾30 min。PCR产物经1%琼脂糖凝胶电泳验证后使用Gel Extraction Kit纯化并与pMD19-T载体相连:目的片段4 μL,连接酶5 μL,载体0.5 μL,Nuclease-Free Water 0.5 μL,混合后于16 ℃金属浴连接3 h。将连接产物转化至大肠杆菌(E.coli)DH5α感受态细胞中,挑取白色克隆进行鉴定。以EHV-1基因组DNA作阳性对照,载体DNA作为阴性对照,对重组质粒进行PCR鉴定和酶切鉴定。鉴定成功后送至生工生物工程(上海)股份有限公司测序。
1.4 基因特征及系统进化分析 使用DNAMAN、DNASTAR软件对EHV-1 XJ2015gp2基因特征进行分析,使用Clustal W列进行数据比对分析,采用MEGA 7.0中的Neighbor joining法绘制系统进化树。
1.5 蛋白质分子特征分析 使用DNAMAN软件进行氨基酸序列相似性分析,DNASTAR软件进行蛋白质组分分析、疏水性分析、表面可及性分析、抗原指数分析,Signal P 5.0、TMHMM 2.0、Net-NES 1.1、NetSurfP-2.0、Phyre2 Server在线服务器对gp2蛋白进行蛋白质性质分析。
2 结果
2.1 基因的扩增与鉴定 采用gp2基因特异性引物进行PCR扩增,EHV-1 XJ2015株扩增出现3个条带,经测序鉴定,其中2个条带为非特异性扩增,中间为目的条带,其大小约为2 846 bp,与预期结果相符合。
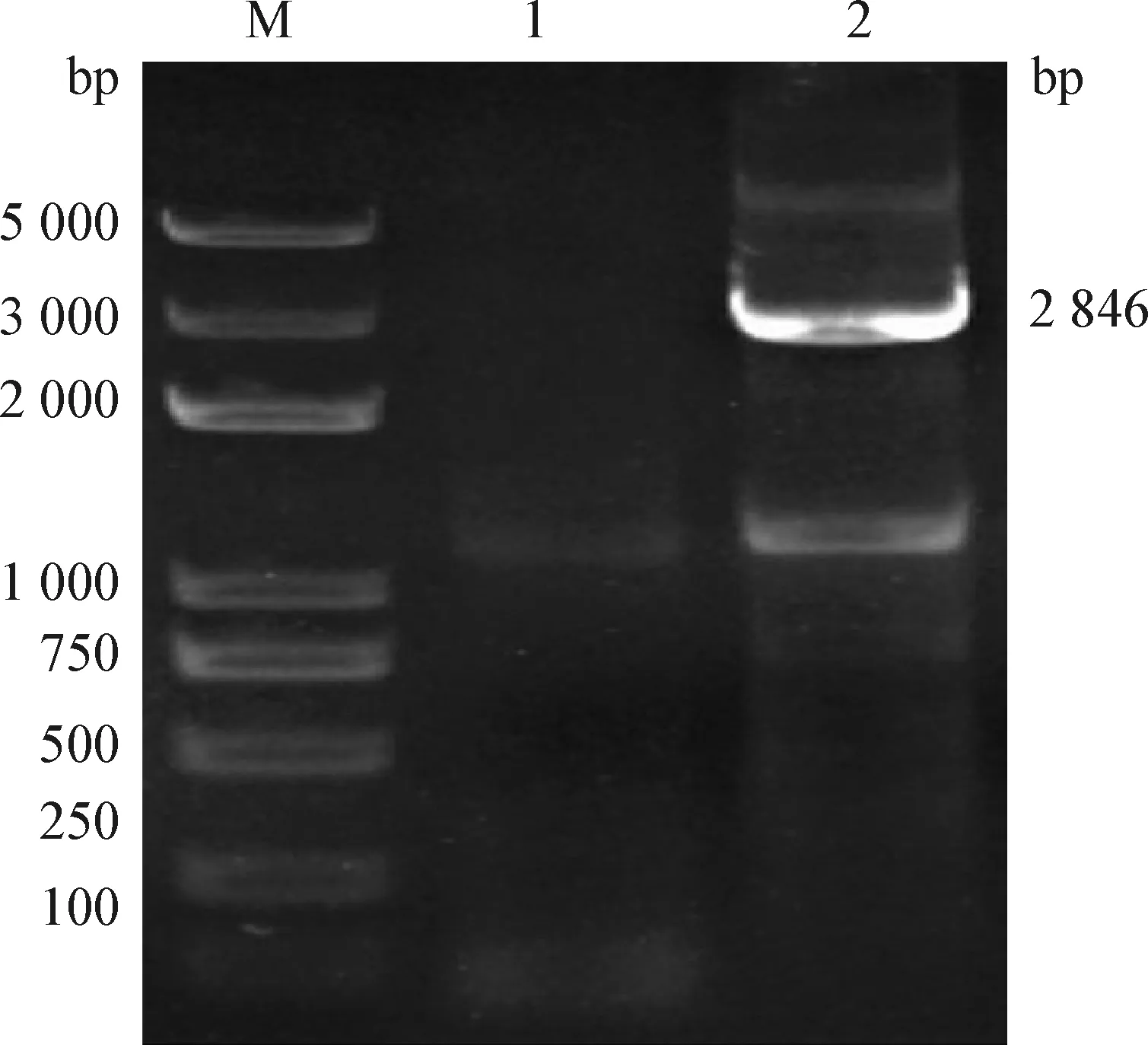
图1 马疱疹病毒1型gp2基因的PCR扩增
2.2 基因特征及系统进化分析 EHV-1 XJ2015株gp2基因核苷酸序列长度为2 454 bp,G+C含量占54.89%,A+T占45.11%,其中碱基A、G、T、C分别占26.49%、19.60%、18.62%和35.29%。gp2基因仅存在于α-疱疹病毒亚科中的马疱疹病毒中,其中,EHV-3单独为一分支,EHV-1、EHV-4、EHV-8、EHV-9被列为同一分支,但EHV-1与EHV-8、EHV-9亲缘关系较EHV-4近,此外,EHV-8 wh株与EHV-1毒株列为同一分支,在EHV-1与EHV-8之间可能发生基因重组(图2A)。
通过对NCBI上已有的30株EHV-1gp2基因分析,系统进化树共分为两大分支,其中3株为非马源性毒株,属于同一分支,并且这3株具有相似的突变位点,EHV-1 XJ2015株在另一分支中,该分支均是马体分离毒株(图2B)。经基因相似性分析表明,马体分离株EHV-1 5586株与其他分离株的相似性均较低,XJ2015株与5586株gp2基因相似性仅为64.3%,而与其他分离株gp2基因的相似性为92.5%~98.1%(图2C)。

图2 gp2基因的遗传进化分析
2.3 EHV-1 gp2蛋白分子特征分析 EHV-1 XJ2015株gp2蛋白氨基酸序列长度为817 aa,相对分子质量为82.095 51 kDa,理论等电点PI=5.417,碱性氨基酸(K、R)占4.16%;酸性氨基酸(D、E)占6.00%;疏水性氨基酸(A、I、L、F、W、V)占24.24%;亲水性氨基酸(N、C、Q、S、T、Y)占52.02%。通过对氨基酸序列分析表明,31株EHV-1 gp2蛋白氨基酸序列一致性为62.92%,除5586株以外,30株EHV-1毒株gp2蛋白氨基酸序列一致性为90.38%,总差异氨基酸数为178个(图3A)。此外,gp2蛋白存在部分氨基酸序列重复,在第186~225位点和第230~273位点,分别出现TAATT重复。在EHV-1 Ab4株gp2蛋白中,还存在SSATTAATT序列重复,但在EHV-1 XJ2015株中没有发现该序列重复(图3B)。

图3 gp2蛋白氨基酸序列差异性分析
2.4 基因特征及系统进化分析
2.4.1 蛋白质二级结构、亲水性、抗原指数和表面可及性分析 EHV-1 gp2蛋白二级结构预测结果显示:EHV-1 gp2蛋白富含无规卷曲,包含719个氨基酸,含量高达88%;其次β-折叠包含79个氨基酸,含量为9.7%;而α-螺旋仅包含19个氨基酸,含量为2.3%;未见β-转角。EHV-1 gp2蛋白亲水性较高区段在第25~85、319~367、377~404位和第407~567位氨基酸;抗原指数分析表明位于第25~130、144~152、281~374、378~500、508~564、665~686位和第744~784位氨基酸具有显著的抗原性;表面可及性区域位于第25~85、105~124、155~188位和第321~565位氨基酸。B细胞表位分析表明第25~130位和第273~565位氨基酸易形成潜在的抗原表位(图4)。

图4 gp2蛋白二级结构、亲水性、抗原指数和表面可及性分析
2.4.2 信号肽、α跨膜螺旋结构域及核外运信号分析 Signal P 5.0信号肽预测结果显示:EHV-1 gp2蛋白包括一种由Sec转运蛋白转运并被信号肽酶I(Lep)切割的“标准”分泌信号肽,切割位点在第21~22位氨基酸:AIG-ST,表明gp2蛋白为分泌蛋白。TMHMM 2.0 α跨膜螺旋结构域预测结果显示:EHV-1 gp2蛋白跨膜预测的期望值为22.844 87,高于阈值18,存在1个跨膜螺旋结构域,位于第787~809位氨基酸处,共包含23个氨基酸残基,结构简式为ALVAATTLTVTILCLLCCLYCML。Net-NES 1.1核外运信号预测结果显示:EHV-1 gp2蛋白包括1个核外运信号,位于第9~15位氨基酸,共包含7个氨基酸残基,结构简式为LLLCMAV。
2.4.3 蛋白质二级结构及三级结构预测 利用Phyre2 Server 在线服务器预测EHV-1 gp2蛋白的三级结构,采用同源建模法预测,预测模型置信度为91.5%,其中73%的序列没有同源结构,使用折叠识别法预测,而22%的序列含180个残基与免疫系统IgG-1链C端结构相似(图5)。

图5 gp2蛋白三级结构预测
3 讨论
病毒基因功能的解析是研究病毒致病机制的重要环节。目前,对疱疹病毒的基因功能的研究主要集中在人型疱疹病毒,而其他属疱疹病毒主要在于对同源基因进行功能验证[6]。在EHV-1中,研究较为深入的基因有UL16(gC)、UL33(gB)、US5(gD)、UL63(EICP0)、UL38(TK)等,这些基因在单纯疱疹病毒1型上均有对应的同系物[7]。gp2基因是马疱疹病毒的特有的基因,无法进行功能验证,想要掌握该基因的功能,生物信息学分析是必不可少的基本环节[8-9]。通过研究蛋白质的二级和三级结构,有助于了解蛋白质的作用和其如何行使其生物功能,并且更深层次地明确该蛋白与其他分子之间的相互作用。前期基础中对该蛋白功能进行预测,并设计相关功能确认的生物学试验,也为改造蛋白质提供可靠的依据[10]。此外,通过预测目的蛋白的信号肽序列,经切除信号肽序列后的前体蛋白才可能成为具有正常功能的成熟蛋白。对信号肽切割位点的预测,可为进一步进行表达研究的引物设计和表达载体的构建提供必要的信息[11]。
本试验发现,30株EHV-1病毒gp2基因相似性为92.5%~98.1%,仅5586毒株与其他分离株的相似性较低,这表明gp2基因属于EHV-1较保守的基因,而在之前的研究中,进行31株病毒序列比对时显示gp2基因是保守性最低的基因,是由5586毒株的差异性所致。此外,gp2蛋白存在部分氨基酸序列重复,且表现出毒株差异性,这些重复序列的差异及功能值得进一步研究。gp2蛋白预测包括1个信号肽、1个螺旋跨膜结构域和1个核外运信号,表明gp2蛋白是分泌型蛋白,这对于在不同的载体系统中表达重组蛋白发挥着重要的作用。二级、三级结构预测显示,该蛋白在无规则卷曲区的氨基酸占比为88%,且极性分子居多,亲水性氨基酸占52.02%,第25~133位和第273~587位氨基酸亲水性和抗原性较强,易形成潜在的抗原表位,表明该蛋白具有良好的抗原性。但是利用大肠杆菌 DH5α表达该蛋白时,表达量较低,这可能与gp2蛋白携带的信号肽有关。此外,Smith等证明EHV-1 RacL 11株在感染细胞的过程中,gp2全长的结构会被切割为2个亚基,在序列HRGRAGGR506R507G处2个相邻的精氨酸残基发生蛋白水解裂解,产生42 kDa的羧基末端和富含丝氨酸和苏氨酸的约200 kDa的氨基末端(高度O-糖基化)[12]。本试验对EHV-1 XJ2015株gp2基因序列进行分析,表明在序列HRGRAGGR526R527G处也存在蛋白裂解位点。因此,在构建原核表达载体时需将信号肽切割位点及蛋白裂解位点去除。
目前已经证明gp2基因产物对于病毒在组织培养中的生长是非必需的[13],但是发现该基因的缺失使得病毒在感染细胞中形成的噬斑大小和病毒滴度显著下降,需要进一步的研究来阐明该基因中重复序列的核苷酸数目以及重复序列的修饰在EHV-1的免疫逃逸和致病性中重要性[14-15]。尽管gp2基因缺失的突变病毒能从感染的BHK-21细胞中释放出来,但突变病毒无法在5%~15%的蔗糖密度梯度上进行条带化,这表明缺少gp2基因的EHV-1在蔗糖溶液中的浮密度会发生改变[16]。体内观察表明,突变病毒在感染小鼠的肺组织中增殖能力较差,并且毒性不如野生型病毒和其他的EHV-1 lacZ插入突变体[17]。Learmonth等研究表明,虽然EHV-1 gp2的C末端区域与EHV-4 gp2的氨基酸同源性为73%,但其抗原仅能检测到EHV-1诱导产生的抗体,而不能检测到EHV-4诱导产生的抗体,这为研发EHV-1特异性诊断测试提供基础[18]。
本试验为该基因的进一步研究提供理论指导,为新型疫苗和诊断试剂的研发奠定基础,今后将继续探索该基因在病毒致病机制中的作用以及gp2蛋白的分子作用模式,深入分析gp2基因的功能,为病毒致病机制的研究提供科学依据。

