α-倒捻子素对帕金森病小鼠的神经保护作用
庞洪波,何晓非,张译文,李琳琳
帕金森病是一种常见的慢性神经退行性疾病,以僵硬、震颤、运动迟缓、步态障碍等为主要临床特征。病理上,黑质致密部的多巴胺能神经元逐渐丧失,使纹状体中多巴胺含量缺乏和不足,是导致上述症状的主要原因。多巴胺替代疗法是治疗帕金森病的主要方法,但它不能阻止帕金森病的发生发展,并且会产生许多负面效应。因此,开发更有效的治疗药物对于帕金森病来说具有重要的临床价值。α-倒捻子素是山竹子果壳中的一种多酚类化合物,具有抗炎、抗氧化应激、抗肿瘤等多种生物学效应[1-3]。近年研究发现,α-倒捻子素可在神经系统疾病中发挥保护作用[4-5],如Zhao 等[6]发现α-倒捻子素可以抑制β-分泌酶和γ-分泌酶的活性,从而抑制β-淀粉样蛋白的生成,而且可以干预阿尔茨海默病的多种病理过程,有希望成为一种新型的神经保护剂。本研究通过腹腔注射1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)的方法构建帕金森病小鼠模型,以探讨α-倒捻子素对帕金森病是否也具有神经保护作用,期望为帕金森病的治疗提供新的选择。本研究的起止时间为2018年7月至2019年8月。
1 材料与方法
1.1 主要试剂与仪器MPTP 购于美国Sigma 公司;α-倒捻子素购于南京狄尔格医药科技有限公司;YLS-4C转棒仪购于济南益延科技发展有限公司;抗酪氨酸羟化酶(TH)抗体购于美国Santa Cruz 公司;抗B 细胞淋巴瘤-2(Bcl-2)抗体、抗Bcl-2 相关X 蛋白(Bax)抗体、抗活化胱天蛋白酶-9(cleaved-caspase-9)抗体、抗甘油醛-3-磷酸脱氢酶(GAPDH)抗体购于美国Abcam 公司;山羊血清封闭液、4′,6-二脒基-2-苯基吲哚(DAPI)购于北京中杉金桥生物技术有限公司;TUNEL 染色试剂盒、放射免疫沉淀法(RIPA)裂解液、BCA 蛋白定量试剂盒、电化学发光法(ECL)显色液购于上海碧云天生物技术有限公司。
1.2 实验分组与处理SPF 级雄性C57BL/6小鼠购于北京维通利华实验动物技术有限公司,生产许可证号SCXK(京)2019-000,使用许可证号SYXK(京)2017-0033),8周龄,体质量范围为18~22 g。饲养环境为室温23~25 ℃,标准湿度55%~60%,光照和黑夜各12 h,饮水饮食正常,分笼饲养,于1 周后实验。将40 只C57BL/6 小鼠按照随机数字表法分为四组,分别为对照组、模型组、α-倒捻子素给药组(低剂量组、高剂量组),每组10只。模型组与α-倒捻子素给药组进行帕金森病造模,即给予30 mg/kg 的MPTP腹腔注射,每日1 次,连续7 d;对照组则腹腔注射相同体积的生理盐水。α-倒捻子素给药组在MPTP 注射完毕后次日进行α-倒捻子素灌胃给药,剂量分别为5 mg·kg-1·d-1、15 mg·kg-1·d-1,每日1 次,连续14 d[7-9];对照组和模型组则给予相同体积的生理盐水灌胃。最后一次给药后14 d,进行小鼠的行为学观测。本研究符合一般动物实验伦理学原则。

图1 各组小鼠间黑质区TH表达的比较(免疫荧光染色×400)

图2 各组小鼠间黑质区细胞凋亡水平的比较(TUNEL染色×100)
1.3 行为学观测爬杆实验:将1 个直径2 cm 的塑料小球固定于爬杆顶部,在爬杆上缠绕医用纱布以防止小鼠滑落,然后将小鼠放置于球体上使其爬下,以其双前肢接触爬杆底部为止,记录其所需时间。每只小鼠测定3 次取均值。转棒实验:将小鼠放置于正在运转的转棒仪上,记录小鼠在转棒上的停留时间。每只小鼠测定3 次取均值。悬挂实验:在距地面30 cm 处水平悬挂1 根直径1 mm 的金属线,使小鼠的双前爪抓住金属线,小鼠若在10 s内能用2只后爪抓住金属线记3分,用1只后爪抓住金属线记2分,2只均未抓住记1分,掉落记0分。
1.4 纹状体多巴胺及其代谢产物含量的检测行为学观测结束后,将小鼠断头处死,在冰上迅速取出脑组织纹状体区,称重后放置于匀浆器中,加入1 mL 预冷的氯乙酸后匀浆。将匀浆液以8 000 r/min离心20 min,吸取上层液。使用高压液相电化学技术测定多巴胺、高香草酸、3,4-二羟基苯乙酸(DOPAC)的含量。
1.5 免疫荧光染色检测TH 表达小鼠断头处死后,同时在冰上迅速取出脑组织黑质区,放置于4%的多聚甲醛中固定48 h,蔗糖脱水后制作冰冻切片。山羊血清封闭液室温封闭30 min,加入抗TH抗体(1∶200)4 ℃过夜孵育。次日,磷酸缓冲盐溶液(PBS)洗涤3 次,加入二抗室温孵育1 h,PBS 洗涤3 次,滴加DAPI染核,封片,荧光显微镜下观察TH的表达。
1.6 TUNEL 染色检测细胞凋亡水平根据上述方法制备脑组织黑质区的冰冻切片,按照TUNEL 染色试剂盒说明书操作,荧光显微镜下观察和拍照。
1.7 蛋白质印迹法检测凋亡相关蛋白表达取脑组织黑质区,加入RIPA 裂解液提取总蛋白质,BCA法测定总蛋白含量。取30 μg 总蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)和电转印,5%的牛血清白蛋白室温封闭2 h,加入抗Bax 抗体(1∶1 000)、抗Bcl-2 抗体(1∶1 000)、抗cleavedcaspase-9 抗 体(1∶1 000)、抗GAPDH 抗 体(1∶3 000),4 ℃过夜孵育。次日,洗膜后加入二抗室温孵育1 h,洗膜后滴加ECL 显色液,使用凝胶成像仪曝光和拍照。使用Image J软件测定各条带灰度值,将对照组的目的蛋白与GAPDH灰度值之比作为1.0。
1.8 统计学方法使用SPSS 20.0 软件进行统计。所有计量数据均符合正态分布,以± s 表示,多组间计量数据的比较使用单因素方差分析,多组间的两两比较使用LSD-t检验。检验水准α=0.05。
2 结果
2.1 各组小鼠间行为学的比较与对照组比较,模型组小鼠的爬杆时间升高,转棒停留时间和悬挂实验得分均降低(P<0.05)。与模型组比较,低剂量组和高剂量组小鼠的爬杆时间降低,转棒停留时间和悬挂实验得分均升高(P<0.05)。高剂量组的上述指标均优于低剂量组。见表1。
2.2 各组小鼠间纹状体多巴胺及其代谢产物含量的比较与对照组比较,模型组小鼠的纹状体多巴胺、高香草酸、DOPAC 含量降低(P<0.05)。与模型组比较,低剂量组和高剂量组小鼠的纹状体多巴胺、高香草酸、DOPAC 含量升高,且高剂量组的纹状体多巴胺、高香草酸、DOPAC 含量高于低剂量组(P<0.05)。见表2。
表1 各组小鼠间行为学的比较/± s
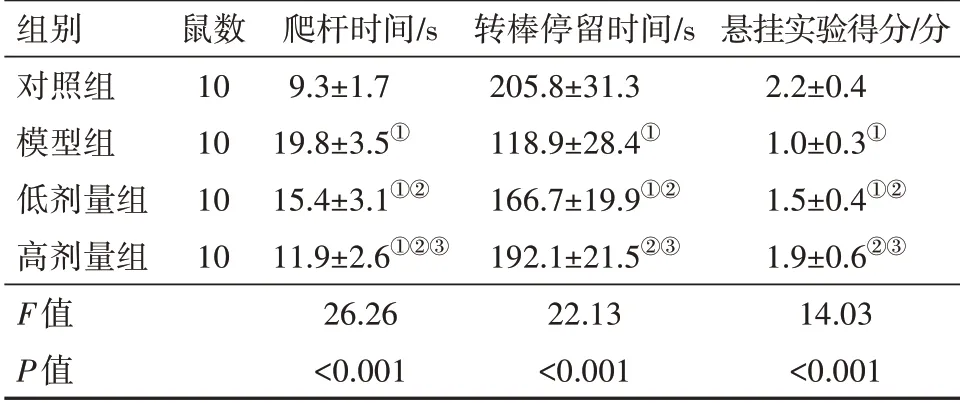
表1 各组小鼠间行为学的比较/± s
注:①与对照组比较,P<0.05。②与模型组比较,P<0.05。③与低剂量组比较,P<0.05。
组别对照组模型组低剂量组高剂量组F值P值鼠数10 10 10 10爬杆时间/s 9.3±1.7 19.8±3.5①15.4±3.1①②11.9±2.6①②③26.26<0.001转棒停留时间/s 205.8±31.3 118.9±28.4①166.7±19.9①②192.1±21.5②③22.13<0.001悬挂实验得分/分2.2±0.4 1.0±0.3①1.5±0.4①②1.9±0.6②③14.03<0.001
表2 各组小鼠间纹状体多巴胺及其代谢产物含量的比较/(ng/g,± s)

表2 各组小鼠间纹状体多巴胺及其代谢产物含量的比较/(ng/g,± s)
注:DOPAC为3,4-二羟基苯乙酸。①与对照组比较,P<0.05。②与模型组比较,P<0.05。③与低剂量组比较,P<0.05
组别对照组模型组低剂量组高剂量组F值P值鼠数10 10 10 10多巴胺2 051.4±195.2 911.3±88.5①1 388.6±159.9①②1 728.2±180.6①②③91.37<0.001高香草酸1 677.3±128.0 1 190.5±83.3①1 366.7±109.2①②1 510.8±112.4①②③35.89<0.001 DOPAC 395.8±41.1 187.9±20.3①266.5±33.7①②320.3±40.4①②③63.15<0.001
2.3 各组小鼠间黑质区TH 表达的比较对照组、模型组、低剂量组、高剂量组小鼠黑质区TH 表达水平 分 别 为(46.27±5.46)%、(8.85±3.15)%、(21.54±4.11)%、(35.29±4.63)%(F=20.77,P<0.001)。与对照组比较,模型组小鼠黑质区TH 表达降低(P<0.05);与模型组比较,低剂量组和高剂量组小鼠黑质区TH 表达升高,且高剂量组的TH 表达量高于低剂量组(P<0.05)。见图1。
2.4 各组小鼠间黑质区细胞凋亡水平的比较对照组、模型组、低剂量组、高剂量组小鼠黑质区TH表达水平分别为(3.23±1.24)%、(34.18±5.15)%、(14.34±3.41)%、(6.42±1.62)%(F=14.03,P<0.001)。与对照组比较,模型组小鼠黑质区细胞凋亡水平升高(P<0.05)。与模型组比较,低剂量组和高剂量组小鼠黑质区细胞凋亡水平降低,且高剂量组的细胞凋亡水平低于低剂量组(P<0.05)。见图2。
2.5 各组小鼠间黑质区凋亡相关蛋白表达的比较与对照组比较,模型组小鼠黑质区Bax 和cleaved-caspase-9表达量升高,Bcl-2表达量降低(P<0.05)。与模型组比较,低剂量组和高剂量组小鼠黑质 区Bax 和cleaved-caspase-9 表 达 量 降 低,Bcl-2 表达量升高(P<0.05)。高剂量组的上述指标均优于低剂量组。见图3,表3。
3 讨论

图3 蛋白质印迹法检测黑质区凋亡相关蛋白的表达
表3 各组小鼠间黑质区凋亡相关蛋白表达的比较/± s

表3 各组小鼠间黑质区凋亡相关蛋白表达的比较/± s
注:Bcl-2 为B 细胞淋巴瘤-2,Bax 为Bcl-2 相关X 蛋白,cleavedcaspase-9为活化胱天蛋白酶-9。①与对照组比较,P<0.05。②与模型组比较,P<0.05。③与低剂量组比较,P<0.05。
组别对照组模型组低剂量组高剂量组F值P值鼠数10 10 10 10 Bcl-2 1.00±0.17 0.23±0.11①0.44±0.19①②0.94±0.22②③45.37<0.001 Bax 1.00±0.14 3.15±0.42①2.06±0.38①②1.18±0.20②③101.80<0.001 cleaved-caspase-9 1.00±0.15 4.27±0.52①2.29±0.43①②1.30±0.28②③156.80<0.001
天然植物提取物因具有安全性高、提取成本低、生物学活性高等优势,在医药开发领域逐渐占据重要地位,也是治疗帕金森病潜在的宝贵资源。α-倒捻子素是一种多酚黄酮类物质,来源于山竹子的果皮、树皮和干汁,而山竹子在一些热带国家中常被经验性地用于腹痛、腹泻、痢疾、感染性伤口、慢性溃疡等疾病[10-11]。近年研究发现,α-倒捻子素具有广泛的生物学效应,如α-倒捻子素是一种强有效的活性氧清除剂,可减少线粒体毒素3-硝基丙酸引起的神经元死亡[12-13]。
MPTP 及其代谢产物通过抑制线粒体复合物Ⅰ的活性诱导多巴胺神经元凋亡,从而产生类帕金森病样症状和病理特征,连续腹腔注射5~7 d 是制备帕金森病小鼠模型的经典方法[14-15]。行为学观测发现,与对照组比较,模型组小鼠的爬杆时间升高,转棒停留时间和悬挂实验得分均降低,表明造模小鼠的运动协调能力明显减弱,证实动物模型已成功构建。此外,给予α-倒捻子素可以明显改善造模小鼠的行为学指标,而且高剂量组优于低剂量组,表明α-倒捻子素对帕金森病确实具有治疗效应。
为了进一步证实上述行为学的结论,本研究检测了α-倒捻子素对帕金森病典型病理特征的影响。TH是多巴胺神经元的特征性标志物,可以反映其数量变化[16],本研究对黑质区神经元进行了TH 的免疫荧光染色,结果显示α-倒捻子素可以显著抑制MPTP 导致的TH 表达降低,表明α-倒捻子素对多巴胺神经元具有保护作用。此外,α-倒捻子素给药组小鼠纹状体中多巴胺及其代谢产物的含量高于模型组,该结果也进一步证实了α-倒捻子素的神经保护作用。细胞凋亡是导致帕金森病中多巴胺神经元数量降低的主要机制[17-18],TUNEL 染色和蛋白质印迹法结果显示α-倒捻子素可以抑制神经凋亡,下调促凋亡蛋白Bax 和cleaved-caspase-9 表达,上调抗凋亡蛋白Bcl-2 表达。上述神经保护效应的机制可能要归功于α-倒捻子素强有力的抗氧化、抗炎作用,如谢瑞等人在癫痫小鼠模型中发现,α-倒捻子素可降低海马组织中炎性因子的含量,活化核因子E2相关因子2/血红素加氧酶-1(NRF2/HO-1)信号通路[7]。但是,本研究未对该方面进行研究,未来需要进一步检测黑质区氧化应激及炎症相关因子的含量,以深入探讨α-倒捻子素的神经保护机制。
本研究的不足与展望:(1)内质网应激、线粒体功能障碍、自噬、蛋白酶体功能障碍等过程与帕金森病的发生发展密切相关,α-倒捻子素对这些病理过程的影响尚不清楚,未来仍需要进一步完善相关指标的检测;(2)α-倒捻子素溶解性差,通过口服进入循环系统的效率较低,而且血脑屏障的阻碍作用较强[19-20],如何促进α-倒捻子素吸收和递送是个关键问题,未来可以尝试构建纳米载药系统以及靶向肽修饰等方法解决[21]。
综上所述,α-倒捻子素可以改善MPTP 诱导帕金森病小鼠模型的行为学,上调多巴胺及其代谢产物的含量,促进TH表达,抑制细胞凋亡水平。
(本文图1,2见插图9-1)

