襄阳市主要花生种植区土壤中黄曲霉菌分布及产毒力研究
张姝娟,王雪,褚乾梅,张奇,张倩,董菁,王盾*,冯鹏*
(1.襄阳市农业科学院,湖北 襄阳,441057;2.中国农业科学院油料作物研究所,湖北 武汉,430062;3.农业农村部生物毒素检测重点实验室,湖北 武汉,430062;4.农业农村部油料产品质量安全风险评估实验室(武汉),湖北 武汉,430062)
花生营养价值高,约含50%的脂肪、25%的蛋白质和16%的碳水化合物,是蛋白质和热量的优质来源,还含有人体必需的氨基酸[1],根据花生品种的特性可以鲜食、熟食和榨油,属于襄阳地区主要的经济作物之一。然而花生在种植、收获、储藏和加工过程中极易受黄曲霉毒素污染,国内及国际对我国花生及其制品黄曲霉毒素超标现象时有报道。
黄曲霉毒素主要是由黄曲霉(Aspergillus flavus)、寄生曲霉(A.parasiticus)、集峰曲霉(A.nomius)等曲霉属真菌产生的次级代谢产物[2],具有剧毒性、致突变性、强致癌性,主要作用于人和动物的肝脏组织,长期暴露在黄曲霉毒素中能够诱导原发性肝癌;近年来一些研究表明黄曲霉毒素也会引起胰腺、肾脏、膀胱等器官癌变,还可能导致营养代谢不良、免疫抑制等病变[3,4]。黄曲霉菌的产毒能力由于菌株的不同而存在差异,根据各类研究目前已发现超过20种不同的黄曲霉毒素,天然产生的黄曲霉毒素类型主要有AFB1、AFB2、AFG1、AFG2等4 种[5],黄曲霉毒素B1被认为是目前毒性最大、致癌力最强的真菌毒素,1993年被世界卫生组织(WHO)的国际癌症研究机构(IARC)划定为Ⅰ类致癌物[6]。
花生具有地上开花、地下结果特性,花生生长期间,其荚果直接与土壤接触,有研究证实土壤是花生黄曲霉菌的主要来源,花生中的黄曲霉与土壤中黄曲霉有直接的联系[7]。因此,开展黄曲霉菌分布、产毒力及黄曲霉毒素污染研究,可为有效预防和控制产后花生黄曲霉毒素污染提供重要的理论依据。
目前,在已有的关于土壤中黄曲霉菌分布及产毒特征方面的研究中,Khan 等[8]认为土壤是农作物被黄曲霉毒素侵染的主要来源;Tran-Dinh 等[9]在针对越南土壤中黄曲霉菌的研究显示,土壤样品中分离出的黄曲霉菌均来自于农垦土地,且主要产生B族黄曲霉毒素;张初曙[10]对我国东南沿海、长江流域、黄河流域和东北地区共四个生态区同时也是国内主要花生产区的研究和张杏[11]全国11 个花生种植地的分析均表明长江流域土壤中黄曲霉菌分布最多,污染风险最大。襄阳,位于长江中游,地处南北交界区域,光照足、积温多、降水均匀,独特的地理环境及气候适合花生的规模化种植,是长江流域主要的花生产区和集散地,随着花生种植面积的逐年增长,现已形成枣阳、襄州、宜城、谷城等规模化产区,总种植面积接近6.67 万公顷,单产4500 kg/hm2左右,高于全省平均水平,是湖北省第一大花生生产区和集散地。然而,现有的针对我国花生黄曲霉菌研究报道中,襄阳虽多次被列入调查对象[10~12],但其调查范围和取样数量有限,代表性不足,不能较全面地反映襄阳花生产区的特征,要摸清襄阳地区花生种植区域土壤黄曲霉菌的分布情况,还需更详细的调查研究。因此,本文立足于襄阳地区气候特点,挑选典型种植区域,对花生土壤进行采样和黄曲霉菌分离鉴定、产毒力测定,分析襄阳四个代表性花生产区黄曲霉菌分布和产毒特征,并与南北方调查数据进行比对,可为襄阳市花生黄曲霉毒素污染预警和防控提供理论依据。
1 材料与方法
1.1 材料
1.1.1 培养基与试剂 培养基:DG-18 琼脂培养基,AFPA(曲霉琼脂)培养基,液体沙氏培养基,均购自青岛高科技工业园海博生物技术有限公司。
标准品:黄曲霉毒素B1、B2、G1、G2标准品购自北京坛墨质检科技有限公司。
试剂:色谱级甲醇(美国Fisher公司),吐温80。
1.1.2 仪器 电子分析天平,电子显微镜,锥形瓶、试管、烧杯,纯水机(优普UPH-III),恒温摇床,霉菌培养箱,液相色谱仪(岛津LC-20AT)。
1.2 方法
1.2.1 土壤样品采集与处理 选取襄阳市辖区内四个花生主要产区(襄州、枣阳、宜城、谷城)所辖乡镇作为采样点,根据襄阳市花生种植实际分布情况在4 个主产区选取共计13 个乡镇作为采样点,在每个采样点的花生田地采用五点取样法取样,5 个子样混成一个样品,每个采样点至少采集样品3份,共采集收获期花生土壤样品36 份。其中襄州区14份,枣阳9份,宜城7份,谷城6份。采样方法参考朱婷婷等[12],样品低温运回实验室后放于4°C 冰箱内保存备用。土壤样品研磨后直接用于黄曲霉菌分离纯化。
1.2.2 黄曲霉菌的分离与纯化 称取磨碎后的10.0 g 土壤样品加入90 mL 灭菌水中,用恒温摇床充分混匀5 min,制成样品基础液,样品基础液稀释度为10-1。取1 mL 样品基础液加入9 mL 无菌水中,制备出10-2稀释度的土壤菌悬浮液,再取25 µL 该土壤菌悬浮液加在倒有DG-18 培养基的平板上,用涂布棒涂布均匀,每份样品设2 个生物学重复。将接种好样品的平板置于恒温培养箱中,28±1℃黑暗培养5 d。5 d 后,从DG-18 培养基上挑取长有黄绿色孢子的菌落,接种到已倒好AFPA 培养基的平板上,于28±1℃条件下纯化培养3~5d,直至长出单个菌落,将AFPA 培养基背面呈亮橘色的菌株初步鉴定为黄曲霉菌,然后从AFPA 培养基上挑取少许亮橘色菌丝于DG18 培养基上,28℃黑暗培养5 d 直至得到黄绿色孢子,将菌株孢子用0.1%的吐温80 水溶液冲洗下来,作为菌种存于-18℃冰柜中备用。
1.2.3 黄曲霉菌鉴定 挑取单个菌落的菌株于AFPA培养基上,28℃培养3 d后进行观察,然后挑选AFPA 培养基背面为橘黄色透明的菌株,寄北京擎科测序公司(武汉)进行ITS鉴定。
根据北京擎科测序公司(武汉)提供的测序结果报告所述,送检的样品经粗提出基因组DNA 后,选择相应引物扩增特异片段并测序比对。PCR 扩增采用通用引物ITS1 和ITS4 扩增菌株ITS 序列,其中ITS1 序列为TCCGTAGGT-GAACCTGCGG,ITS4序列为TCCTCCCGCTTATT-GATATGC。
1.2.4 黄曲霉菌产毒培养 将保存的黄曲霉菌接种于DG18 培养基28℃培养5 d 后,用含0.1%的吐温80无菌水将孢子从培养基上冲洗下来,制备黄曲霉菌分生孢子悬浮液备用。将制备好的黄曲霉分生孢子液置于电子显微镜下用血球计数板计数,然后吸取一定量的孢子悬浮液加入装有30 mL沙氏液体培养基的锥形瓶中,使其最终浓度1.0×105个/mL。在28℃、200 r/min恒温摇床培养7 d。
用灭菌纱布过滤产毒培养液于15 mL离心管中备用。取1 mL 产毒培养液再加4 mL 纯水定量至5 mL,通过免疫亲和柱,控制流速为2~3 mL/min,用10mL 水分2 次洗脱,洗脱完后将洗脱液弃去,用洗耳球将水吹尽,再加1 mL纯甲醇洗脱,收集洗脱液,待液相上机。
1.2.5 产毒培养液中黄曲霉毒素的测定 将购买的黄曲霉毒素B1、B2、G1、G2混合标准溶液用甲醇稀释制备成浓度分别为5、10、50、100、200、500µg/L共6个梯度的混合标准溶液。
采用高效液相色谱串联柱后光化学衍生法测定黄曲霉菌株产毒能力。
色谱条件:色谱柱为C18(5 µm,4.6 mm×150 mm);柱温为35℃;流动相为甲醇:水(V:V=45:55);流速为0.9 mL/min;
检测条件:光化学衍生器254nm;以荧光检测器检测,激发波长360 nm,发射波长440 nm,进样量10µL。
1.2.6 计算方法 计算公式参考张杏等[11]文献中的计算方法。
每克土壤中黄曲霉的菌落数(cfu/g)=平板的菌落数/0.025/稀释倍数 (1)
每克土壤产生黄曲霉毒素(AFT)的量=每克土壤中黄曲霉菌落数×黄曲霉菌平均产AFT的量(2)
本文中计算每克土壤产生的黄曲霉毒素的量时所用的黄曲霉菌平均产AFT 的量是按照文中1.2.4 所述方法培养黄曲霉菌株后测得的培养液中毒素含量。计算公式(1)中0.025 为平板培养时加稀释液体积。
2 结果与分析
2.1 黄曲霉菌的分离与鉴定
采用稀释涂布方法,对采自襄州、枣阳、宜城、谷城共36 份土壤样品中的黄曲霉菌进行分离、纯化,根据AFPA 培养基呈现亮橘色这一表征,初步筛选得到116株可产生黄绿色孢子的菌株。
2.2 黄曲霉的分子生物学鉴定
将AFPA 培养基背面为橘黄色透明的菌株培养单菌落平板后寄往第三方检测机构(北京擎科测序公司(武汉)),用ITS 通用引物测序进行分子生物学鉴定,得到黄曲霉菌株99株,与数据库中黄曲霉ITS序列相似性达到99%~100%(图1)。

图1 PCR扩增鉴定胶图Fig.1 PCR electrophoretic results
2.3 襄阳市典型花生种植区土壤中黄曲霉菌分布
襄阳4 个花生代表产区共取样36 份,检出阳性样品31 份,分离黄曲霉菌株共99 株,花生土壤中黄曲霉菌整体检出率高达86.1%,说明襄阳花生种植区土壤中黄曲霉菌分布广泛(图2)。全市花生主产区的平均黄曲霉菌落数为5997.6 cfu/g,不同的花生种植区土壤中黄曲霉菌落数存在显著差异,由表1可看出,襄州区花生土壤中黄曲霉菌落数最高,其范围为0~24 000 cfu/g,平均值为9508 cfu/g;其次为枣阳,土壤中黄曲霉菌落数范围为0~20 000 cfu/g,平均值5289 cfu/g;再次是宜城,菌落数范围为400~16 000 cfu/g,平均值为3886 cfu/g;最低的是谷城,菌落数范围为400~6400 cfu/g,平均值为1333 cfu/g。
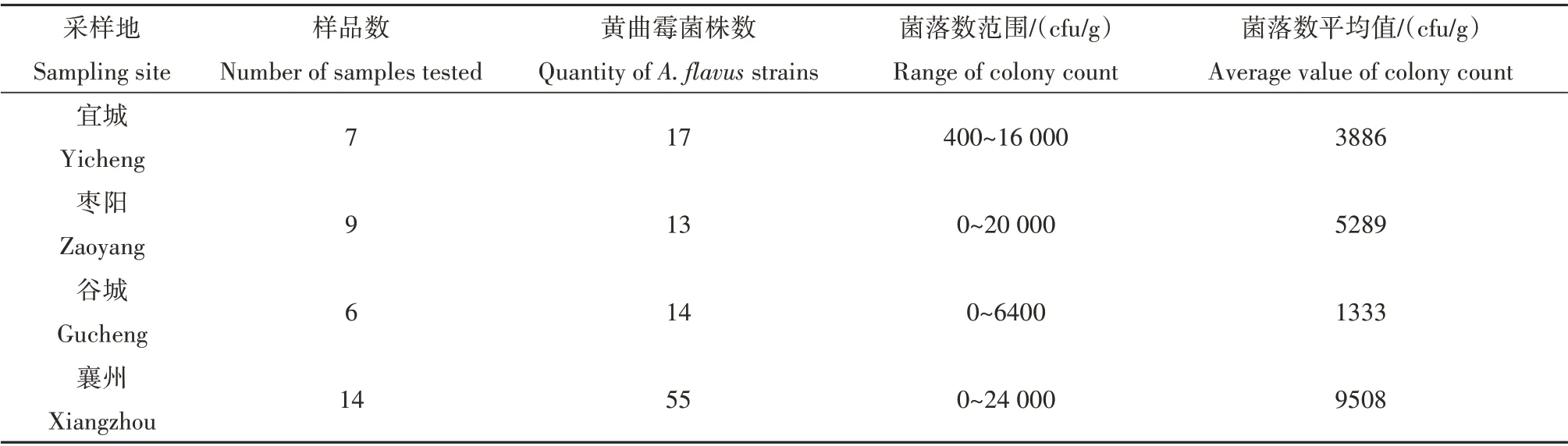
表1 襄阳主要花生产区土壤中黄曲霉菌的分布Table 1 Distribution of Aspergillus flavus in peanuts planting areas in Xiangyang

图2 襄阳代表性花生产区土壤取样点分布示意图Fig.2 Distribution of sampling areas and quantities of soils in Xiangyang
2.4 黄曲霉毒素标准曲线
在所选用色谱条件下,黄曲霉毒素得到良好的基线分离,4 种毒素在20 min 内出峰,先后顺序为AFG2、AFG1、AFB2、AFB1,图3 为黄曲霉毒素标准品色谱图。以黄曲霉毒素的色谱峰面积(Y)为纵坐标,质量浓度(X,µg/L)为横坐标,绘制AFG2、AFG1、AFB2、AFB1标准曲线,得到线性回归方程(表2),R2均大于0.999,说明线性关系良好。
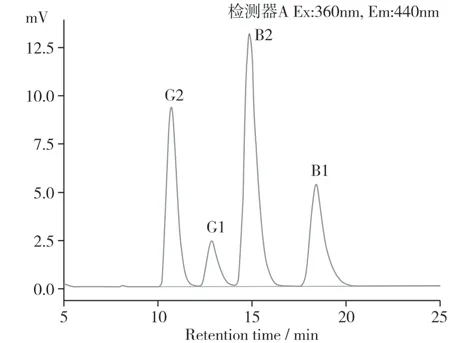
图3 黄曲霉毒素混合标准品色谱图(标准品浓度均为10 μg/L)Fig.3 HPLC chromatogram of aflatoxin standard sample(sample concentration is 10μg/L)
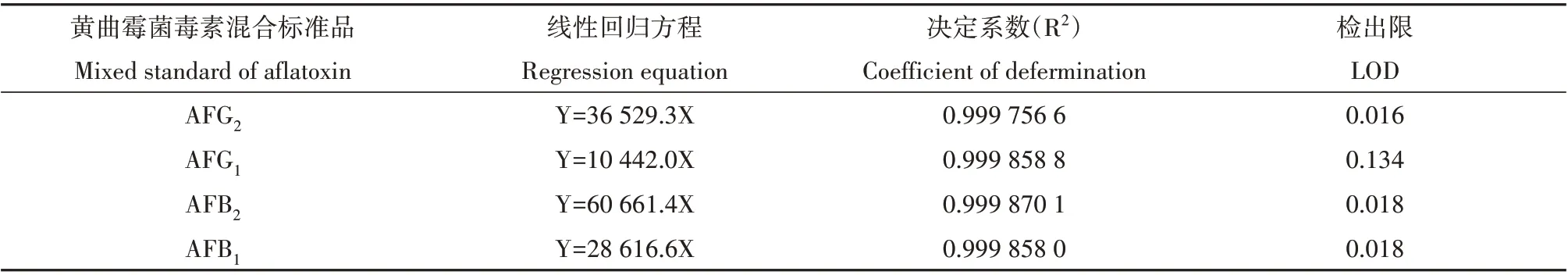
表2 黄曲霉毒素混合标准品线性回归方程Table 2 Linear regression equation of aflatoxin standard sample
2.5 襄阳花生种植区土壤中黄曲霉菌产毒特征
对分离鉴定的99 株黄曲霉菌进行产毒特征分析,结果发现,能产生黄曲霉毒素的菌株所占的比例为63.6%,不产毒菌占36.4%。再对能产生黄曲霉毒素的菌株细分,根据菌株产毒种类可分为7 种类型(图4):只产AFB1的黄曲霉菌和只产AFG2的黄曲霉菌,占比分别为12.7%和1.6%;产生AFB1和AFB2两种类型的黄曲霉菌,和AFB2和AFG2两种类型的黄曲霉菌,分别占比22.2%和4.8%;产AFB1、AFB2和AFG2三种类型的黄曲霉菌、产AFB1、AFB2和AFG1三种类型的黄曲霉,占比分别为54.0%和1.1%;同时产AFB1、AFB2、AFG1和AFG2四种类型黄曲霉菌,占比1.6%。各个种植区的土壤黄曲霉菌株均以产生AFB1、AFB2和AFG2三种类型的毒素为主。
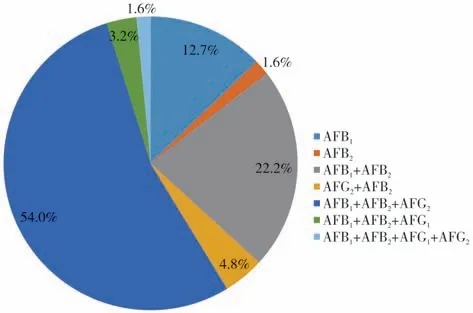
图4 襄阳主要花生产区土壤中黄曲霉菌产毒类型分布Fig.4 Distribution of aflatoxin-producing types of A.flavus in soils of typical peanuts planting areas in Xiangyang
根据菌株毒素含量AFT(B1、B2、G1、G2四种类型毒素量总和),同时参考其它相关文献[10,11]的划分情况,将其产毒能力划分为4个水平,并根据菌株产毒量分别命名为高产毒菌(>1000 µg/L)、中产毒菌(100~1000 µg/L)、低产毒菌(0~100 µg/L)和不产毒菌(ND)。从图5 中可以看出,襄阳市的花生种植区中分离出的黄曲霉菌株均以产AFT 量0~100 µg/L范围的菌株(低产毒菌株)所占的比例最高,为38.4%,其次为不产毒菌株,占全部菌株比例为36.4%,高产毒菌占比最低,仅有5.1%。此结论与杨博磊[13]、张杏[11]等调查研究趋势相同,说明襄阳花生主产区同长江流域其它产区一样,土壤黄曲霉菌均以低产毒菌和不产毒菌为主。

图5 襄阳主要花生产区土壤中黄曲霉菌产毒力分布Fig.5 Distribution of aflatoxin production by A.flavus in soils of main peanuts fields in Xiangyang
从表3 和图6 中可以看出,所鉴定的样品中宜城产区的不产毒菌占比为64.7%,明显高于其它产区;低产毒菌在谷城和襄州产区占比均为最高的,分别为50.0%和41.8%;而枣阳产区分离出的黄曲霉菌株中中产毒菌占多数,为53.8%;枣阳和谷城产区未检测到高产毒菌株,考虑到枣阳和谷城产区分离出的黄曲霉菌株较少,因此不能直接断定这两个产区没有高产毒菌株的存在。
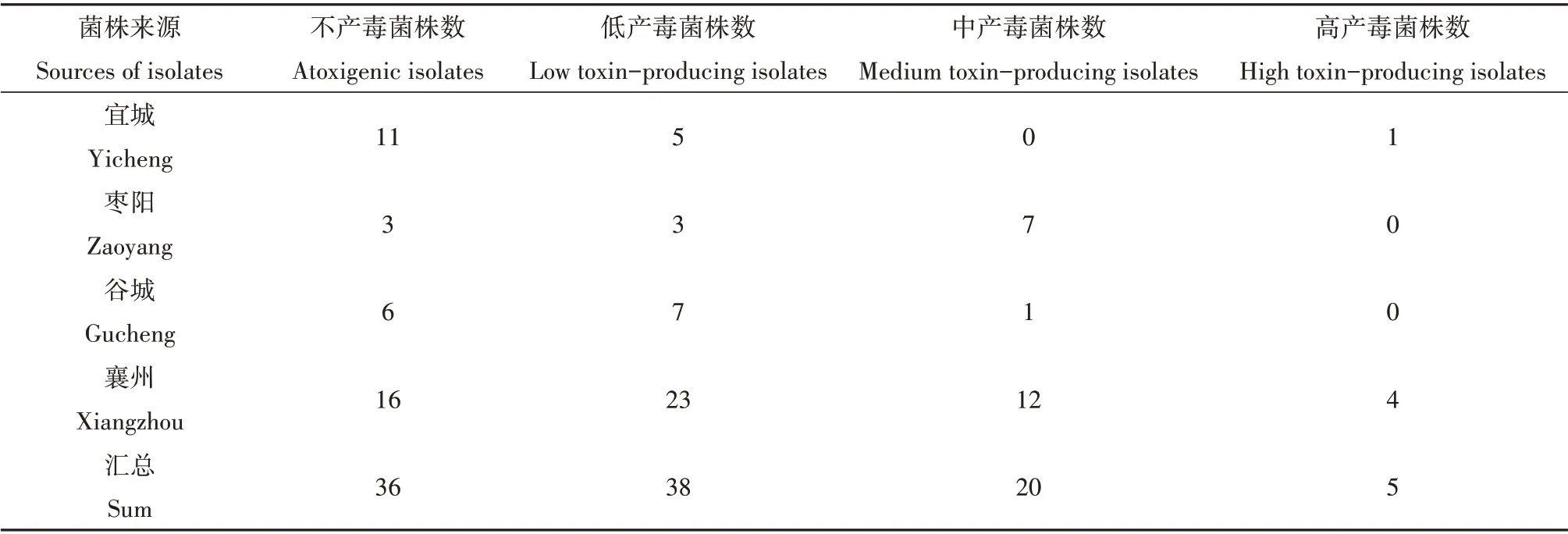
表3 襄阳主要花生产区土壤黄曲霉菌产毒力分布Table 3 Distribution of aflatoxin production by A.flavus in soils of main peanuts fields in Xiangyang
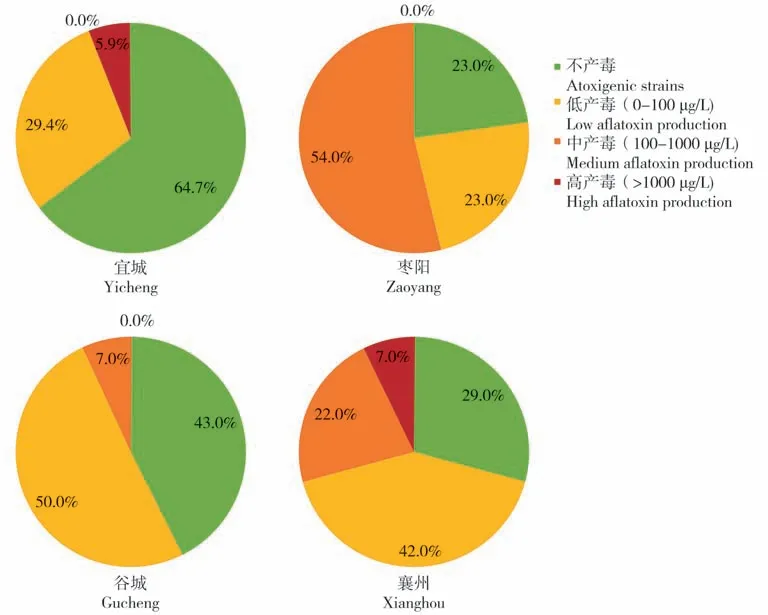
图6 四个花生产区土壤中黄曲霉产毒力分布图Fig.6 Distribution of aflatoxin production by A.flavus in soils of 4 peanuts fields in Xiangyang
经过进一步分析发现,襄阳地区的花生土壤中黄曲霉菌株产毒以B 族毒素为主,尤其是AFB1,平均产毒量是AFB1>AFB2>AFG2>AFG1。对土壤中菌株产黄曲霉毒素AFT 含量比较分析发现,最高的为襄州,菌株平均产生黄曲霉毒素AFT 的量为218.7 µg/L,其次为宜城(173.2 µg/L),再次为枣阳(140.5µg/L),最低为谷城(16.1µg/L);每克土壤中黄曲霉菌产AFT 的量也是襄州产区最高,为2080.0×103µg/L,其次为枣阳,每克土壤中黄曲霉菌产AFT 的量为742.89×103µg/L,最低的为谷城,每克土壤中黄曲霉菌产AFT 的量为20.4×103µg/L。
3 讨论与结论
黄曲霉菌广泛分布在纬度26~35℃的温暖地带,适宜生长温度范围为25~42℃,适宜水分活度(water activity,aw)为0.86~0.96,最适产毒温度为28℃[14]。研究表明,环境温湿度对黄曲霉菌的生长有明显影响作用,高温和潮湿的环境能促进黄曲霉菌的生长。襄阳地处汉江流域,水系丰沛,在花生生育期正处于夏季,具备典型的高温和潮湿的环境,因此研究本地土壤中的黄曲霉菌分布及黄曲霉毒素污染状况对花生生产具有重要意义。
通过本研究调查分析结果可以看出,在襄州的花生种植区土壤样品中分离鉴定出的黄曲霉菌落数平均值为9508 cfu/g,远高于其它几个花生种植区,对比张初曙[10]2013 年的研究中展现的襄州(菌落数范围0~16665 cfu/g,平均值为2749.3 cfu/g)和宜城(菌落数范围0~1000 cfu/g,平均值297.5 cfu/g)的数据来看,也是襄州的黄曲霉菌落数远高于宜城(表1)。与其它相关文献中的数据对比可以发现,襄阳市主要花生种植区的黄曲霉菌落数整体平均水平为5997.6 cfu/g,远高于张初曙[10]、张杏[11]、朱婷婷[15]等论文中所选取的襄阳花生种植区的土壤黄曲霉菌落数,原因可能是这些调查中所选取的取样点范围以及取样数量不同。张初曙[10]在调查中是将襄州和宜城设置为长江流域代表采样地,在这两个采样地方圆一公里内进行多点采样;朱婷婷选择襄阳产区十个村进行取样调查;而近五年来襄阳的花生种植面积增加了50%以上,本次调查研究取样的范围覆盖襄州产区和宜城产区共计7 个村镇采样地,全面覆盖了襄州和宜城主要的花生种植地域,同时还增加了之前调查中未涉及的谷城和枣阳等花生种植区域,取样点涵盖了襄阳地区四个县市区共计13 个村镇的种植基地,可以较全面的展现出襄阳本地黄曲霉菌的分布特点。
张初曙的调查[10]覆盖了东北地区(河北、辽宁、山东等)、黄河流域(山东省)、长江流域(湖北省)、东南沿海(广东省)几个产区,其中辽宁沈阳、山东青岛、湖北黄冈、广东湛江土壤中黄曲霉菌落范围分别为0~33.3 cfu/g、0~300 cfu/g、33.3~6660 cfu/g、0~1666.7 cfu/g;张杏等[16]调查西南主产省(四川蓬安、云南广南、西藏察隅等)花生土壤中黄曲霉菌落数,得到菌落数平均范围分别为100~223 cfu/g;在朱婷婷论文[15]中展示黑龙江齐齐哈尔、河南开封、江苏连云港、安徽合肥、广东湛江等地土壤中黄曲霉菌落数平均值分别为10 cfu/g、160 cfu/g、170 cfu/g、240 cfu/g、50 cfu/g;杨博磊等[13]调查了四川南充、河北保定等地的花生土壤黄曲霉菌落数据分别为194 cfu/g、25 cfu/g;刘付香等[17]在对广东省广州市等10 个地市花生田黄曲霉数量的调查中得到其平均菌落数范围在20~160 cfu/g。综合以上数据可以看出,襄阳市花生主产区的黄曲霉菌落数平均值相较于其它产区都要显著偏高,分析原因,可能是因为襄阳市地处长江中下游,位于我国地势第二阶梯向第三阶梯过渡地段,区域内地势自西北向东南倾斜,可分为西部山地、中部岗地平原及东部低山丘陵三个地形区,气候总体属于亚热带季风气候向北方温带季风气候过渡,雨热同期[18],每年夏花生播种到收获时期为6 至9 月,此段时间一般雨水较多且温度高,降水分布趋势是自东南向西北递减,种植区土壤也多以保水性较好的黏土为主,为黄曲霉菌生长创造了有利条件。对比襄阳市四个花生产区的数据也呈现该种趋势,黄曲霉菌落数最高的襄州区地势较其它地区更平坦,且均为黏土,而谷城县多山,土壤也多为砂土。由此可以看出,在襄阳市花生主产区中,襄州区的土壤中黄曲霉菌分布最广且菌落数最高,其种植花生过程中的风险也更大,在后期花生被黄曲霉菌侵染的几率也更大。
根据产毒力试验显示,襄阳市花生种植区所分离的黄曲霉菌株以低产毒菌占比最高、不产毒菌次之,这与朱婷婷等调查研究的结论相同。张初曙[10]针对全国主要花生产区的调查研究得出长江流域种植区的土壤黄曲霉菌中高产毒菌占比为10.2%,为全国几个主要产区中最低的,东南沿海高产毒菌占比最高为55.4%,本次调查分析的数据也显示襄阳花生主产区高产毒菌占比为5.4%,远低于其它调查文献[10,15]中东北产区和东南产区分离出的高产毒菌占比,说明襄阳花生产区虽然土壤中黄曲霉菌含量较高,但多为不产毒菌株和低产毒菌株。值得注意的是,本次调查研究结果显示分离出高产毒菌株的两个产区(襄州和宜城)中,高产毒菌株和不产毒菌株的比例呈现负相关性,可以推测花生土壤中不产毒菌株可以抑制高产毒菌的生长。
襄阳花生主要产区的黄曲霉菌株产毒量平均为137.1 µg/L,各个产区的菌株平均产AFT 的量和AFB1的量十分相近,说明襄阳产区土壤黄曲霉菌以产生毒性较强的B1型毒素为主,花生被黄曲霉毒素污染后产生的危害较大(表4)。但对比文献中其它地区黄曲霉菌株产毒力的数据,张初曙[10]的调查结果是长江流域菌株平均产毒量为1566µg/L、东南沿海为5836µg/L、黄河流域为5453µg/L、东北地区为1886µg/L,张杏等[16]调查的西南产区菌株平均产毒量范围为2135~6807.5 µg/L,襄阳花生主产区的黄曲霉菌株产毒量较低。张初曙[10]调查襄阳市襄州产区的土壤黄曲霉菌株产AFB1的量为147µg/L,本调查中相应结果为202.7 µg/L,因为取样地点覆盖面不同,襄州区面积2306平方公里,张初曙[5]调查时襄州区作为一个采样地在一公里范围内取样,本次取样是在襄州区4 个村镇的花生种植地,取样村镇覆盖面积的增加可能会导致样品中分离出高产毒菌的占比更大。
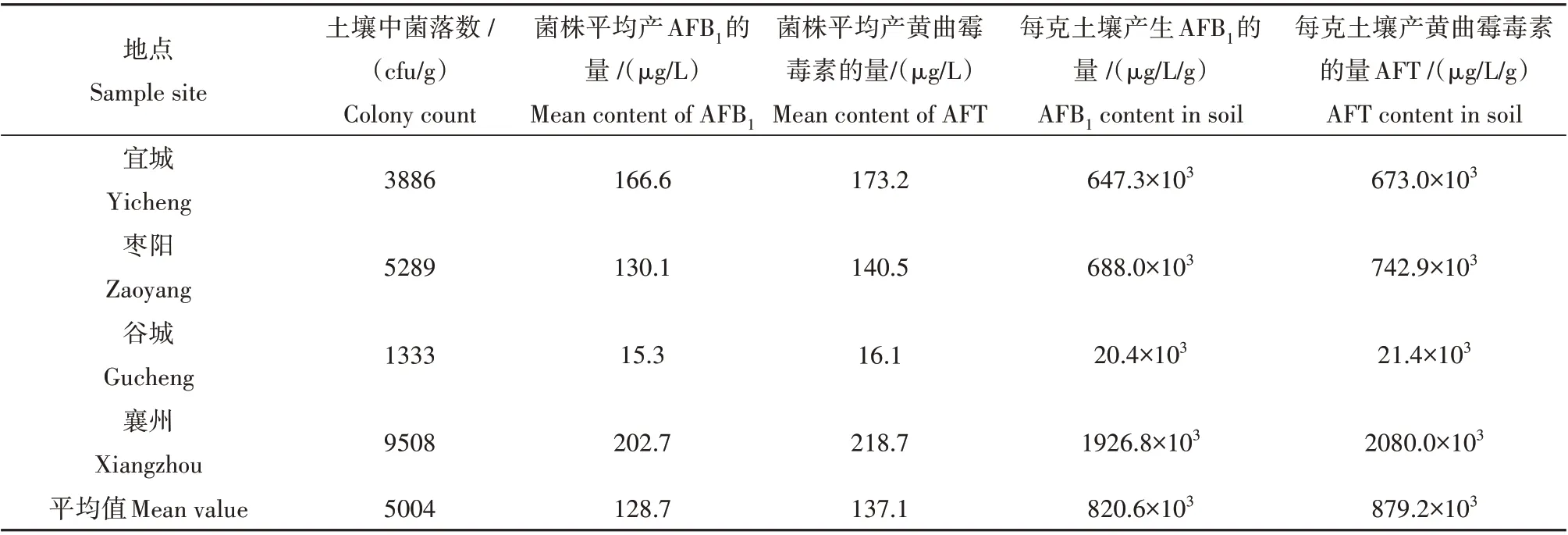
表4 襄阳花生主产区土壤黄曲霉菌株产毒能力Table 4 Ability of aflatoxin production by A.flavus in peanuts fields in Xiangyang
本研究发现,襄阳市花生代表性产区土壤中黄曲霉的分布数量显著高于我国南、北方花生主产区的平均水平,但其菌株的平均产毒能力却远低于全国其它地区。这表明在襄阳市独特的自然地理条件下,大量的不产毒菌和低产毒菌对高产毒菌的生长可能存在一种自然抑制机制[19]。襄阳市花生主要产区中襄州地区土壤中黄曲霉菌分布最多且产毒能力最强,因此在生产过程中应注意土壤的排水措施,并且通过施加生物菌肥等方式降低花生被土壤中黄曲霉菌侵染的几率,通过宜城产区不产毒菌和高产毒菌极显著的负相关性可以考虑投放不产毒黄曲霉素菌作为生防菌,与高产毒菌形成竞争生态位,从而降低花生黄曲霉毒素污染的风险[8]。
黄曲霉的田间污染被认为是花生黄曲霉菌侵染和产毒的重要源头,控制花生收获前土壤中黄曲霉菌的生长和产毒是降低花生黄曲霉毒素污染的重要途径。因此,摸清土壤中黄曲霉菌的分布情况和产毒力特征是开展襄阳花生黄曲霉污染产前防控的前提和基础。本研究下一步将继续探索襄阳花生产区土壤中黄曲霉菌群产毒力与土壤类型之间的关系,以及土壤黄曲霉菌群分布对花生产前、产后黄曲霉侵染风险之间的关系,为襄阳花生产区黄曲霉毒素污染预警和防控措施制定提供理论依据。

