微反应器内的有机合成前沿进展
张经纬,周弋惟,陈卓,徐建鸿
(清华大学化学工程系,化学工程联合国家重点实验室,北京 100084)
引 言
化学工业是我国的经济支柱产业之一,但因为其“高污染、高能耗、高物耗”等问题仍面临着发展与污染的矛盾。在实现“碳达峰,碳中和”双碳目标的大背景下,迫切需要开发新工艺、新方法、新技术以降低化工过程中的能耗物耗从而实现绿色可持续发展。化工过程强化技术具有节能环保、低能耗、集约化的优势,是解决这一问题的重要手段。过程强化包括设备强化和方法强化,典型的强化方式包括设备小型化和过程集约化等。其中,出现于20 世纪90 年代的微化工技术兼具这两方面的特点[1]。与传统化工技术相比,微化工技术利用微尺度下独特的流动与传质特性,强化传质传热性能,提高反应效率和产品质量,保证化工过程的安全性,具有广阔的应用前景[2-5]。
微反应器技术高效的微尺度混合特性、良好的传质和传热性能和本质安全的特点决定了其特别适用于因反应速度快或者放热量大而有危险性的化学反应,如重氮化反应[6]、加氢反应[7-9]、硝化反应[10-11]等。因此,对于医药、农药、染颜料等精细化工领域涉及的霍夫曼重排、环加成、重氮化和偶合、烷基化、氮氧化等典型“强放热快反应”过程,采用微反应连续化工艺可将反应产生的热量迅速移除,有效避免局部过热,减少副反应的发生,更能够防止由于热量积聚而产生飞温现象,降低反应失控风险,有望实现生产过程的高效、绿色和安全。本文将重点介绍近年来有关上述几类反应在条件优化和过程强化方面的最新研究进展,并展望其发展前景。
1 霍夫曼重排反应
霍夫曼重排反应于1881 年由德国著名化学家Hofmann[12]发现,该反应通常是指伯酰胺在卤素和碱作用下发生重排,经异氰酸中间体生成比反应物少一个碳的伯胺的反应。该反应是制备许多医药中间体的关键反应,具有重要的研究价值[13-15]。此外,霍夫曼重排反应也可以用来制备各种氨基功能材料[16-17],这些材料在医药、吸附、催化等众多领域都有广泛的应用。
目前工业生产中霍夫曼重排反应的反应设备主要是釜式反应器。采用釜式反应工艺时,考虑到卤素试剂的高活性和强腐蚀性,通常采用两段工艺保证反应过程的安全进行。其中,第一阶段是低温反应,目的是将原料伯酰胺通过卤化反应转化成异氰酸酯中间体。第二阶段是高温反应,是使异氰酸酯中间体转化为最终产物。工业生产常用工艺虽然可以获得较高的产率,但仍存在如下问题[18-19]。第一,反应耗时长,生产效率低。第一阶段的低温反应过程虽然能有效防止由于卤素试剂的高活性而带来的危险,但导致反应时间过长,生产周期大大增加,生产效率不理想。第二,高能耗,高物耗。由于釜式反应器的换热能力有限,反应过程中需要大量的冷却水,导致了能耗的提高;长时间低温反应也会使反应的选择性降低,副产物增多,产生废水增加,导致物耗提高。第三,反应的系统稳定性差,安全风险高。尽管两步法工艺流程降低了生产过程的危险性,但反应釜较差的换热性能仍然导致整个系统的鲁棒性差,一旦物料或反应条件出现偏差,极可能导致产品质量下降,甚至出现爆炸危险。
微反应器技术可有效解决上述三个问题并展现出高效性和稳定性两大突出优势。微反应器的换热性能与传统釜式反应器相比高1~2 个数量级,在换热方面的显著优势允许采用一步法工艺完成整个霍夫曼重排过程,减少了反应步骤,缩短了反应周期,具有高效性的优势。其次,微尺度下的连续流动过程对传质和混合效果有明显强化,能够大幅增加工艺的稳定性。目前,微反应器技术应用于霍夫曼重排过程已有许多研究进展。如图1 所示,Huang 等[20]以环丙甲酰胺(CPCA)、NaClO 和NaOH 为原料,连续高效合成了环丙胺(CPA),通过优化反应温度和停留时间,产率可达到95%~96%,反应时间仅需4 min,缩短为釜式工艺的1/30。

图1 制备环丙胺的微反应实验装置示意图[20]Fig.1 Schematic diagram of a microreaction experimental apparatus for the preparation of cyclopropane[20]
加巴喷丁是一种由霍夫曼重排反应合成的常用抗癫痫药物,其经典的合成工艺为低温取代—高温重排的两步法工艺。由于低温取代过程是强放热过程,反应温度往往低于0℃以确保过程的安全性,反应时间较长。Huang 等[21]借助微反应器,利用1,1-环己基二乙酸单酰胺(CDMA)、NaClO 和NaOH为原料,合成了抗癫痫药物加巴喷丁,微反应器结构如图2 所示。他们系统研究了物料浓度、反应温度和停留时间等关键因素对反应过程的影响规律并对反应条件进行了优化,在停留时间为400 s、反应温度为45℃时,产率可达到97%。该工艺流程利用微反应的强换热性能保障了高温下取代反应的安全高效进行,实现了加巴喷丁的高效安全制备。目前也有研究者使用微反应器平台探索新的卤化剂在霍夫曼重排反应中的应用,Gambacorta 等[22]以三氟异氰尿酸(TCCA)为卤化剂与水杨酰胺反应连续合成2-苯并唑啉酮,当反应温度为22℃,停留时间为0.5 min 时,就可以得到99.5%的转化率和97.6%的主产物收率。TCCA 是一种超高反应活性的卤化剂,一旦反应中出现局部过热的情况,就会导致烷基段发生取代副反应,影响选择性。在这一过程中,微反应器的高效传热保障了反应环境中温度均匀分布,实现了高转化率和高收率的优化结果。微反应连续合成新工艺不但可以大大提高霍夫曼重排反应的效率,大幅缩短反应周期,提高安全性和生产效率,同时也可以用于安全高效探索新的反应体系,尤其是高反应活性的反应体系。
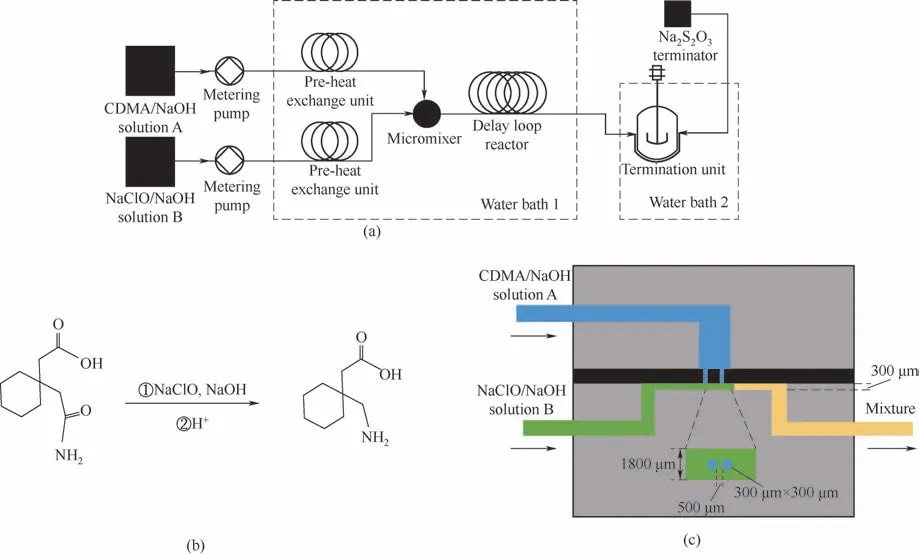
图2 (a)制备加巴喷丁的微反应实验装置示意图;(b)合成反应方程;(c)微通道的内部结构示意图[21]Fig.2 (a)Schematic diagram of the microreaction reaction experimental setup for the preparation of Gapentin;(b)Synthesis equation;(c)Schematic diagram of the internal structure of the microchannel[21]
2 环加成反应
为了实现双碳目标中碳排放量净值降低的目标,除了减少CO2的排放量,CO2化学转化制备精细化学品也是重要的研究方向之一。CO2可转化为各种高附加值产品,包括环状碳酸酯[23]、唑烷[24]、甲醇[25]等。其中,利用CO2与环氧化合物加成由于其100%的原子经济性而成为重要的研究方向之一[26]。其产物环状碳酸酯可应用于非质子极性溶剂、二次电池电解质、合成某些化学品的中间体和聚合物的前体等领域[27]。
环加成反应具有绿色环保,产品附加值高的优点,然而其反应工艺流程的设计尚存在困难。首先,环加成反应的控制步骤为CO2在液相催化剂中(常常为离子液体)的气-液传质过程,这一过程需要较高的气体压力,在传统釜式反应器中进行缓慢,因此反应效率低,耗时长,且由于压力过高存在安全隐患[28]。其次,由于离子液体具有高催化活性,一旦在反应器内混合不均匀将导致局部过热,进而可能造成环氧基中间体发生爆炸,面临严重的安全风险。微反应器作为合成平台,在环加成反应过程中有独特的优势。第一,微反应器内的气-液相间传质速度高出传统釜式反应设备一个数量级以上[29],能够有效解决反应速度受气-液传质控制的问题。第二,微反应器优异的混合和传热性能可及时移走反应热,避免产生局部过热的现象,加快反应速度,缩短反应周期[30]。
基于上述优点,本课题组[31]采用微反应器技术以绿色无污染的非金属基离子液体催化剂对环氧丙烷和CO2的环加成过程进行了系统的研究,重点优化了反应条件并揭示了反应动力学规律。Wu等[32]以微反应器为反应平台,以离子液体为催化剂将环氧丙烷与CO2反应合成碳酸丙烯酯,反应过程和设备示意图如图3 所示。通过调控相比、温度和压力等反应条件,在仅40 s的停留时间条件下,碳酸丙烯酯收率达到98%以上。而使用类似催化剂的釜式反应工艺中,需要6 h 的反应时间才能达到90.7%的产率[33]。此工作证明了微反应器技术可大幅缩短碳酸丙烯酯合成的反应周期,提升反应效率,减少副反应。

图3 制备碳酸丙烯酯的微反应实验装置示意图[32]Fig.3 Schematic diagram of the microreaction experimental setup for preparation of propylene carbonate[32]
微反应系统也可以用来揭示CO2环加成反应的动力学规律。Wu 等[34]利用微反应器平台对上述反应的动力学规律进行了系统的研究,揭示了可能的反应机理,并指出该反应速率与环氧丙烷浓度、CO2相对浓度和催化剂的浓度均为线性关系,得到了表观动力学方程。此研究结果可以用来指导微反应器中环加成反应的反应条件优化,反应机理如图4所示。也有研究者利用微反应器为平台,探索了新的CO2环加成反应催化剂的催化效果。Li 等[35]合成了一种以纳米二氧化硅为载体无卤素的离子液体催化剂,用微反应器平台测量了其催化效果并研究了催化动力学。该工作中,微反应器的重要作用是以其高传质性能尽量消除外扩散对于催化效果的影响,测量催化过程的本征动力学。从上述研究工作可以看出,微反应器由于其高传质传热性能,对于CO2环加成一类的气-液多相反应过程具有良好的适应性,在反应条件优化,反应机理探索和新反应过程的设计方面均有独到的优势。
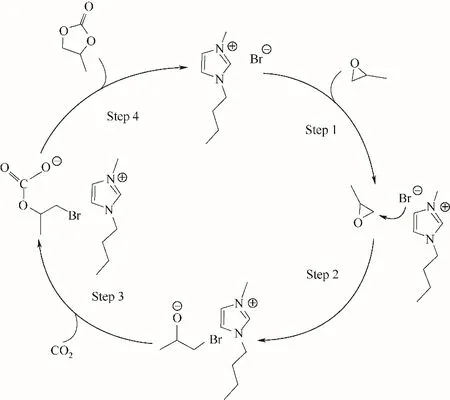
图4 由[bmim]Br催化的CO2环加成的可能机理[34]Fig.4 The possible mechanism for the cycloaddition of CO2 catalyzed by[bmim]Br[34]
3 重氮化反应与重氮偶合反应
偶氮化合物已被用于许多领域,如材料[36]、绘画[37]、生物制药研究[38-39]、化妆品[40]和油墨工业[41]等。目前合成偶氮化合物的主要工艺是重氮化-重氮偶合串联反应。重氮化反应是指芳香族伯胺与亚硝酸作用生成重氮盐。重氮化反应应用广泛的原因是重氮化反应合成的重氮盐中间体反应活性较高,可以在不同的反应条件下继续合成其他化合物。例如,重氮盐中间体可以进行水解生成酚类化合物,可以被亲核试剂攻击合成偶氮化合物[42],也可以与卤素原子发生取代生成芳香族氯化物[43]、芳香族氟化物[44]、芳香族碘化物[45]等。而重氮盐生成偶氮化合物的重氮偶合反应,则是指重氮盐进一步与芳胺、酚类发生氮氮间的偶联产生氮氮双键[46-47]。目前,重氮化/重氮偶合反应的反应器还是以反应釜为主。重氮盐中间体因其活泼性而用途广泛,但同样由于其活泼性,重氮盐具有热不稳定和冲击敏感的特点,当温度升高时可能会导致重氮化/偶合反应失控出现爆炸等危险情况[48]。因此,出于安全考虑,无论是生成重氮盐的重氮化反应还是以重氮盐为反应物的重氮偶合反应,反应过程的稳定可控都相当重要。
强换热能力和高稳定性的微反应平台为解决上述安全问题和开发重氮化/重氮偶合反应新工艺提供了契机。在重氮化/重氮偶合反应中引入微反应器作为反应设备,既可以降低由于传热性能不足导致的潜在风险,又能通过强化混合效果带来更好的产品性能。目前,已经有研究者针对微反应器内的多类重氮化/重氮偶合反应进行了研究[49]。
颜料红146 是一种典型的水性偶氮颜料,被广泛用于印刷色浆、水性涂料和油墨颜料[50-51]。Wang等[52]以3-氨基-苯胺(KD)和N-(4-氯-2,5-二甲氧基苯基)-3-羟基-2-萘酰胺(AS-LC)为原料通过重氮偶合反应高效合成了该种偶氮颜料,反应方程式与设备的示意图见图5。结合实验结果与CFD 模拟,研究者认为微反应器中的两相混合效果远远强于釜式反应器是提升产品均匀性和转化率高的主要原因。通过调控温度和反应液浓度,在反应温度为25℃,停留时间为40 s 时,KD 可达到99.50%以上的转化率,且产品纯度超过98%。在各类偶氮颜料中,黄色偶氮颜料常常用在印刷过程的最后一个步骤,需要高透明度和纯度[53]。Wang 等[54]借助微反应器对常用颜料黄14 生产过程中的重氮化/重氮偶合过程进行了系统研究和条件优化,制备得到的产品纯度可以达到90%且颗粒分布均匀,反应的过程如图6 所示。除了用于合成偶氮染颜料,微反应器对于其他各类的重氮化/偶合反应过程也有显著的优化效果。Jiang 等[55]使用串联的微反应器平台实现了4-硝基苯胺(PNA)重氮化—结晶—偶合三步连续过程生成4-硝基联苯(4-NBP),在最优条件下总产品收率可达80%,反应流程如图7 所示。上述研究表明,对于均相或非均相的各类重氮化/重氮偶合反应过程,微反应器技术都能大大提升反应过程的安全性和稳定性,在提高偶氮产品关键性能的同时缩短反应所需时间,相比于传统的釜式工艺有明显的优势。

图5 (a)合成颜料红146的偶合反应;(b)合成颜料红146的微反应系统示意图[52]Fig.5 (a)Coupling reaction of C.I.PR 146;(b)Experimental setup of the C.I.PR 146 synthesis microreactor system[52]
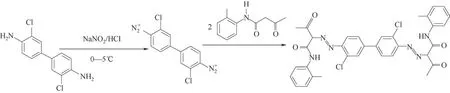
图6 颜料黄14合成的重氮化和偶合反应[54]Fig.6 Diazotization and azo coupling reaction for Yellow 14[54]
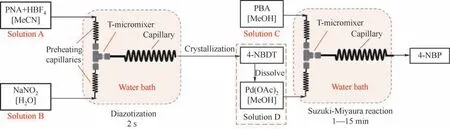
图7 4-硝基苯胺重氮化/重氮偶合流程图[55]Fig.7 Flow chart of diazotization/diazo coupling of 4-nitroaniline[55]
在重氮化反应的反应动力学方面,Wang 等[56]利用微反应器为平台,研究了重要偶氮颜料前体红色基KD 的重氮化反应动力学,并给出了流-固耦合的传质-反应模型,实验所采用的设备如图8所示。利用微反应器内停留时间和反应温度准确可调的特性,可通过标定不同温度和停留时间下产生的偶氮颜料的量来计算重氮盐中间体的含量。研究者指出由于微通道内混合过程迅速,反应过程受混合的影响较小,因此可利用微反应器搭建可靠的本征动力学数据测量平台。该研究结果证明微反应器优异的传递特性不但在工艺条件优化方面具有一定的优势,同时在基础动力学数据的准确获取方面也有重要的作用。
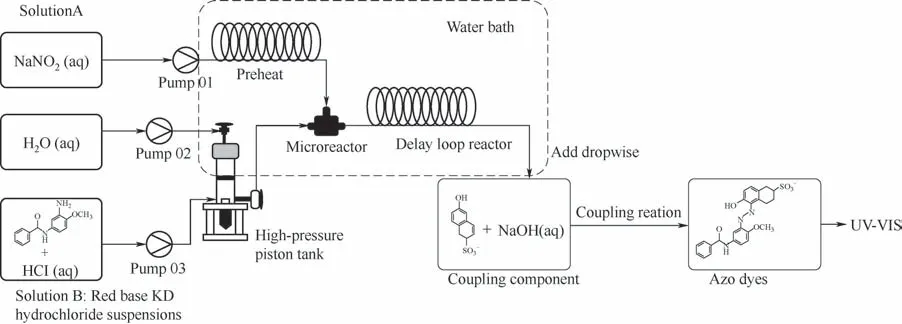
图8 红色基KD合成装置示意图[56]Fig.8 Sketch for diazotization and azo coupling reaction for Red KD[56]
4 烷基化反应
烷基化反应是在酸性催化剂存在下用烷基化剂合成烷基芳香烃的反应,由于其反应过程简单,原料易得,成为了最常见的合成烷基芳香烃的方法[57]。烷基化试剂种类繁多,如烯烃[58]、醇[59-60]和卤代烷[61],但由于选择性和反应效率的要求,α-烯烃的使用最为广泛[62]。硫酸是经典的工业化酸性催化剂,已经有研究者针对硫酸催化体系在微反应器中的动力学规律开展研究[63]。而在近年来,由于催化效率高和反应时间短的优势,酸性离子液体作为烷基化反应的催化剂受到关注[64-65]。相比于传统的硫酸催化剂,离子液体在催化效率方面具有优势,但在实际工艺过程中还存在如下的问题。第一,相比于经典的酸催化剂,离子液体催化的反应体系基础动力学数据不足。反应工艺流程和反应器的设计都需要大量的动力学数据作为支撑,因此需要构建准确快速获得动力学数据的测量平台。第二,离子液体催化的反应体系本征动力学快,传热和混合效率是控制反应速率的重要因素。由于反应速度过快,过程中释放的反应热一旦积累可能导致危险。目前,釜式反应器的传热性能较难满足以离子液体作为催化剂的反应过程,不能充分发挥离子液体的优异催化性能。
微反应器技术可有效解决上述工艺问题。首先,微反应器中的流体高度有序,重复性好,单次反应周期短,是测量动力学数据的良好平台。其次,微反应器优异的传热和混合性能能够最大限度地避免由于过热和混合不均匀带来的烷基化产品均匀度下降或副反应等问题,能充分发挥离子液体优异的催化性能。因此,本课题组针对工业级α-烯烃的萘烷基化开展了相关工作。Yang 等[66]以工业级混合α-烯烃为原料,离子液体(AlCl3)为催化剂,进行微反应器内萘烷基化过程的研究,此工作的微反应系统如图9 所示。通过调控反应物的相比和温度,停留时间为40 s 时即可达到超过99%的原料转化率。研究结果表明,选取内径更小的微混合器,能够在同样的反应条件下达到更强的混合效果,提高反应速率和原料转化率。

图9 连续流系统的示意图[66]Fig.9 Schematic of the continuous-flow reactor system[66]
目前,也有研究者利用微反应器研究新型烷基化体系。Wang 等[67]以具有交错十字通道的微反应器为平台,探索了酸性咪唑离子液体[CnMIm][OTf]与H2SO4组成的二元酸性催化剂对于异丁烷/1-丁烯反应体系的催化效果。实验结果和模拟结果均证明微反应器中的强化混合效果提升了主反应的选择性。在最优实验条件下,在微反应器中的停留时间为81 s时,即可达到94.2%以上的1-丁烯转化率,产品辛烷值为99.5。对于同一反应过程,釜式反应需耗时10~15 min,得到产品的辛烷值为92~94[68]。
上述研究表明,针对各类烷基化反应过程,微反应器都能强化混合过程,缩短反应时间,提升产品质量。同时,相比于釜式反应器,微反应器也可以更加快速准确地获得新型复杂多元催化剂的催化动力学数据,用于指导反应过程设计。
5 氮氧化反应
氮氧化反应是通过强氧化剂氧化含氮杂环的有机合成反应,此类反应常常由于含氮杂环性质不稳定而有一定的危险性。3-甲基吡啶-N-氧化物是制备2-氯-5-甲基吡啶的重要中间体,可用于合成吡虫啉、啶虫脒等烟碱类杀虫剂,具有重要的商业价值[69]。3-甲基吡啶-N-氧化物的传统生产方法是在半间歇式反应器中由3-甲基吡啶催化氧化制备。但由于3-甲基吡啶强烈的爆炸性[70],采用间歇技术反应效率和安全性较低[71]。相比于釜式反应器,微反应器技术由于优异的换热能力,可从根源上防止由于浓度和温度分布不均匀而产生的潜在爆炸危险。
基于上述原因,本课题组针对3-甲基吡啶-N-氧化物的合成开展了相关工作。Sang等[72]研究了微反应器内3-甲基吡啶和H2O2为原料,MoO3为催化剂制备3-甲基吡啶-N-氧化物的反应过程,示意图如图10 所示。研究者设计了一种半连续循环微反应的新工艺,可以将原料的转化率提升至90%以上,反应时间大大缩短。此外,氮氧化反应已经有商业化的微通道技术[73]。Hamano 等[74]使用了一种商业化的玻璃微通道利用氧气或空气氧化2-、3-和4-甲基吡啶合成对应的羧酸。在常温常压连续流动条件下,2-、3-和4-甲基吡啶在氧气或空气中直接氧化成相应的羧酸而不需要任何的金属基催化剂,停留时间只需5 min,所有反应物的转化率都能达到95%以上。该过程所采用的商业化设备示意图如图11所示。

图10 循环微反应器示意图[72]Fig.10 Sketch for circular microreaction[72]

图11 商业化微反应器示意图[74]Fig.11 Sketch for commercial microreaction[74]
上述研究表明,微反应器对于氮氧化反应有较好的适用性,能够在提升反应安全性的同时加快转化速率,提升产品收率,有良好的商业应用前景。尽管微通道中的传质传热效果好,但部分氮氧化反应的本征动力学过慢,因此必须采用合适的催化剂,加快本征反应速度,才能体现出微通道传递特性的优势[75]。
6 结论与展望
本文综述了微反应器技术对霍夫曼重排、环加成、重氮化和偶合、烷基化、氮氧化等典型“强放热快反应”有机合成反应的应用和研究进展。应用微反应器技术对各类反应进行条件优化和机理探索,不仅能够使得这些典型的危险反应工艺向着绿色、安全、高效和可持续化方向发展,而且能帮助研究者深入了解此类反应的机理,并进一步解决此类反应生产过程中的瓶颈问题。基于目前的研究进展,未来微反应器技术的发展应该在以下几个方面加强研究。
(1)反应机理的研究。现有微反应研究主要着眼于反应条件的优化和表观动力学的探究,缺乏对于反应机理和本征动力学的揭示。通过对反应机理和本征动力学的深入研究,可以揭示反应选择性的影响规律以及反应过程强化的优化方向。
(2)过程在线分析技术的应用。随着各类检测手段的发展,微反应器内实时、可视化检测手段的应用将促进该技术进一步发展。微反应器可结合在线红外、紫外、拉曼光谱、气质联用等在线检测技术,及时、准确地获取反应信息,显著提高工艺开发的整体效率,还能监控反应进程,实现过程的实时监控。同时,可以利用收集到的数据进行连续反馈与自调控,实现反应过程“自我优化”的效果。
(3)新工艺技术工业化的应用基础研究,尤其是微反应装置放大规律的探索。目前,大多数微反应器的工艺研究未能真正投入工业生产,停留在实验室阶段。微反应器经过并联放大和相似放大后,是否能够保留良好的传递和反应性能,还有待进一步研究,其放大后的流动传质与反应规律也需进一步深入探索。

