NLRP3 炎症小体作为肾脏疾病潜在治疗靶标的研究进展
赵 婷,张芳菲,汪年松,王 锋
上海交通大学医学院附属第六人民医院肾内科,上海 200030
急性肾损伤(acute kidney injury, AKI)和慢性肾脏病(chronic kidney disease, CKD)是常见的肾脏损伤,具有高发病率、高死亡率和高治疗成本的特点。炎症小体在肾脏疾病的发生和发展中非常重要,尤其是核苷酸结合寡聚化结构域样受体家族含pyrin 结构域蛋白3(nucleotide-binding oligomerization domain-like receptor family pyrin domain-containing protein 3, NLRP3) 炎 症 小 体。本文对NLRP3 炎症小体在AKI 和CKD 发病中的作用及相关治疗研究进展作一综述。
1 NLRP3 炎症小体的结构和激活
1.1 NLRP3 炎症小体的组成成分及各成分作用 NLRP3 炎症小体由核苷酸结合寡聚化结构域样 受 体 (nucleotide-binding oligomerization domainlike receptors, NLR)、 凋 亡 相 关 的 斑 点 样 蛋 白(apoptosis-associated speck-like protein containing a CARD, ASC) 和 半 胱 氨 酸 天 冬 氨 酸 蛋 白 酶 1(caspase-1)组成[1]。NLR 由富含亮氨酸的重复序列(leucine-rich repeat, LRR)、吡啶结构域(pyrin domain, PYD)和 1 个中央核苷酸结合结构域(NACHT)组成[2]。NLR 作为一种模式识别受体(pattern-recognition receptor, PRR),可以识别1 种或多种病原相关分子模式(pathogen-associated molecular pattern, PAMP) 和 宿 主 来 源 的 危 险 相关 分 子 模 式(danger-associated molecular pattern,DAMP)。ASC 作为衔接蛋白,含有与NLRP3 衔接的PYD 域和与caspase-1 衔接的胱天蛋白酶激活和 募 集 结 构 域(caspase activation and recruitment domain,CARD)。Caspase-1 是第 1 个被发现的半胱氨酸天冬氨酸蛋白酶。Caspase-1 前体包含CARD、p20 大亚基和p10 小亚基,激活后裂解为p20 和p10,促进白介素1β(IL-1β)、白介素18(IL-18)和焦亡诱导因子Gasdermin D (GSDMD)成熟,发挥诱导炎症和细胞凋亡作用[3]。
1.2 NLRP3 炎症小体效应分子 成熟的IL-1β 是炎症反应的重要介质,并参与多种细胞活动,包括细胞增殖、分化、凋亡以及将炎症细胞募集到感染部位。IL-1β 可通过影响足细胞蛋白质(如肾素)的产生,破坏足细胞的结构完整性和功能[4];同时可通过破坏肾小球内皮细胞的紧密连接和黏附,破坏肾小球滤过屏障[5]。IL-18 是肾脏中另一种重要的炎症细胞因子,参与并调节各种T 细胞的活化和分化,进而参与机体适应性免疫[6]。IL-18 还介导其他炎性细胞因子的产生,如一氧化氮、细胞黏附分子和趋化因子,诱导炎症细胞活化并向肾脏聚集[7]。此外,GSDMD 作为 caspase-1 的下游靶标,由caspase-1 诱导裂解成熟,从而在细胞焦亡和IL-1β 分泌中发挥重要作用[8]。
1.3 NLRP3 炎症小体激活主要过程 NLRP3 炎症小体激活包含启动和激活两个步骤:第1 步,在PAMP 和DAMP 作用下,多种通路激活促炎性 核 因 子 -κB(nuclear factor -κB, NF-κB), 促使 NLRP3、ASC、caspase-1 前 体、IL-1β 前 体和IL-18 前体转录和表达,即NLRP3 炎症小体及其下游分子原料准备[9];第 2 步,NLRP3 通过PYD-PYD 域相互作用招募ASC,随后ASC 通过CARD-CARD 相互作用募集caspase-1 前体而组装成NLRP3 炎症小体,并激活caspase-1 前体,即NLRP3 的组装和激活[10](图 1)。

图1 NLRP3 炎症小体激活的机制
1.4 NLRP3 炎症小体在肾脏中激活的机制 NF-κB/NLRP3 是NLRP3 炎症小体激活的重要路径之一,淫羊藿苷和厚朴酚可通过调节NF-κB/NLRP3途径减轻狼疮性肾炎(lupus nephritis, LN)患者的肾脏损伤[11-12]。有研究[13]发现,嘌呤能受体P2X7 在NLRP3 炎症小体激活中发挥重要作用。该研究发现,在LN 小鼠模型中,P2X7/NLRP3 信号通路中炎性分子显著增加,而抑制P2X7 可抑制NLRP3-ASC-caspase-1 的组装,表明NLRP3 炎症小体在LN 中起至关重要的作用。最近研究[14]发现,P2X4 在缺血再灌注(ischemia-reperfusion,I/R)诱导的AKI 小鼠模型中通过激活NLRP3 炎症小体诱导肾脏炎症和肾脏细胞凋亡;相反,P2X4缺失可预防缺血性AKI,减少肾小管坏死,减轻肾脏细胞凋亡,减少肾脏中性粒细胞浸润。P2X 相关NLRP3 炎症小体激活机制见图1。
高葡萄糖、脂多糖和氧化应激等能促进NLRP3 炎症小体的组装和激活[15-16]。ROS-硫氧还蛋白互作蛋白(ROS-thioredoxin-interacting protein,TXNIP)是NLRP3 炎症小体激活过程中的另一重要分子。Gao 等[17]和 Wang 等[18]发现,在高葡萄糖环境下,TXNIP 激活还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)氧化酶后,足细胞中NLRP3 炎症小体激活,进而引起足细胞损伤[17-18]。Wen 等[19]发现,抑制 mROS 产生可以抑制NLRP3 和TXNIP 的共定位以及NLRP3 炎症小体的激活;此外,TXNIP siRNA 明显抑制了I/R 损伤小鼠模型中的NLRP3 炎症小体激活。该研究表明,mROS-TXNIP-NLRP3 是I/R 诱导的AKI 发生的关键信号传导途径,为针对NLRP3 炎症小体信号途径的基因治疗提供了新方式。
1.5 非炎症小体依赖的NLRP3 的作用 除NLRP3炎症小体外,NLRP3 在肾脏中也独立于炎症小体发挥作用。Wang 等[20]报道,NLRP3 独立于炎症小体而直接促进转化生长因子β(transforming growth factor-β, TGF-β) 信 号 传 导 和 R-Smad 活化,进而促使上皮间质转化。TGF-β 诱发的纤维化信号可在NLRP3 缺乏的成纤维细胞中减弱[21]。NLRP3 还可与线粒体中的ASC 和caspase-8 形成复合物,调节肾脏和肠上皮中的细胞凋亡[22]。在凋亡过程中,线粒体抗病毒信号蛋白(mitochondrial antiviral signaling protein, MAVS)可连接并激活线粒体中的 caspase-8[23]。Kim 等[24]发现,缺氧时肾小管细胞中的NLRP3 从细胞质重新定位于线粒体并与MAVS 结合,而缺氧时NLRP3 或MAVS 的缺失可减少线粒体ROS 的产生和线粒体膜电位的去极化,从而保护肾脏免受损伤。因此,NLRP3可独立于炎症小体发挥作用,其机制有待进一步阐明。
2 NLRP3 炎症小体在AKI 中的作用
2.1 NLRP3 炎症小体在I/R 中的作用及机制 I/R损伤肾脏中NLRP3 炎症小体蛋白(NLRP3、caspase-1、GSDMD 和 IL-1β) 增 加, 而 NLRP3基因缺失可显著减轻肾脏损伤[25-26]。在I/R 介导的AKI 中,NLRP3 炎症小体主要定位于肾小管上皮细胞[19]。多种信号通路与I/R 诱导的AKI中NLRP3 炎症小体的激活有关。Tang 等[27]证明NLRP3 和ASC 共定位于核周间隙,并认为溶酶体组织蛋白酶可能是NLRP3 炎症小体的激活剂之一。该研究还发现,组织蛋白酶B、组织蛋白酶D 和组织蛋白酶L 均调节NLRP3 炎症小体成分(caspase-1 前体和IL-1β 前体)的表达,但仅组织蛋白酶B 和组织蛋白酶L 通过裂解的caspase-1和IL-1β 诱导NLRP3 炎症小体活化,表明组织蛋白酶可能诱导NLRP3 炎症小体活化,且不同类型的组织蛋白酶可能发挥不同的作用。P2X4 在I/R 诱导的 AKI 中通过促进 NLRP3 和 caspase-1 表达及IL-1β 加工诱导NLRP3 炎症小体信号转导,而P2X4 的缺失或拮抗则可预防缺血性AKI[14]。Xiao 等[28]发现,糖尿病小鼠更易发生I/R 及AKI,mROS-TXNIP-NLRP3 通路在其中发挥重要作用。Pang 等[29]观察到在 I/R 介导的 AKI 小鼠模型中GSDMD 的表达水平明显升高,提示NLRP3 炎症小体介导的焦亡在I/R 介导的 AKI 损伤中发挥作用。Nazir 等[30]发现, NLRP3 可独立于炎症小体在AKI 中起作用,在肾脏I/R 中,NLRP3 导致组织损伤过程与ASC 和细胞因子产生无明显相关性。Cell 发表的一项研究[31]表明,多巴胺可以通过抑制NLRP3 炎症小体来控制全身性疾病。D-1 多巴胺受体相互作用因子A68930 可减少线粒体损伤并改善I/R 诱导的AKI 小鼠的肾功能损伤[32]。这些发现为I/R 介导AKI 的机制研究和治疗提供了新的方向。
2.2 NLRP3 炎症小体在造影剂肾病中的作用及机制 造影剂损伤为AKI 的另一个常见原因,导致肾脏细胞功能障碍和凋亡。Lau 等[33]发现,暴露于造影剂的AKI 患者的尿白细胞中IL-18 和裂解caspase-1 的水平升高。Shen 等[34]发现,在对比剂处理的人肾近端肾小管细胞HK-2 中,NLRP3 和ASC 水平升高,而NLRP3 或ASC 的缺失可以减弱IL-1β 和 IL-18 的分泌,且抑制 HK-2 凋亡。Lin 等[35]报道,在体内和体外造影剂肾病模型中,肾小管上皮细胞能诱导线粒体自噬,而PINK1-Parkin 通过介导线粒体自噬而减少NLRP3 炎症小体激活进而发挥肾脏保护作用。该发现为抑制NLRP3 炎症小体激活提供了新思路。但是,造影剂在体内和体外不同细胞中与NLRP3 关系不同,如造影剂可通过激活巨噬细胞中的NLRP3 炎症小体引起肾脏损伤,而在体外可不依赖NLRP3直接诱导肾小管上皮细胞死亡[33]。因此,造影剂在体内不同细胞中对NLRP3 炎症小体的作用以及机制仍需要进一步求证。
2.3 NLRP3 炎症小体在脓毒症诱导的AKI 中的作用及机制 脓毒症诱导的AKI(sepsis induced AKI, S-AKI)模型通常通过在小鼠腹腔内注射脂多糖(lipopolysaccharide, LPS)建立。研究发现,在S-AKI 体内和体外模型中,NLRP3、裂解caspase-1、IL-1β 和 IL-18 蛋白均显著增加[36-37],NLRP3 炎症小体诱导的炎症和氧化反应可导致S-AKI 的发生[38],而 LPS 诱导的 AKI 可在 NLRP3炎症小体和氧化应激被抑制后减轻[39]。此外,Huang 等[40]报道,NLRP3 炎症小体诱导的细胞凋亡也是S-AKI 损伤的重要机制。
3 NLRP3 炎症小体在CKD 中的作用
CKD 的临床发病率高,且患者常预后不良。最近一项纳入80 例CKD(高血压肾病、糖尿病肾病、肾小球肾炎、阻塞性肾病和多囊肾病)患者的研究[41]表明,NLRP3 的表达水平随CKD 严重程度的增加而升高。
3.1 NLRP3 炎症小体在肾纤维化中的作用及机制 肾纤维化是各种CKD 的发展重要机制和共同途径,导致肾功能进行性丧失,并最终导致终末期肾衰竭。细胞外钙通过钙敏感受体启动信号转导后,可有效激活NLRP3 炎症小体并诱导肾纤维化[42]。Schmidt-Lauber 等[43]也证明,在造影剂肾病小鼠模型中,NLRP3 炎症小体激活促进IL-1β 分泌和肾纤维化。而体外实验[44]也表明,IL-1β 可诱导CKD 发展及肾小管上皮细胞向成纤维细胞转化。敲除NLRP3 基因可保持小鼠肾小管中线粒体的形态,改善CKD 相关高血压和蛋白尿,并减轻肾纤维化[45-46]。总之,NLRP3 炎症小体通过介导氧化应激和炎症诱导肾纤维化[47]。此外,NLRP3 可独立于炎症小体介导肾脏炎症、损伤和纤维化[20]。
3.2 NLRP3 炎症小体在糖尿病肾病(diabetic kidney disease, DN)中的作用及机制 DN 是 CKD的最常见原因之一。NLRP3 mRNA 在2 型糖尿病患者肾脏中增加,在DN 患者中水平更高[48-49]。另一项研究[50]也发现,肾小管间质损伤的糖尿病患者肾小管中NLRP3 炎症小体表达增加。在DN 小鼠的肾小球内皮细胞和足细胞中也观察到NLRP3 炎症小体激活[50]。NLRP3 炎症小体的激活诱导促炎因子的产生,并进一步促进DN 患者发生胰岛素抵抗[51]。相反,敲除或抑制NLRP3 可降低糖尿病肾脏损伤[50]。NLRP3 炎症小体在DN发生过程中的激活涉及多种通路,如核因子E2 相关因子 2(nuclear factor erythroid 2-related factor 2,Nrf2) 通 路[52]、ROS/TXNIP 通 路[53]、NF-κB 通路和 P2X7/NLRP3 通路[54]。此外,自噬可抑制NLRP3 炎症小体的激活[55]。而在DN 大鼠模型中,线粒体自噬通过调节巨噬细胞M1、M2 比例减轻机体炎症反应和进一步损害,维持体内稳态[56]。最近研究[57]表明,NLRP3 通过抑制足细胞自噬,介导DN 小鼠模型的肾脏损害。
3.3 NLRP3 炎症小体在单侧输尿管阻塞模型中的作用及机制 单侧输尿管阻塞模型(unilateral ureter obstruction, UUO) 作 为 CKD 模 型, 为 肾纤维化进展的分子和细胞机制研究提供了基础。UUO 的特征为进行性肾纤维化伴细胞外基质(extracellular matrix, ECM)沉积和肾小球损伤评分增加。UUO 小鼠中NLRP3 炎症小体及其下游细胞因子(如成熟的IL-1β 和IL-18)增加[58]。此外,与对照小鼠相比,NLRP3 基因敲除的UUO 小鼠的肾纤维化、ROS 损伤和凋亡减弱,线粒体形态和功能损害较小[46]。
3.4 NLRP3 炎症小体在IgA 肾病中的作用及机制 IgA 肾 病(IgA nephropathy, IgAN) 是 最 常见的肾小球肾炎。有25%~30%的IgAN 患者在患病20 年后出现肾衰竭。IgAN 小鼠巨噬细胞中NLRP3 炎症小体被IgA 免疫复合物激活,而NLRP3 敲除小鼠的肾损伤减轻[59]。从 IgAN 患者血清中分离获得的Dys-糖基化的IgA1 可诱导足细胞中NLRP3 表达,并引起足细胞巨噬细胞转化,进而导致肾脏炎症和纤维化[60]。这些证据表明,NLRP3 在IgAN 发展中起重要作用,具体的机制还有待进一步研究。
3.5 NLRP3 炎症小体在LN中的作用及机制 NLRP3炎症小体成分(NLRP3、ASC、caspase-1 和IL-1β)在LN 小鼠肾脏中表达增加[13]。在人和小鼠的足细胞中,NLRP3、caspase-1 和IL-1β 的表达增加,同时caspase-1 p20 表达增加,表明NLRP3 炎症小体被激活[61]。而沉默或抑制NLRP3 可显著减轻LN 小鼠肾脏损害[62-63]。一项纳入 86 例 LN 患者的研究[64]表明,NLRP3 主要定位于肾小管细胞,且NLRP3 表达水平与系统性红斑狼疮疾病活动指数评分正相关。这些证据表明,NLRP3 炎症小体在人和鼠的多种肾脏细胞中表达并发挥作用。另外,有研究[63]发现,NLRP3 炎症小体在LN 小鼠中诱导的炎症和氧化应激与IL-1β 有关,而与IL-18 无关。
4 在肾脏疾病中靶向NLRP3 炎症小体的药物
目前已有多种针对NLRP3 炎症小体的生物抑制剂(表1),但这些抑制剂对肾脏疾病的有效性和安全性尚未确定。
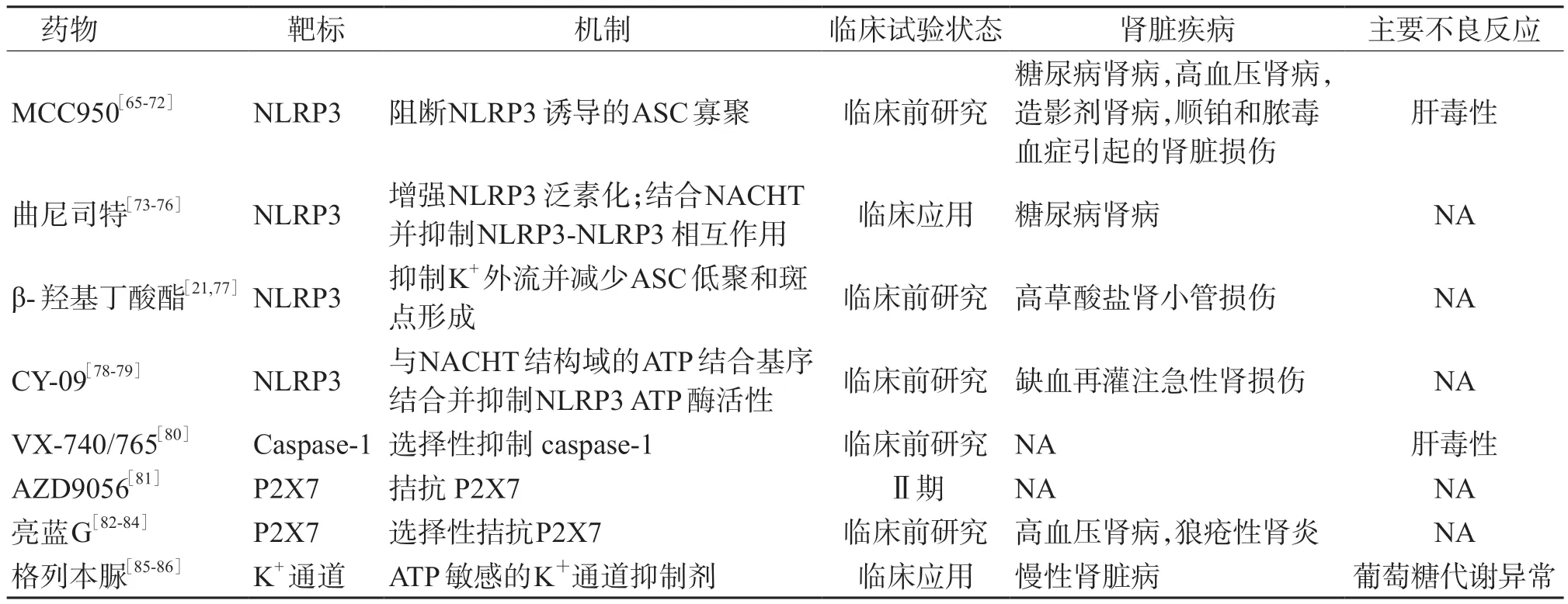
表1 针对NLRP3 炎症小体的药物在肾脏中应用的研究进展
4.1 以NLRP3 为靶标的药物 MCC950 是目前最有效、特异度最高的NLRP3 抑制剂[87]。MCC950是一种二芳基磺酰脲小分子化合物,通过抑制ASC 寡聚反应选择性抑制NLRP3 炎症小体的活性[88]。MCC950 可通过抑制糖尿病肾病模型体内和体外的NLRP3/caspase-1/IL-1β 途径,减轻肾小球基底膜增厚、足细胞损伤和肾脏纤维化程度[65-66]。MCC950 可降低高血压小鼠的血压和尿蛋白水平,减轻肾脏炎症和纤维化[67]。MCC950 通过抑制结晶性肾病中的炎症小体活化以及IL-1β 和IL-18 的产生来改善肾纤维化[68]。MCC950 还可以减轻肥胖相关性肾小球病和狼疮易感模型中的足细胞损伤,以及脓毒症引起的肾脏损伤[69-71]。此外,MCC950 可通过减轻氧化应激和炎症,改善肾小管损伤和肾纤维化来改善顺铂引起的肾功能不全[47]。虽然已有上述研究结果,且MCC950 具有小分子和高特异性的优点,但其应用于治疗肾脏疾病的安全性尚待阐明。有研究[72]显示,由于肝毒性,已停止MCC950 治疗Ⅱ期类风湿性关节炎的临床试验。
曲尼司特是色氨酸代谢产物的类似物,是一种传统的抗过敏药。最近证实曲尼司特能直接作用于NLRP3 抑制其活性[73]。曲尼司特通过增强NLRP3 泛素化,与其NACHT 结构域结合并抑制NLRP3-NLRP3 的直接相互作用,从而中断NLRP3炎症小体的组装和激活[73-74]。曲尼司特可降低氧化应激[89]、抑制肥大细胞浸润[85]、抑制 ECM 沉积[86]、缓解上皮-间质转化[90],减少蛋白尿[91]、减轻肾小管间质纤维化[92],在预防肾脏纤维化进展中起重要作用。曲尼司特还能改善环磷酰胺和环孢素诱导的肾毒性[75-76]。曲尼司特已被批准用于治疗多种炎症性疾病,其耐受性好、不良反应少[73]。尽管曲尼司特尚未被批准用于治疗肾脏疾病,但上述研究显示其已在动物实验中显示出巨大潜力。期望未来研究其在各种肾脏疾病中的效果和安全性。
β-羟基丁酸酯(β-hydroxybutyrate, BHB)是近年来发现的NLRP3 炎症小体抑制剂,可防止K+外流并抑制 ASC 寡聚和斑点形成[77]。研究[21]发现,BHB 能减轻高草酸盐饮食小鼠的肾小管损伤,还可将巨噬细胞表型从促炎表型转变为抗炎表型。这提示BHB 可减轻肾脏炎症,且可能通过抑制NLRP3 炎症小体而成为治疗肾脏相关疾病的潜在药物。
CY-09 是目前发现的NLRP3 炎症小体直接抑制剂。CY-09 通过与NACHT 域的 ATP 结合基序结合,并抑制NLRP3 ATP 酶的活性,从而抑制NLRP3 炎症小体的组装和激活[78]。CY-09 在多种疾病的动物模型中发挥作用,包括肥胖症及其相关的非酒精性脂肪肝[93]、2 型糖尿病[78]和癫痫[94]等,然而其应用于肾脏疾病的报道较少。目前,仅发现CY-09 对I/R 诱发的肾功能不全具有改善作用[79]。
4.2 以 caspase-1 为靶标的药物 VX-740 和VX-765 是抑制caspase-1 的拟肽前药,应用于银屑病、关节炎和癫痫的临床试验已进展到Ⅱ期,但是由于肝毒性而被迫停止[80]。在肾脏疾病中的应用目前还未见相关的临床试验。
4.3 以 P2X7 为靶标的药物 AZD9056 是第 1 个通过临床试验的P2X7 受体拮抗剂,可显著改善Ⅱa 期类风湿关节炎。除AZD9056 外,其他P2X7抑制剂如CE-224535 也已进入临床试验阶段[95],但尚无其应用于肾脏疾病治疗的研究。
亮蓝G(brilliant blue G,BBG)是一种选择性P2X7 受体拮抗剂。实验证明,BBG 可以减轻炎症及纤维化[82-83]。BBG 可减轻Dahl 盐敏感性大鼠和LN 小鼠的肾脏损伤[84]。BBG 能抑制巨噬细胞和成纤维细胞浸润,减少炎症因子和胶原蛋白表达,抑制细胞凋亡,促进肾小管细胞的再生[96]。但是,BBG 应用于肾脏疾病的安全性和临床疗效尚待研究。
4.4 以K+通道为靶标的药物 Lamkanfi 等[97]发现,格列本脲与ATP 敏感的K+通道结合可以抑制NLRP3。作为一种NLRP3 炎症小体抑制剂,格列本脲能抑制腺嘌呤诱发的大鼠CKD 和肾脏纤维化[98]。但是作为降糖药,格列本脲引起的低血糖和葡萄糖代谢紊乱限制了其在其他疾病中的应用[99]。
5 小 结
NLRP3 炎症小体的功能及其在肾脏疾病中的作用取得了较大的研究进展。NLRP3 炎症小体参与多种肾脏疾病的发生发展,但其进一步作用机制及临床应用仍有待研究,且独立于炎症小体的NLRP3 作用的研究仍在起步阶段。深入了解其相关信号传导途径、调节机制和病理学意义有助于肾脏疾病预防和治疗新策略的提出。
与目前使用的较大分子的生物制剂相比,直接靶向NLRP3 炎症小体的小分子抑制剂具有针对性强和成本较低的优势,而且由于药物浓度较小而毒性较小,因此展示出很好的应用前景。部分正在研发的靶向NLRP3 炎症小体及其下游效应因子的药物在治疗其他疾病中取得了可喜的成果,但在肾脏中的研究仍较少。这些药物可能具有治疗AKI 和CKD 的潜在价值。但是将实验数据转化进而应用于临床仍需很长时间,这些药物治疗肾脏疾病的有效性和安全性也有待明确。
利益冲突:所有作者声明不存在利益冲突。

