益生菌发酵藜麦制备ACE抑制肽
李 帅 袁亚宏 岳田利
(西北农林科技大学食品科学与工程学院,陕西 咸阳 712100)
据最新调查结果[1]显示,中国高血压病人约占总人口的23.2%,其中控制率仅有15.3%。预计至2025年,全球高血压人数将涨到16亿左右,而中国将是位居榜首的国家[2]。高血压作为人类的“无声杀手”,常导致心肌梗塞、脑出血等严重危害人类生命的心血管和脑疾病[3]。研究[4]表明,人体血压受到很多系统的调节,其中激肽释放酶—激肽和肾素—血管紧张素系统作为互相拮抗的两个系统发挥着至关重要的作用,二者平衡失调是引起高血压发病的主要因素之一。在该系统中,肝源性血管紧张素原被肾素裂解,形成非活性十肽血管紧张素I,继而被血管紧张素转换酶(ACE)酶解为八肽血管紧张素II(一种有效的血管收缩剂)。此外,ACE代谢九肽的舒缓激肽(bradykinin,BK,一种血管扩张剂),转化为不活跃的BK-(1-7)和BK-(1-5)[5]。因此,由于ACE在血管系统中具有双重直接作用,抑制其已成为治疗高血压的主要靶点。然而ACE抑制剂药物具有高效的降血压作用时,也会产生诸多副作用,甚至药物依赖性[6]。研究[7]表明,很多食物中含有预防或治疗高血压的生物活性肽,具有安全性高、副作用小的特点,逐渐成为降血压药物替代品的首选。迄今为止,乳类[8]、肉类[9]、蛋类[10]、海洋生物[11]、植物[12]均是制备ACE抑制肽的丰富来源。
藜麦(ChenopodiumquinoaWilld.)产于南美洲,其蛋白含量丰富且比例平衡,含有全部天然氨基酸,是联合国粮农组织推荐的唯一全营养食品[13-14]。藜麦作为伪谷物不含麸质,易消化吸收,能避免引起胃肠道的过敏反应[15-16]。且藜麦是一种潜在的生物活性肽制备来源,来自藜麦蛋白的肽已被证明能够发挥一些有益的作用,如Vilcacundo等[17]发现藜麦蛋白消化物中释放的肽在胃十二指肠中抑制DPP-IV、α-淀粉酶和α-葡萄糖苷酶活性,从而表现出有效的体外抗糖尿病特性。并且Vilcacundo等[18]还报告了上述消化物在结肠癌细胞中的抗增殖作用以及抗氧化特性。<5 kDa的肽分离组分表现出更高的抗氧化活性,而含有>5 kDa肽的组分表现出更高的抗增殖活性。此外藜麦水解肽在抗炎、降胆固醇、抗高血压等方面均表现出积极作用[19-20]。尽管如此,关于藜麦ACE抑制活性的研究还较少,且目前多采用酶解方式制备降压肽,微生物发酵应用较少[21]。而利用酶水解时酶的切割位点较为固定,可采用的商业酶种类较少,利用复合酶会提高经济成本且在酶解前需要对样品进行预处理。微生物发酵法逐渐成为一种有效的水解手段,具有简单经济、不会造成必需氨基酸损失的优点,同时可以提高发酵物营养价值和感官属性[22-23]。目前常用的发酵菌株如乳酸菌、芽孢杆菌属、酿酒酵母、汉逊酵母等都是富产蛋白酶的菌种,可以利用自身所产的蛋白酶系酶解底物蛋白,制备具有ACE抑制活性的多肽。
研究拟以藜麦为原料,采用微生物发酵法制备藜麦ACE抑制发酵液,通过比较ACE抑制活性筛选出优势益生菌,并对其制备条件进行优化;同时对发酵液中的肽进行液质鉴定,并对筛选出的肽进行体内试验,以期筛选出有望用于降血压功能食品或者药品研发的高效肽。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
藜麦:繁峙县懿康土特产有限公司;
原发性高血压大鼠(SHR)、Wistar-Kyoto大鼠(WKY):北京维通利华实验动物技术有限公司;
MRS肉汤:北京奥博星生物技术有限责任公司;
来自兔肺(A6778-1UN)的血管紧张素转化酶(ACE)、N-马尿酰-L-组氨酰-L-亮氨酸水合物(HHL):美国Sigma-Aldrich公司;
三氟乙酸:色谱级,上海麦克林生化科技有限公司;
乙腈:色谱级,安徽天地高纯溶剂有限公司;
卡托普利:济南永宁制药股份有限公司;
NIFRPFAPEL、AALEAPRILNL:≥95%,上海三工生物科技有限公司。
1.1.2 主要仪器设备
高速万能粉碎机:FW-400AD型,天津鑫博得仪器有限公司;
恒温摇床培养箱:TS-100B型,上海善志仪器设备有限公司;
立式高压蒸汽灭菌器:LDZX-50L-I型,上海申安医疗器械厂;
高速冷冻离心机:HC-3018R型,安徽中科中佳科学仪器有限公司;
恒温水浴锅:HSQ-1型,上海智城分析仪器有限公司;
高效液相色谱仪:LC-20A型,日本岛津公司;
无创血压计:CODATMMonitor型,美国Kent Scientific公司。
1.1.3 试验菌株
18株乳酸菌(动物双歧杆菌BifidobacteriumanimalisB15、动物双歧杆菌BifidobacteriumanimalisB16、两歧双歧杆菌BifidobacteriumbifidumB17、嗜酸乳杆菌BifidobacteriumbifidumB18、短乳杆菌LactobacillusbrevisL1、副干酪乳杆菌LactobacillusparacaseiL2、鼠李糖乳杆菌LactobacillusrhamnosusL8、类植物乳杆菌LactobacillusparaplantarumsL13、嗜酸乳杆菌LactobacillusacidophilusYTL1、鼠李糖乳杆菌LactobacillusrhamnosusYTL2、短乳杆菌LactobacillusbrevisYTL3、消化乳杆菌DigestionofLactobacillusYTL4、植物乳杆菌LactobacillusparaplantarumsYTL5、植物乳杆菌LactobacillusparaplantarumsYTL6、发酵乳杆菌LactobacillusfermentumYTL7、戊糖乳杆菌LactobacilluspentosusYTL8、副干酪乳杆菌LactobacillusparacaseiYTL9、干酪乳杆菌LactobacilluscaseiYTL10)和12株酵母菌(异常毕赤PichiaanomalaH2、H5、H7、H10,酿酒酵母SaccharomycescerevisiaeHansenWF1、WF17、WF38、WF58、WLS21、PF14、YN6、4#):西北农林科技大学食品科学与工程学院健康食品制造与安全控制研究实验室。
1.2 方法
1.2.1 菌株活化 将保存在-80 ℃,30%甘油中的乳酸菌和酵母按1%的比例分别接种在无菌MRS肉汤和YPD培养基中,使乳酸菌和酵母单独复苏并繁殖,并在37 ℃下培养24 h。每种益生菌进行两次传代培养,得到发酵种子液。
1.2.2 藜麦发酵液的制备 将藜麦种子用粉碎机粉碎,过60目筛,得到藜麦面粉。藜麦面粉在密封容器中于121 ℃干热灭菌15 min[24-25]。向面粉中按10 mL/100 g的接种量加入发酵种子液,将面粉与无菌水以m面粉∶V无菌水为1∶2 (g/mL)的比例混合后,接种乳酸菌的面粉在37 ℃培养箱中固态发酵72 h;酵母在28 ℃培养箱中固态发酵72 h。发酵结束后,将藜麦发酵物在蒸馏水中以m发酵物∶V无菌水为1∶10 (g/mL)的比例稀释,然后在室温[(25±2) ℃]下搅拌1 h。将获得的混合物于4 ℃、5 400 r/min离心10 min,上清液经Whatman定性滤纸过滤,于-20 ℃贮藏供下一步分析[26]。
1.2.3 ACE抑制活性的测定 参考Deng等[6]的方法,修改如下:将50 μL发酵液与30 μL HHL混合预热5 min,添加ACE开始反应。在37 ℃下保持反应30 min,然后添加80 μL 1 mol/L HCl以停止反应。溶液过0.45 μm的滤膜,将10 μL反应溶液注入配备安捷伦TC-C18柱(4.6 mm×250 mm,5 μm)的RP-HPLC中,以测量马尿酸(HA)的浓度。色谱条件:流动相乙腈/超纯水(0.1% TFA)的比例为25/75,等度洗脱,流速为0.5 mL/min,柱温为30 ℃。按式(1)计算ACE抑制活性。
(1)
式中:
R——ACE抑制活性,%;
A——空白对照组测定得到的马尿酸峰面积;
B——添加样品后测定得到的马尿酸峰面积。
在测定条件下抑制50% ACE活性所需的样品浓度定义为IC50。
1.2.4 高ACE抑制菌株的筛选 将18株乳酸菌和12株酵母菌分别发酵藜麦制备降压肽,以无菌接种的面粉为对照组,对得到的发酵液进行ACE抑制活性测定,筛选出具有高抑制活性的乳酸菌或酵母菌株。
1.2.5 单因素试验 选取接种量(5.0%,7.5%,10.0%,12.5%,15.0%)(固定水平为10.0%)、发酵时间(24,48,72,96,120 h)(固定水平为72 h)、发酵温度(31,34,37,40,43 ℃)(固定水平为37 ℃)3个因素的5个水平进行单因素试验,通过对各个条件下制备的藜麦发酵液的ACE抑制率进行测定,选取较优的条件进行正交试验。
1.2.6 正交试验 在单因素试验的基础上,选取3个试验因素中各自较优的3个水平,以ACE抑制率为指标,采用L9(34)正交试验设计,确定最佳发酵工艺。
1.2.7 发酵液中肽的液质鉴定及筛选 使用配备有纳流毛细管液相色谱Easy-nLC 1200的三合一超高分辨组合液质联用仪鉴定ACE发酵液中的肽段。将冻干样品溶解在含有0.1%甲酸的去离子水中,进行纳米液相色谱分离。流动相A为含0.1%甲酸的超纯水,流动相B为含0.1%甲酸的乙腈—超纯水(V乙腈∶V超纯水=4∶1)。梯度洗脱过程:B相在50 min内由4%线性增加到50%,在随后的4 min内B相增加到100%,并保持6 min。洗脱肽的序列鉴定采用MS/MS分析,标准化碰撞能量30%;扫描范围m/z375~1 500。质谱原始文件使用Proteome Discovered 2.2 检索NCBI和BIOPEP藜麦蛋白数据库进行筛选。
1.2.8 体内试验 将24只11周龄雄性SHR,18只WKY在标准条件下适应性喂养7 d。SHR随机分成数量相等的生理盐水组、NIFRPFAPEL组、AALEAPRILNL组和卡托普利组4组。同样的,WKY随机分成数量相等的NIFRPFAPEL、AALEAPRILNL和生理盐水3组。各组均以10 mg/kg·BW的剂量标准灌胃,然后采用CODATM Monitor测定大鼠灌胃0,2,4,6,8 h时尾动脉的收缩压(SBP)和舒张压(DBP),以观察血压变化。根据《实验动物护理和使用指南》(美国国立卫生研究院第85-23号出版物,修订版),所有动物都接受了人道护理。
1.2.9 统计分析 试验中ACE抑制活性的测定均进行3次重复,结果以平均值±标准差表示。通过SPSS 18.0版对数据进行统计分析,并使用软件Origin 2018绘图。使用方差分析(ANOVA)中的Duncan检验来测试平均值之间的差异。
2 结果与分析
2.1 高ACE抑制活性菌株的筛选
由图1可知,作为对照的未经益生菌发酵的藜麦,其ACE抑制率为(52.06±3.60)%,表明藜麦本身就具有较好的ACE抑制活性。其中25株菌固态发酵产生的藜麦发酵液的ACE抑制率较对照组显著提高(P<0.05),抑制效果最好的菌株为LactobacillusparacaseiL2(副干酪乳杆菌),发酵液的ACE抑制率高达(86.50±0.25)%,显著高于除LactobacillusrhamnosusL8(鼠李糖乳杆菌)以外的菌株发酵液的(P<0.05),其次为鼠李糖乳杆菌L8,其ACE抑制率为(85.74±0.62)%。3株菌固态发酵藜麦后的ACE抑制率与对照组无显著差异,分别为酿酒酵母4#、WF38和嗜酸乳杆菌B18,2株菌固态发酵藜麦后的ACE抑制率显著降低(P<0.05),分别为短乳杆菌YTL3和发酵乳杆菌YTL7,表明大多益生菌能够在生长繁殖过程中,利用自身的酶分解藜麦产生具有ACE抑制活性的物质,而少数菌则利用一些ACE抑制活性物质进行生长繁殖,导致发酵液的ACE抑制率下降。藜麦发酵液的ACE抑制活性因菌株的不同而显现出不同的效果。Ayyash等[24-25]利用双歧杆菌、乳酸菌罗伊氏乳杆菌K777和植物乳杆菌K779,对奎奴亚藜采用固态发酵法进行发酵时,也表现出ACE抑制活性增强作用。试验中的副干酪乳杆菌L2的ACE抑制作用高于Ayyash等[24-25]报道的几株菌,表明副干酪乳杆菌L2是一株潜在的利用藜麦蛋白的优势菌株。因此,选取该菌株作为后续研究的目标菌株。

字母不同表示有显著性差异(P<0.05)图1 30株益生菌发酵藜麦制备的发酵液的ACE抑制率Figure 1 ACE inhibition rate of fermentation broth prepared by fermenting quinoa with 30 probiotic strains
2.2 发酵藜麦制备ACE抑制肽的单因素试验
2.2.1 接种量对制备ACE抑制肽的影响 由图2可以看出,藜麦发酵液的ACE抑制率随接种量的变大先增后降,在接种量为7.5%时藜麦发酵液的ACE抑制率最高。这是由于接种量较低时,菌株无法充分分解藜麦,产生的ACE抑制活性物质较少,致使ACE抑制活性较低;而接种量较高时,菌株会利用分解得到的ACE抑制活性物质为其生长繁殖提供营养,从而造成ACE抑制率下降。故将7.5%作为制备降压藜麦发酵液最佳的接种量。
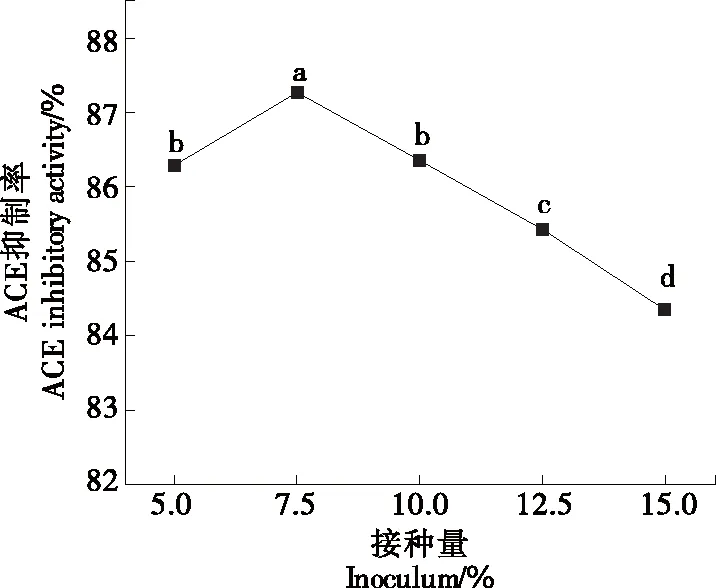
字母不同表示有显著性差异(P<0.05)图2 接种量对制备ACE抑制肽的影响Figure 2 Effects of inoculum on preparation of ACE inhibitory peptides
2.2.2 发酵时间对制备ACE抑制肽的影响 由图3可以看出,藜麦发酵液的ACE抑制率随发酵时间的延长先增长后下降。在发酵72 h时,藜麦发酵液的ACE抑制活性最强。再延长发酵时间,ACE抑制活性不增反降,可能是由于发酵液中的菌株过多,藜麦分解成ACE抑制活性物质的量远远不及其生长和繁殖所需的量,从而导致发酵液中的活性物质含量下降,对ACE的抑制率也随之降低。故将72 h作为菌株发酵藜麦最适发酵时间。
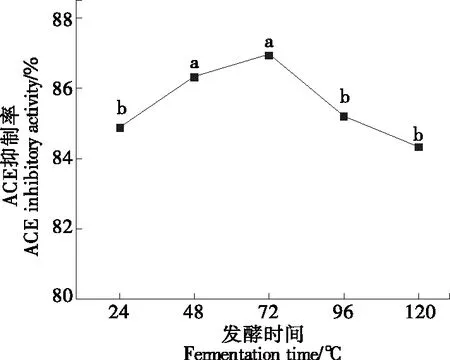
字母不同表示有显著性差异(P<0.05)图3 发酵时间对制备ACE抑制肽的影响Figure 3 Effects of fermentation time on preparation of ACE inhibitory peptides
2.2.3 发酵温度对制备ACE抑制肽的影响 如图4所示,发酵液ACE抑制率随发酵温度的升高先缓慢增加后下降,在34 ℃达到最大。这可能是由于在34 ℃时,该菌株能够适应生长,且是所产蛋白酶的最适酶解温度,随着温度的继续增加,菌株偏离适宜生长温度和蛋白酶最适酶解温度,降压活性物质制备量减少,ACE抑制率下降。故将34 ℃作为制备降压藜麦发酵液的最佳发酵温度。
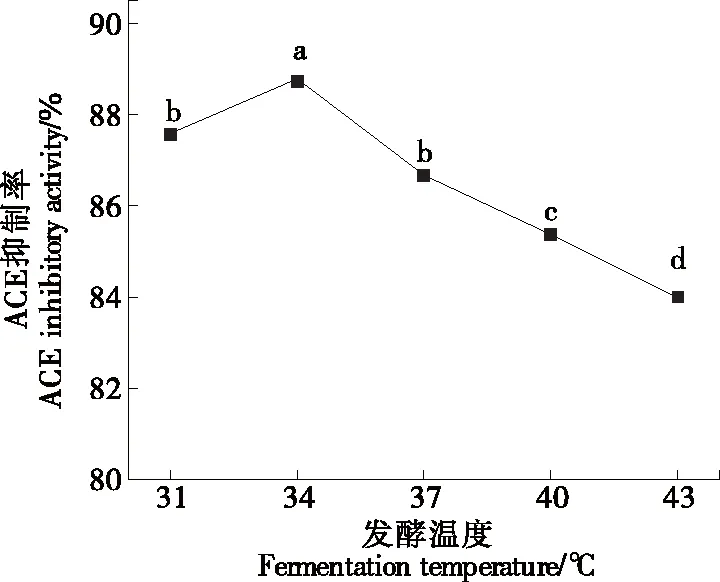
字母不同表示有显著性差异(P<0.05)图4 发酵温度对制备ACE抑制肽的影响Figure 4 Effects of fermentation temperature on preparation of ACE inhibitory peptides
2.3 发酵藜麦制备ACE抑制肽的正交试验
根据单因素试验结果确定正交试验的因素与水平取值见表1,正交试验结果见表2。

表1 藜麦发酵条件正交试验因素及水平Table 1 Orthogonal test factors and levels of quinoa fermentation conditions
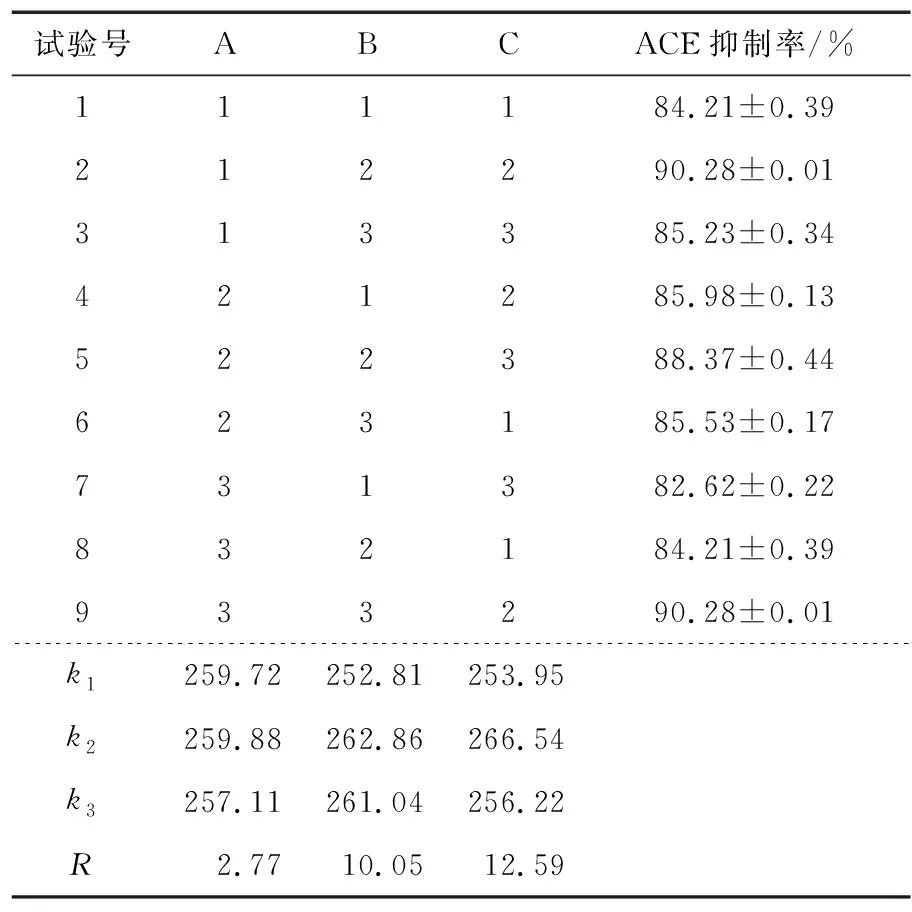
表2 L9(34)正交试验Table 2 L9(34) Orthogonal test
根据表2可知,各因素对藜麦发酵液的ACE抑制率影响大小依次为C>B>A,制备藜麦发酵液的最优组合为C2B2A2。如表3所示,基于藜麦发酵液ACE抑制率建立的模型P值<0.05,表明该模型显著,说明该模型拟合程度较好。根据结果表明,3个因素对藜麦发酵液ACE抑制率均有显著影响。通过各因素水平间的方差分析表明,接种量为5%和7.5%时,ACE抑制率显著高于10%;发酵时间为48 h和72 h时,ACE抑制率显著高于24 h;发酵温度为34 ℃和37 ℃时,ACE抑制率显著高于31 ℃。结合试验结果,C2B2A1和C2B2A2均可作为最优水平组合。

表3 正交试验方差分析表†Table 3 Orthogonal test ANOVA table
通过对两个最优组合的发酵条件进行验证实验,结果发现C2B2A1和C2B2A2的ACE抑制率分别为(90.41±0.16)%,(89.55±0.18)%,故选取C2B2A1作为最优藜麦发酵条件,即接种量为5%,发酵时间为48 h,发酵温度为34 ℃。
2.4 发酵液中肽的液质鉴定及筛选
通过质谱对发酵液鉴定后,得到的肽段较多无法全部合成检验其降压效果。比对BIOPEP数据库筛选出了最具有潜在降压能力的肽段AALEAPRILNL和与文献[27]的NIFRPF有一段相同序列的肽段NIFRPFAPEL进行了合成,通过体外活性测定其IC50值分别为(79.72±0.21),(49.02±0.54) μmol/L,ACE抑制活性较好。两条肽的质谱图见图5。
图5 ACE抑制肽NIFRFAPEL和AALEAPRILNL的MS/MS谱图Figure 5 MS/MS spectrum of ACE inhibitory peptides NIFRPFAPEL and AALEAPRILNL
2.5 体内试验
对NIFRPFAPEL、AALEAPRILNL体内降压效果进行了测定,结果见图6。
由图6(a)和图6(b)可知,灌胃NIFRPFAPEL对SHR有显著的降压效果,0~4 h时,SHR的SBP、DBP均逐渐降低,在4 h时达到最低,分别下降了(2.67±0.21),(3.46±0.01) kPa;4 h后药效减弱,血压逐渐回升,在8 h时基本回升至初始血压,表明NIFRPFAPEL体内降压效果显著。灌胃AALEAPRILNL对SHR的降血压趋势与灌胃NIFRPFAPEL类似,在灌胃4 h时血压下降最多,分别下降了(29.36±0.54),(22.33±0.77) kPa,表明AALEAPRILNL也是一种具有较好的体内降压效果的肽段。
NIFRPFAPEL和AALEAPRILNL均能在体内发挥一定的降压作用,4 h时二者的血压下降至最低,然而二者的降血压效果却有所差异。相同剂量下,AALEAPRILNL的SBP降血压效果比NIFRPFAPEL好,而其DBP降血压效果比NIFRPFAPEL略差。这与两个肽的体外抑制效果表现出了不同的情况,说明肽进入体内还会因其不同生化性质导致效果发生变化,因此进行体内试验是验证其活性大小最有效的方法。在对比8 h时的数据可以看出NIFRPFAPEL和AALEAPRILNL的SBP、DBP血压下降值均回升至初始血压值附近,表明两种肽的降压持久性相似。
在灌胃卡托普利之后,SHR的SBP和DBP均持续降低,在6 h时降到最低,分别降低了44.38,55.69 kPa,在第8 h时SHR的血压有所回升。与之相比,NIFRPFAPEL和AALEAPRILNL能够在短时间内使SHR血压下降到最低值。说明NIFRPFAPEL和AALEAPRILNL具有显著的降压作用,但降压效果和持久性不如卡托普利。
图6(c)和图6(d)分别为灌胃WKY同等剂量的NIFRPFAPEL、AALEAPRILNL和生理盐水8 h内大鼠的SBP和DBP变化情况,经方差分析发现,分别灌胃NIFRPFAPEL和AALEAPRILNL后WKY的SBP和DBP值与0 h WKY的无明显差异(P>0.05),表明NIFRP-FAPEL和AALEAPRILNL对WKY血压无影响。

图6 灌胃各样品后大鼠8 h内的血压变化图Figure 6 Changes of blood pressure in rats within 8 hours after gavage of each sample
3 结论
试验表明,LactobacillusparacaseiL2菌株发酵藜麦制备血管紧张素转换酶抑制发酵液的最佳发酵条件为接种量5%,发酵时间48 h,发酵温度34 ℃,在此条件下血管紧张素转换酶抑制率最高达(90.41±0.16)%。通过液质鉴定和筛选得到的两条抑制效果较好的肽NIFRPFAPEL和AALEAPRILNL,其原发性高血压大鼠体内试验均能够在大鼠体内显现出显著的降血压作用,且均对Wistar-Kyoto大鼠的血压不产生影响。综上,藜麦是一种优良的血管紧张素转换酶抑制发酵液制备来源,能够作为降血压功能食品的原料。根据体内试验推测,NIFRPFAPEL和AALEAPRILNL不会对正常人群的血压造成影响,在降血压功能食品或者药品研发方面有重要的潜力。

