山东石榴品种对枝条干腐病的抗性评价及其病原菌鉴定
丁 宁 于 霞 张 雯 房超琦 王思贤 王治国,*
(1 枣庄市农业科学研究院,山东 枣庄 277100;2 枣庄市山亭区农业技术推广中心,山东 枣庄 277800;3 枣庄市峄城区农业农村综合服务中心,山东 枣庄 277300)
石榴(PunicagranatumL.)为千屈菜科(Lythraceae)石榴属(PunicaL.)落叶果树[1]。石榴果肉中的多酚类化合物在延缓衰老、护肝、消炎、防癌等方面具有较高的药用价值[2-3]。全国石榴种植主要集中在四川会理、山东枣庄等八大产区,枣庄市石榴栽培面积已达1万hm2[4],该地区生产的峄县石榴已成功入选山东省知名农产品区域公用品牌[5],因此针对当地石榴品种的研究具有重要价值。枣庄石榴产区的主栽品种为大青皮、大马牙、岗榴、峄城三白,约占总种植面积的95%[6]。但石榴植株易发生干腐病、软腐病、褐斑病等多种真菌病害[7],对石榴的质量与产量均有严重影响。其中石榴干腐病在山东、云南、四川、安徽、陕西、河南等石榴主产区均有发生,已成为我国石榴产业发展的瓶颈[8]。
石榴干腐病是一类发生在枝干和果实上的系统性真菌病害。石榴干腐病原菌首先侵染石榴枝干,然后蔓延至花萼及果实[9],并持续存在于果实贮藏期,造成石榴减产。目前已报道的石榴果实干腐病防治策略主要为喷施化学药剂,如杨雪等[10]发现,嘧菌酯在水杨肟酸(salicylhydroxamic acid)协同作用下对石榴果实干腐病原菌有很好的抑制作用,且田间防治效果良好;王丽等[11]研究表明戊唑醇和苯醚甲环唑对果实干腐病有较好的田间防治效果,然而病原菌对化学药剂的耐药性问题仍有待解决。石榴抗病品种筛选是一种可以克服耐药问题的有效绿色防控策略,然而目前鲜见山东地区有关抗干腐病石榴种质资源筛选、枝条干腐病原菌鉴定方面的报道。
鉴于此,本研究对山东省主要石榴品种枝条干腐病进行抗性筛选,分离纯化石榴枝条干腐病致病菌,通过形态学、分子生物学鉴定及致病性测定明确病原菌种类,以期为山东系统性防控石榴干腐病及其抗病机理研究提供参考。
1 材料与方法
1.1 试验材料
在山东省枣庄市峄城区冠世榴园中采集具有典型症状特征的1年生大青皮品种病枝,置于自封袋内,带回分离得到病原菌菌株。
马铃薯葡萄糖琼脂(potato dextrose agar, PDA)培养基:马铃薯200 g、葡萄糖20 g、琼脂20 g、蒸馏水定容至1 000 mL。 基础培养基(minimal medium,MM): FeSO41.368 mg、(NH4)2SO40.53 g、葡萄糖1.8 g、NaCl 0.15 g、K2HPO41.74 g、MgSO4·7H2O 0.49 g、CaCl2·2H2O 0.07 g、K2H2PO41.36 g、琼脂20 g、蒸馏水100 mL。
新型植物基因组DNA提取试剂盒,天根生化科技(北京)有限公司;其他试剂均为国产分析纯。CKX53生物显微镜,日本Olympus公司;Mastercycler nexus PCR仪,德国Eppendorf公司。
1.2 试验方法
1.2.1 石榴干腐病原菌的分离与形态学观察 参考文献[12]的组织分离法,首先选取具有典型症状的1年生石榴病枝,剪取病健交界处边长为5 mm的正方形组织小块,75%乙醇消毒20 s,0.1%氯化汞溶液浸泡4~6 min,ddH2O冲洗3次,放置在含有干燥滤纸的培养皿中晾干。然后将组织块置于PDA培养基上,25~28℃条件下培养3~5 d,待长出菌丝后分离纯化,将分离得到的病原菌经单孢转入PDA斜面培养基上,4℃条件下保存。
显微镜下观察分离的病原菌形态特征,分别测量100个分生孢子器、分生孢子梗及分生孢子的大小。
1.2.2 病原菌致病性测定 将分离的病原菌在马铃薯葡萄糖肉汤培养基(potato dextrose broth, PDB)培养基中活化培养,25℃摇床摇菌5 d,制成1×108CFU·mL-1的菌悬液备用。
1.2.2.1 枝条离体接种 选取健康1年生石榴枝条,无菌水冲洗3次后晾干,然后用70%酒精擦洗消毒,置于超净工作台晾干,切成5 cm左右的小段,石蜡封闭枝条切口,用无菌刀片刺伤枝条表面。用无菌注射器吸取1 mL菌悬液滴至伤口处并涂抹均匀,无菌脱脂棉包住伤口,以无菌PDB培养基作为对照。处理组与对照组各接种5个枝条,重复3次,将接种后的枝条置于25℃恒温培养箱,观察记录石榴枝条的发病情况,并从病株上再分离病原菌。
1.2.2.2 离体果实接种 摘取健康石榴果实,无菌水冲洗3次后晾干,然后用70%酒精擦洗消毒,置于超净工作台晾干,用无菌注射针刺伤果实表面,用无菌注射器吸取1 mL菌悬液滴至石榴果实伤口处并涂抹均匀,以接种无菌PDB培养基为对照。每个果实接种2处,处理组与对照组各接种5个石榴果实,重复3次,培养条件同离体枝条接种。观察并记录发病情况,并从病株上再次分离病原菌。
1.2.3 病原菌分子生物学鉴定 首先使用CTAB法提取菌株DNA,分别选用通用引物ITS1(5′-T C C G T A G G T G A A C C T G C G CG-3′)/ITS4(5′-T C C T C C G C T T A T T G A T A T GC-3′)[13]和Bt2a( 5′-G G T A A C C A A A T C G G T G C T G C TT/Bt2b( 5′-A C C C T C A G T G T A G T G A C C C T T G GC)[14]扩增病原菌的rDNA-ITS和β-tubulin基因序列。PCR反应体系25 μL[15]:2×Taq Master Mix 12.5 μL,引物各0.5 μL,模板DNA 1 μL,ddH2O补齐到25 μL。PCR反应程序:95℃预变性3 min;94℃变性30 s,52℃退火30 s,72℃延伸1 min,35个循环;72℃延伸10 min。经1%琼脂糖凝胶电泳检测后回收测序。然后将病原菌β-tubulin和rDNA-ITS联合基因序列在NCBI数据库中与GeneBank已登录的相似序列进行同源性对比,使用MEGA X软件以相邻法构建系统发育树。
1.2.4 不同品种对枝条干腐病的抗性评价
1.2.4.1 田间发病情况调查 2021年10—11月,对种植于山东省枣庄市峄城区石榴资源圃内的20份石榴品种资源进行枝条干腐病抗病性调查并统计病情指数。每个品种随机调查10株,重复3次。每株石榴从东南西北4个方向随机调查共20个枝条。
1.2.4.2 离体抗性筛选 将20个石榴品种枝条分别取样,开展离体抗性筛选,步骤与1.2.2.1枝条离体接种相同。每个品种接种5个枝条,重复3次。将接种枝条置于恒温培养箱中,光周期为16 h光照/8 h黑暗,光照温度设置为23℃,黑暗温度设置为20℃。相对湿度保持在70%~80%。
1.2.4.3 病情统计 参照杨顺超等[16]的病情统计方法,发病程度分级:0级,无症状;1 级,枝条病斑面积占比0~1/3;2级,枝条病斑面积占比1/3~2/3;3级,枝条病斑面积占比2/3~1;4级,枝条整体变黑干枯,然后按照公式计算病情指数:
病情指数=∑(各病级枝条数×该病级值)/(鉴定枝条数×最高病级值)×100%
(1)。
结合调查数据,将石榴枝条干腐病抗病等级标准划分成5个等级:近免疫,病情指数=0;抗病,病情指数为0.1~25.0;中抗,病情指数为25.1~50.0;感病,病情指数为50.1~75.0;高感,病情指数为75.1~100.0。
平均病情指数=(田间发病情况调查病情指数+离体抗性筛选病情指数)/2
(2)。
1.3 数据分析
利用Excel 2016进行试验数据整理和统计分析。
2 结果与分析
2.1 病原菌的分离和代表菌株的形态学特征
近年来,枣庄市石榴果园枝条干腐病发病状况严重(图1-A),石榴干腐病病枝发病初期病斑呈黑色,椭圆形(图1-B),后期整枝干枯死亡,枝条表面有黑色或棕色突起。

注:A:田间症状;B:枝条上的分生孢子器(如箭头所示);C:分生孢子器;D:分生孢子器横切面;E:分生孢子器中的分生孢子梗;F:在PDA培养7 d的病原菌菌落(正面);G:在PDA培养7 d的病原菌菌落(背面);H:分生孢子梗(如箭头所示);I:分生孢子。Note:A: Field symptom. B: Conidiomata on the branch(indicated by the arrow). C: Conidiomata. D: Section view of conidiomata. E: Conidiophores in the conidiomata. F: Colony morphology at the positive for 7 d. G: Colony morphology at the contrary side for 7 d. H: Conidiophores(indicated by the arrow). I: Conidia. 图1 石榴枝条干腐病症状及病原菌形态特征Fig.1 Symptoms of pomegranate branch rot and Morphological characteristics of the pathogen
病原菌在石榴病枝上的分离频率为92.3%。经分离纯化得到形态学特征基本相同的代表菌株zzdn001和zzdn007,并开展形态学鉴定。在PDA培养基上培养7 d后菌丝呈乳白色,边缘规则,气生菌丝发达致密,呈羽毛状(图1-F、G)。20 d后PDA培养基上可见黑色分生孢子器,形态与病斑表面分生孢子器相同,呈黑色乳头状隆起,直径为450~800 μm (图1-B~D)。分生孢子梗无色透明,圆柱形,无隔膜,不分枝,直或稍弯曲,长15~22.5 μm、宽1.9~2.5 μm(图1-E、H)。显微观察可见α型分生孢子,无色单孢,孢子(6.2~8.6) μm×(1.5~2.8) μm,呈长卵圆形(图1-I)。根据杨琴[17]对单间座壳菌(Diaportheeres)的形态学描述,初步鉴定菌株zzdn001和zzdn007为单间座壳菌(Diaportheeres)。
2.2 病原菌致病性测定
病原菌接种后,石榴枝条发病率为93.3%,果实发病率为86.6%。枝条接种组生长9 d后出现干腐病症状,枝条接种部位变为照色并向周围扩展,该症状与枝条干腐病初期症状一致(图2-A~C)。果实接种组5 d后出现干腐病症状,果皮形成黑色病斑(图2-D,E)。室内离体接种发病枝条和果实经分离、纯化获得的分生孢子形态及菌落特征与原接种物完全一致,证实接种菌株为石榴枝条干腐病的致病菌。
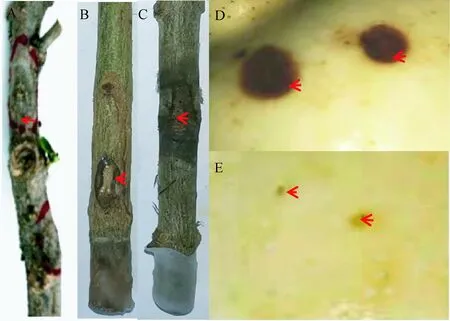
注:A:病枝症状;B:枝条接种组(接种9 d后);C:枝条对照组;D:果实接种组(接种5 d后);E:果实对照组。红色箭头所示为病斑位置或接种位置。Note:A: Symptom of the diseased branch. B:The inoculated group of pomegranate branch 9 d after inoculation. C: The branch of control. D: The inoculated group of fruit 5 d after inoculation. E: The fruit of control. The red arrow indicates the location of the disease spot or inoculation.图2 枝条干腐病的田间症状与致病性测定Fig.2 Symptoms of branch rot in the field and pathogenicity test
2.3 石榴枝条干腐病病原菌分子生物学鉴定
菌株zzdn001和zzdn007的ITS序列大小均为584 bp,分别提交至GenBank(zzdn001 Accession No. MT990517,zzdn007 Accession No. OL587848);β-tubulin基因序列大小为698 bp,分别提交至GenBank(zzdn001 Accession No. OL631611,zzdn007 Accession No. OL631612)。将获得的序列与GeneBank中已登录的不同病原菌的相似序列进行比对,并使用β-tubulin和ITS联合序列建树,结果显示,zzdn001、zzdn007的联合序列与Diaportheeres位于系统发育树的同一分支,支持率为95%。结合致病性测定、形态学特征和分子生物学鉴定结果,可将菌株石榴枝条干腐病病原菌鉴定为单间座壳菌(Diaportheeres)(图3)。
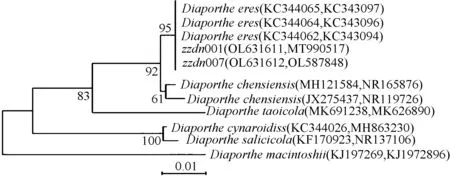
图3 基于β-tubulin和ITS联合基因序列构建菌株zzdn001、zzdn007和其相关菌株的系统进化树Fig.3 Phylogenetic tree of stain zzdn001、zzdn007 and their related strains based on combinedβ-tubulin and ITS gene sequence
2.4 山东省主要石榴品种对枝条干腐病的抗性评价
田间发病情况调查和离体抗性筛选结果显示,17个石榴品种的抗病类型一致,不一致的品种为墨石榴、黑美人和红皮马牙。根据平均病情指数抗性评价如下:白皮酸、碧榴几乎未发病,表现为近免疫,占调查品种的10%;秋艳、岗榴1号、大马牙、峄城三白、冰糖籽、黑美人、大青皮等7个品种病情指数为2.9~18.6,表现为抗病,占调查品种的35%;枣庄玛瑙、墨石榴、九洲红、青皮软籽、枣庄软仁、黄金榴等6个品种病情指数为26.0~42.4,表现中抗,占调查品种的30%;冠榴、谢花甜、红皮马牙等3个品种病情指数为50.7~66.4,表现为感病,占调查品种的15%;大红袍和泰山红等2个品种表现为高感,占调查品种的10%,其中大红袍病情指数最高,为85.2。
3 讨论
石榴枝条病害和果实病害存在一定的关联性。例如,付娟妮等[18]认为陕西地区果实腐烂是由葡萄座腔菌引起,王含等[19]认为葡萄座腔菌(Botryosphaeriadothidea)也是造成陕西地区石榴枝条病害的病原菌,该枝条病害特征与刘会香等[9]总结的疮痂病一致。目前有关果实干腐病病原菌的鉴定研究较多,其中多项研究表明垫壳孢菌(Coniellagranati)可以引起石榴果实干腐病[20-21],而石榴枝条干腐病的病原菌鉴定研究较少。本研究将单间座壳菌(Diaportheeres)确定为石榴枝条干腐病病原菌,对抗病育种和病害防治具有重要意义。
在生产实践中,石榴枝条病害的鉴定还需进一步细分。刘会香等[9]将石榴疮痂病的症状总结为:发生在石榴多年生大枝或主干上,病枝表皮逐渐隆起、翘皮的真菌病害。病原菌葡萄座腔菌(Botryosphaeriadothidea)还可造成苹果轮纹病、桃流胶病、甜樱桃叶斑病等林木病害[22-24]。在病害症状和病原菌等方面,本研究所述的石榴枝条干腐病与石榴疮痂病均有所区别。石榴枝条干腐病主要发生在1年生枝条上,病斑呈黑色椭圆形后期整枝干枯死亡,病原菌单间座壳菌(Diaportheeres)作为植物病原真菌、内生菌或腐生菌在世界范围内广泛分布,通常可以引起植物的根系和果实腐烂、枝干溃疡甚至植株死亡,其中比较典型的是梨树枝枯病[25]和猕猴桃黑斑病[26]。此外,肥水管理不规范可能增加石榴枝条干腐病的发病率。氮元素可以保证细胞壁的厚度、强度以及代谢酶活性,从而抑制病菌的侵染和孢子的萌发[27]。钙元素能够调节物质代谢,影响细胞壁的通透性和酚类物质含量,抑制病原菌菌丝的生长[24]。
抗病品种筛选是防治石榴枝条干腐病的重要措施,我国目前还鲜有针对石榴枝条干腐病抗病品种筛选的系统研究。本研究对20个石榴品种资源进行抗病评价,对石榴抗性育种和种质资源改良具有重要意义。另外,植物组织被病原菌侵染一般会导致被侵染组织过氧化物酶(peroxidase, POD)、过氧化氢酶(catalase, CAT)和超氧化物歧化酶(superoxide dismutase, SOD)等防御酶类大量积累以及光合速率下降[28-30],因此防御酶类和光合作用相关酶的活性测定可以作为不同石榴品种抗性筛选的辅助研究方法。综上所述,本研究还需将抗性筛选与防御酶类和光合作用相关酶的活性测定相结合,以便准确判断不同石榴品种的抗病类型。
4 结论
本研究对山东省枣庄市的20个主要石榴品种进行田间抗性调查,筛选出的抗病品种可作为石榴枝条干腐病抗病机理研究的理想材料。同时采用柯赫氏法则验证致病性、显微形态特征观察及分子生物学分析鉴定单间座壳菌(Diaportheeres)为石榴枝条干腐病病原菌。研究结果为山东石榴干腐病的系统性防控、抗病机理研究提供了理论基础。

