N-糖蛋白去糖基化酶(PNGase)的研究进展*
陈妍雯 袁舒颖 刘瑞杰 张绍兴 邹琳 芦鑫荣 孔维溧 陈力** 孙桂芹**
(1)浙江中医药大学医学技术与信息工程学院,杭州 310053;2)复旦大学基础医学院病原生物学系,医学分子病毒学教育部/卫生健康委员会重点实验室,上海 200032)
N-糖蛋白去糖基化酶(peptide∶N-glycanase,简写为PNGase),又称为N-糖肽酶、N-糖酰胺酶、肽-N-糖苷酶,广泛分布于原核和真核生物中,可以水解多肽上天冬酰胺(Asn)连接的寡糖,并释放出完整寡糖链[1]。不同物种来源的PNGase,基因长度及氨基酸序列不同,生物学功能上也有一定差异性。PNGase参与秀丽线虫的生殖,并与果蝇生长、小鼠胚胎发育有关[2-3]。人体内的PNGase NGLY1(N-glycanase 1)缺陷,会引起罕见遗传性疾病先天性去糖基化障碍,患者出现发育迟缓、运动障碍等症状[4];对出现运动障碍的Ngly1缺陷小鼠模型补充其表达,模型小鼠的运动功能得到一定恢复[5]。NGLY1在人黑色素瘤细胞中高表达,下调黑色素瘤细胞NGLY1,肿瘤细胞生长受到抑制[6]。上述研究结果提示,PNGase可能在生物生长发育过程中有重要意义。本文阐述了PNGase在不同物种中的分布、酶的结构、生物学功能,为PNGase的基础及应用研究提供依据。
1 PNGase的分布
PNGase在真核生物(真菌、线虫、哺乳动物等)和原核生物(细菌)中均有分布,本文对已报道的不同物种来源PNGase进行统计(表1)。
1.1 真核生物的PNGase
PNGase在真核生物广泛存在,包括真菌、植物、线虫、哺乳动物等[7-10]。1977年,Takahashi等[9]在杏仁(Almond)中首次发现PNGase,命名为糖胺酶A,即PNGase A。之后陆续在大豆[11]、水 稻[12]、拟 南 芥[13]和 番 茄[14]等 植 物 中 发 现PNGase。1997年,真菌塔宾曲霉(Aspergillus tubingensis)中 发 现PNGase,命 名 为PNGase At[7]。Suzuki等[15]在酿酒酵母中发现第二个真菌PNGase YPNG1。裂殖酵母中也发现有SpPNGase[16]。
无脊椎动物秀丽隐杆线虫和黑腹果蝇(线虫和果蝇的寿命短、繁殖速度快)中发现的PNGase[17-18],多用于PNGase体内功能研究。1991年Seko等[19]在脊椎动物青鳉鱼(Medaka fish)的卵中发现PNGase。1993年,小鼠体内发现Ngly1、人体内发现NGLY1(N-glycanase 1,又称为Nglycanase,PNGase)[10];后续研究发现人NGLY1的缺陷会导致遗传性疾病NGLY1型先天性去糖基化 障 碍(NGLY1-related congenital disorder of deglycosylation,NGLY1-CDDG)[4]。
1.2 原核生物的PNGase
目前,原核生物的PNGase仅在脑膜炎败血伊丽莎白菌(Elizabethkingia meningoseptica,缩写为EM;又称为脑膜炎脓毒黄杆菌,Flavobacteriummeningosepticum)中发现,共两种PNGase,分别命名为PNGase F和PNGase F-Ⅱ。
1984年,Plummer等[20]在EM中发现了第一个细菌来源的PNGase并命名为PNGase F,PNGase F能完整水解并释放糖蛋白上的N-糖链,但不能作用于含有α-1,3核心岩藻糖基化的N-糖蛋白。2015年,孙桂芹等[3]在EM中发现了第二个细菌来源的PNGase F-Ⅱ,PNGase F-Ⅱ在具有PNGase F功能的同时,还可水解并释放植物和昆虫来源的含有α-1,3核心岩藻糖基化N-糖蛋白的完整糖链。

Table 1 Basic information statistics table of N-glycosidase from different species表1 不同物种PNGase的基本信息统计表
2 PNGase的结构
不同物种PNGase是均具有去糖基化功能的同工酶,其基因序列、酶结构等各有特点。
2.1 不同物种PNGase的同源性
PNGase在不同物种内虽然具有相似功能,但其氨基酸长度和序列有较大差异。根据GeneBank数据库中已发表的PNGase相关氨基酸序列,进行序列比对,本文绘制了部分PNGase的进化树(图1)。由图可知,原核、真核生物PNGase有较大的遗传距离,但在真核生物中有一定的保守性,人与黑猩猩的PNGase同源性最近。
2.2 PNGase的结构
2.2.1 真核来源的PNGase

Fig.1 Phylogenetic tree analysis of PNGase图1 部分PNGase的进化树分析
目前,真菌、植物和动物来源的PNGase分子结构仅有部分得到解析。人NGLY1蛋白含有PUB、PNG Core、PAW 3个保守结构域[24](图2a),其中PUB区域的结构已被解析,该结构域由5个α螺旋和3个反平行的β折叠构成。PUB是蛋白质与蛋白质相互作用的区域;PNG Core是NGLY1催化N-糖蛋白去糖基化的区域;PAW参与NGLY1与寡糖结合[25]。通过AlphaFold2模拟了NGLY1蛋白的三级结构(图2b),根据模拟结果,PUB结构域有一长臂状结构,可能与帮助蛋白质结合相关。酿酒酵母YPNG1分子结构已得到解析,分为两个结构域;小鼠Ngly1仅有PUB结构域得到解析。

Fig.2 Structure of human PNGase图2 人PNGase的结构
2.2.2 原核来源的PNGase
PNGase F的保守结构域包括PNG-N与PNG-C(图3)。PNGase F的活性中心,是两个8字反向β折叠形成的结构域,底物在活性中心内与3个酸性氨基酸结合,结合位点分别为Asp60、Glu118和Glu206。Kuhn等[26]认为Asp60位点起催化作用,Glu118位点主要参与底物的识别与结合,Glu206位点主要稳定底物分子与酶的结合。
PNGase F-Ⅱ的N端为GLPGLi结构、C端为PNG-N和PNG-C结构域(图3),后两个结构域之间由10个氨基酸组成的α螺旋连接。GLPGLi结构域由10个β折叠和两个α螺旋组成,与Glu82和Asp189结合,带正电荷。PNGase F-Ⅱ靠近C端的PNG-N和PNG-C与PNGaseF的相似,但PNGaseF-Ⅱ没有Glu118位点,比PNGase F多了3个与底物识别相关的loop环[3]。
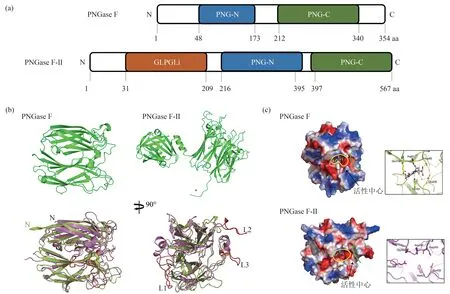
Fig.3 Structure of prokaryotic PNGase[3]图3 原核生物PNGase的结构[3]
3 PNGase的功能研究
3.1 PNGase的酶学功能研究
PNGase能够裂解N-连接糖肽或糖蛋白上天冬酰胺残基与N-乙酰葡糖胺与之间的酰胺键,使天冬酰胺转化为天冬氨酸,生成含有天冬氨酸的多肽链并释放完整的N-糖链[27-28]。根据糖蛋白糖链外层链结构的不同,糖蛋白可分为高甘露糖型(high-mannose,含有多个α-连接的甘露糖残基)、复杂型(hybrid,含有以岩藻糖、半乳糖和唾液糖为组分的糖链残基)与杂合型(complex,兼有高甘露糖型、复杂型特点)。PNGase对复合型、杂合型、高甘露糖型糖链均可切除;能水解的N-糖蛋白或N-糖肽的氨基酸序列为Ser/Thr-X-Asn(Ser:丝氨酸,Thr:苏氨酸,X:除脯氨酸以外的任何氨基酸)[1]。PNGase的酶切位点示意图见图4。
目前平台已承接全国用户规模达10 000个,300家企业及代理商接入系统平台,8个区域数据中心;全国合作运营光纤传输网络范围达到14 000多公里,覆盖全国200多个城市,目前是装备制造业中最大的分布云网络平台综合服务提供商和运营商。

Fig.4 Schematic diagram of the restriction site of PNGase图4 PNGase的酶切位点示意图
Suzuki等[24]报道,人NGLY1的主要作用底物为高甘露糖型N-糖蛋白。原核来源的PNGase F具有广泛的底物特异性,可以酶切RNase B、Ova、IgG等底物,但不能切除带有α-1,3-核心岩藻糖N-糖蛋白上的寡糖链,例如辣根过氧化物酶(HRP,植物来源蛋白)[2];而同为原核来源的PNGase F-Ⅱ,除了具有PNGase F的功能,可水解释放含有α-1,3核心岩藻糖N-糖蛋白的完整糖链[3]。其余物种来源的PNGase具有相似的酶学功能。
3.2 PNGase的生物学功能研究
已有研究显示,PNGase在真核生物中发挥一定的生物学功能,如器官发育、个体生长等[4,29-30]。当人NGLY1缺陷时,会导致先天性去糖基化障碍[4,6]。PNGase在原核生物中的生物学功能尚未明确,本课题组前期实验发现,PNGase F在炎症机体中可能促进细胞因子风暴,从而加重EM感染宿主的炎症反应[31]。
3.2.1 PNGase与人类疾病
人体内蛋白质糖基化修饰作用缺陷,会导致疾病发生,如糖基化障碍(congenital disorder of glycosylation,CDG)。N-糖基化缺陷是CDG糖基化缺陷类型之一,与PNGase缺陷相关[32]。由NGLY1缺陷引起的NGLY1-CDDG,患者出现发育迟缓、智力缺陷、运动功能障碍等临床症状[4]。本课题组于2020年报道了6例中国NGLY1-CDDG患者,并对NGLY1-CDDG的临床及基础研究进行了综述[33-34]。
另外,Zolekar等[6]对人皮肤黑色素瘤细胞进行研究,发现黑色素瘤细胞相比正常黑色素细胞NGLY1高表达;体外敲除黑色素瘤细胞NGLY1基因,黑色素瘤细胞的生长受到抑制、死亡,提示NGLY1与黑色素瘤的高度相关性,抑制NGLY1可能作为新的黑色素瘤治疗策略。
3.2.2 PNGase与鼠模型疾病
Fujihira等[30]敲除C57BL/6品系小鼠的Ngly1基因,观察发现C57BL/6Ngly1+/-缺陷的雌雄小鼠配交后,Ngly1-/-后代在胚胎发育过程出现心室间隔缺损,个体在出生前胚胎全部死亡,但C57BL/6品系小鼠与ICR品系小鼠杂交,Ngly1-/-小鼠胚胎部分死亡,Ngly1-/-小鼠的致死表型可以通过敲除内切N-糖苷酶基因(Engase)得到纠正。
Kong等[35]敲除小鼠胚胎成纤维细胞MEFs的Ngly1,发现Ngly1-/-MEFs线粒体膜电位降低50%,线粒体活性氧负荷上升40%,线粒体呼吸链功能缺陷;回补Ngly1后,线粒体功能恢复正常。Asahina等[5]报道,Ngly1缺陷鼠模型出现运动功能障碍,使用腺相关病毒(AAV-9)与人NGLY1 cDNA重组载体对小鼠进行单次脑室内注射,恢复大脑(神经元)和脊髓中的NGLY1表达,大脑神经元中NGLY1的酶活性增加,模型鼠的运动功能得到一定恢复。上述结果提示,小鼠体内PNGase缺陷可导致部分品系小鼠胚胎致死;PNGase可能与维持线粒体功能和机体运动功能有关;补充NGLY1表达,可能对相关疾病有治疗意义。
3.2.3 PNGase与酵母
PNGase缺陷的酵母突变株,与野生型相比,突变株中错误折叠的突变糖蛋白的降解速率变慢,但png1基因的缺失未影响酵母细胞的生存和生长,与酵母生存无明显关联[17]。Hirsch等[36]报道,酵母YPNG1在体外也可以区分正确与非正确的糖蛋白。上述结果提示,YPNG1可能与酵母细胞内糖蛋白质量控制有关。
3.2.4 PNGase与线虫
秀丽隐杆线虫体内的PNGase PNG-1由png-1基因编码[17]。Habibi-Babadi等[29]研究发现,png-1能够限制神经元和上皮细胞轴突分支,png-1缺陷后其产卵器官发育过程中轴突分支增加,导致其产卵行为下降。Kong等[35]敲除秀丽线虫的png-1基因,发现png-1敲除个体寿命降低为野生型的53%。上述结果提示,PNGase可能参与维持线虫的生殖功能,并延长线虫个体寿命。
3.2.5 PNGase与果蝇
Galeone等[37]研 究 果 蝇PNGase相 关 基 因Pngl,发现其与果蝇骨骼形态生成蛋白(bone morphogenetic protein,BMP)信 号 通 路 有 关,BMP参与果蝇胚胎期消化道形成;当Pngl缺陷,果蝇发育迟缓且幼虫消化道畸形。Owings等[38]干扰果蝇Pngl表达,发现PNGase缺陷个体生长发育迟缓,在部分个体中有致死性;热休克基因表达增加,热冲击作用可延长缺陷个体的寿命,对治疗有一定的参考意义。结果提示PNGase缺陷可能导致果蝇生长发育延迟、器官畸形。
4 展 望
糖组学是继基因组学、蛋白质组学之后的研究热点。糖基化和去糖基化是影响蛋白质结构功能的重要修饰,研究此类修饰需要具有相关酶学功能的工具酶。PNGase酶学功能的研究可以通过质谱、核磁共振波谱等技术开展。PNGase F是目前应用最多的糖生物学分析工具酶,N-糖蛋白经PNGase F水解,获得的寡糖链可通过质谱、毛细管电泳等技术分析鉴定糖链结构及丰度,已在肿瘤、感染性疾病、自身免疫性疾病与糖基化研究中得到应用[39-41]。
PNGase的酶学及生物学功能已有一定的研究,但生物体内的生理病理机制还未明确。研究表明,人NGLY1缺陷可引起罕见遗传性疾病NGLY1-CDDG,临床表现为发育迟缓、智力缺陷、运动障碍等[4],该疾病目前无有效的治疗方法。AAV9-NGLY1 cDNA重组载体,能补充Ngly1缺陷小鼠神经元细胞的NGLY1,使模型小鼠的运动功能障碍恢 复[5],结果提示NGLY1可 能 为NGLY1-CDDG患者治疗的潜在药物靶点,提高NGLY1蛋白表达水平或其酶活性,可能有助于减轻患者症状,针对NGLY1筛选酶激活剂是该类疾病药物的研发目标。NGLY1在黑色素瘤细胞中高表达,降低NGLY1表达水平能抑制黑色素瘤细胞生长[6],为NGLY1酶抑制剂相关药物的研发提供新的思路。另外,NGLY1-CDDG患者成纤维细胞存在线粒体功能损伤,影响能量产生,回补NGLY1表达恢复线粒体功能,NGLY1或能应用于线粒体相关药物的研发。
孙桂芹等[3]发现的PNGase F-Ⅱ能水解植物、昆虫来源带有α-1,3核心岩藻糖的蛋白质寡糖,而植物[42]、昆虫[43]来源的α-1,3核心岩藻糖结构参与人IgE识别花粉、蜂毒等过敏原。李天胜等[44]用核心岩藻糖苷酶(cFase I)处理过敏原,发现过敏病人的血清对处理后过敏原的反应下降。因此,糖苷酶在过敏原的基础与应用研究与中药糖生物学研究等领域有潜在的应用价值。

