石胆酸对小鼠腹腔巨噬细胞内质网应激和凋亡的影响
成乐乐,古丽尼尕尔·吐尔洪江,孟子喧,荐志洁,吴 岳,张 惠*
(1西安交通大学第一附属医院心血管内科,西安 710000;2西安交通大学第一附属医院医学影像科;*通讯作者,E-mail:z632698415h@xjtufh.edu.cn)
胆汁酸的合成涉及位于肝细胞胞浆、内质网、线粒体和过氧化物酶体中的十几种酶,它们将胆固醇转化为初级胆汁酸,初级胆汁酸由肠道微生物的水解酶和异构酶等代谢,生成次级胆汁酸[1-3]。石胆酸(lithocholic acid, LCA)作为次级胆汁酸,是肠道微生物的一种次生代谢产物,可以抑制细胞的生长和增殖,同时对人的神经母细胞瘤、乳腺癌、肝癌和前列腺癌等癌细胞有选择性毒性[4-6]。同时有研究表明,LCA可以诱导人体前列腺癌细胞自噬、内质网应激、线粒体功能障碍和选择性凋亡[5]。内质网是参与真核细胞蛋白质合成、折叠加工和分泌的场所。在机体细胞营养缺乏、钙失衡失调、有害因素等情况下均可破坏内质网的正常功能,引起未折叠蛋白反应(UPR)。持续性的过强的UPR会引起内质网应激,进而引起细胞凋亡过程[7]。
巨噬细胞是组织中具有吞噬功能的一类免疫细胞,参与多种组织病理生理改变过程并发挥重要作用。研究发现内质网应激与巨噬细胞功能、极化以及凋亡的关系密切[8]。目前,有关LCA对小鼠腹腔巨噬细胞影响的相关研究甚少,本研究主要通过细胞培养、蛋白检测等来研究次级胆汁酸LCA对小鼠腹腔巨噬细胞内质网应激及凋亡的影响,为肠道微生物次生代谢产物对巨噬细胞影响提供一定的理论依据。
1 材料与方法
1.1 小鼠腹腔巨噬细胞的分离
于小鼠(7~8周大小C57BL/6J雄鼠,购买于北京维通利华公司)腹腔巨噬细胞提取前3 d,向小鼠腹腔注射浓度为3%的Brewer改良硫乙醇酸淀粉肉汤(1 ml/只)。72 h后,颈椎脱臼法处死小鼠,75%酒精内浸泡5 min,超净台内固定小鼠四肢于解剖板上,消毒腹部皮肤,下腹部剪开皮肤一小口,钝性分离皮层及腹壁肌肉膜。DMEM培养基5 ml注入小鼠腹腔内,迅速拔针轻柔按摩腹部1~2 min,使得培养基充分扩散,用10 ml注射器尽可能多地吸出腹腔内细胞悬液,将含有腹腔巨噬细胞的培养基移入15 ml无菌离心管,1 000 r/min,离心5 min,弃上清,用含10% FBS的DMEM完全培养基重悬细胞沉淀,接种至6孔板。
1.2 主要试剂
DMEM培养基和胎牛血清购自美国Gibco公司;LCA购自美国Sigma-Aldrich公司;Brewer改良硫乙醇酸淀粉肉汤购自美国Becton Dickinson公司;抗半胱氨酸的天冬氨酸蛋白水解酶3(cysteinyl aspartate specific proteinase 3,Caspase-3),抗聚腺苷酸二磷酸核糖基聚合酶(poly ADP-ribose polymerase, PARP),抗C/EBP同源蛋白(C/EBP homologous protein, Chop),磷酸化的抗p38丝裂原活化的蛋白激酶(phospho-p38 mitogen-activated protein kinase,p-p38MAPK)抗体,均购于美国Cell Signalling Technology公司;BCA蛋白浓度测定试剂盒购自美国Thermo Fisher Scientific公司;TUNEL检测试剂盒购自瑞士Roche Life Sciences公司。
1.3 细胞分组及干预
上述原代腹腔巨噬细胞接种于6孔板中,将细胞移入5%CO237 ℃恒温细胞培养箱中培养,贴壁的即为腹腔巨噬细胞,24 h后更换培养基去除未贴壁的其他细胞。饥饿处理细胞16~18 h,实验组给予不同浓度(10,20,30 μmol/L)的LCA干预相同的时间(4 h),或给予相同浓度(30 μmol/L)LCA干预不同时间(1,2,3,4 h),对照组给予相应的LCA的溶剂DMSO干预。
1.4 Western blot实验检测蛋白表达
上述干预后的细胞提取蛋白,使用BCA蛋白浓度测定试剂盒测定蛋白浓度,采用聚丙烯酰胺凝胶电泳分离,每个孔道上相等质量的蛋白样品,将其转移到PVDF膜上,5%脱脂牛奶封闭后,加本实验所检测蛋白(Caspase-3、cleaved-Caspase-3、PARP、cleaved-PARP、Chop、p-p38 MAPK)的一抗(Caspase-3、PARP、Chop、p-p38 MAPK),工作液均按照1 ∶1 000稀释;内参β-actin、Tubulin为1 ∶5 000稀释)孵育、4 ℃过夜,经二抗(1 ∶5 000)孵育并洗涤后用Bio-Rad全自动发光仪进行化学发光法显色。
1.5 TUNEL染色检测细胞凋亡
将腹腔巨噬细胞接种于48孔板中,于5%CO237 ℃恒温细胞培养箱中培养,贴壁后,饥饿处理细胞16~18 h,实验组给予LCA 30 μmol/L干预1 h,对照组给予相应的浓度的DMSO干预。使用In Situ TUNEL Kit试剂盒进行细胞凋亡的检测。根据说明书按比例配置反应混合物,将贴附的细胞与TUNEL反应混合物在37 ℃连续孵育60 min,检测被TUNEL标记为阳性的细胞。使用倒置荧光显微镜于相同的曝光时间设置下获得图像。
1.6 统计学分析
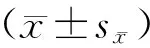
2 结果
2.1 LCA呈浓度和时间依赖性诱导Chop的表达
与对照组相比,实验组巨噬细胞内Chop蛋白的表达量随着LCA干预浓度的增加而增加,差异均具有统计学意义(P<0.05,见图1)。
同样,与对照组相比,实验组巨噬细胞内Chop蛋白的表达量随着LCA处理时间的增加而增加,差异均具有统计学意义(P<0.05,见图1)。

与对照组比较,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1图1 LCA对巨噬细胞Chop蛋白表达的影响 (n=5)Figure 1 Effect of LCA on the expression of Chop protein in macrophages (n=5)
2.2 LCA可诱导p-p38MAPK的表达并呈浓度和时间依赖性
与对照组相比,实验组巨噬细胞内p-p38MAPK蛋白的表达量随着LCA干预浓度的增加而增加,差异均具有统计学意义(P<0.05,见图2)。
另外,与对照组相比,实验组巨噬细胞p-p38MAPK蛋白的表达量随着LCA处理时间的增加而增加,差异均具有统计学意义(P<0.05,见图2)。

与对照组比较,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1图2 LCA对巨噬细胞p-p38 MAPK蛋白表达的影响 (n=5)Figure 2 Effect of LCA on the expression of p-p38 MAPK protein in macrophages (n=5)
2.3 LCA呈浓度和时间依赖性地促进细胞凋亡相关蛋白增加
与对照组相比,实验组巨噬细胞内cleaved-Caspase-3、cleaved-PARP蛋白的表达量随着LCA干预浓度的增加而增加,差异均具有统计学意义(P<0.05,见图3)。
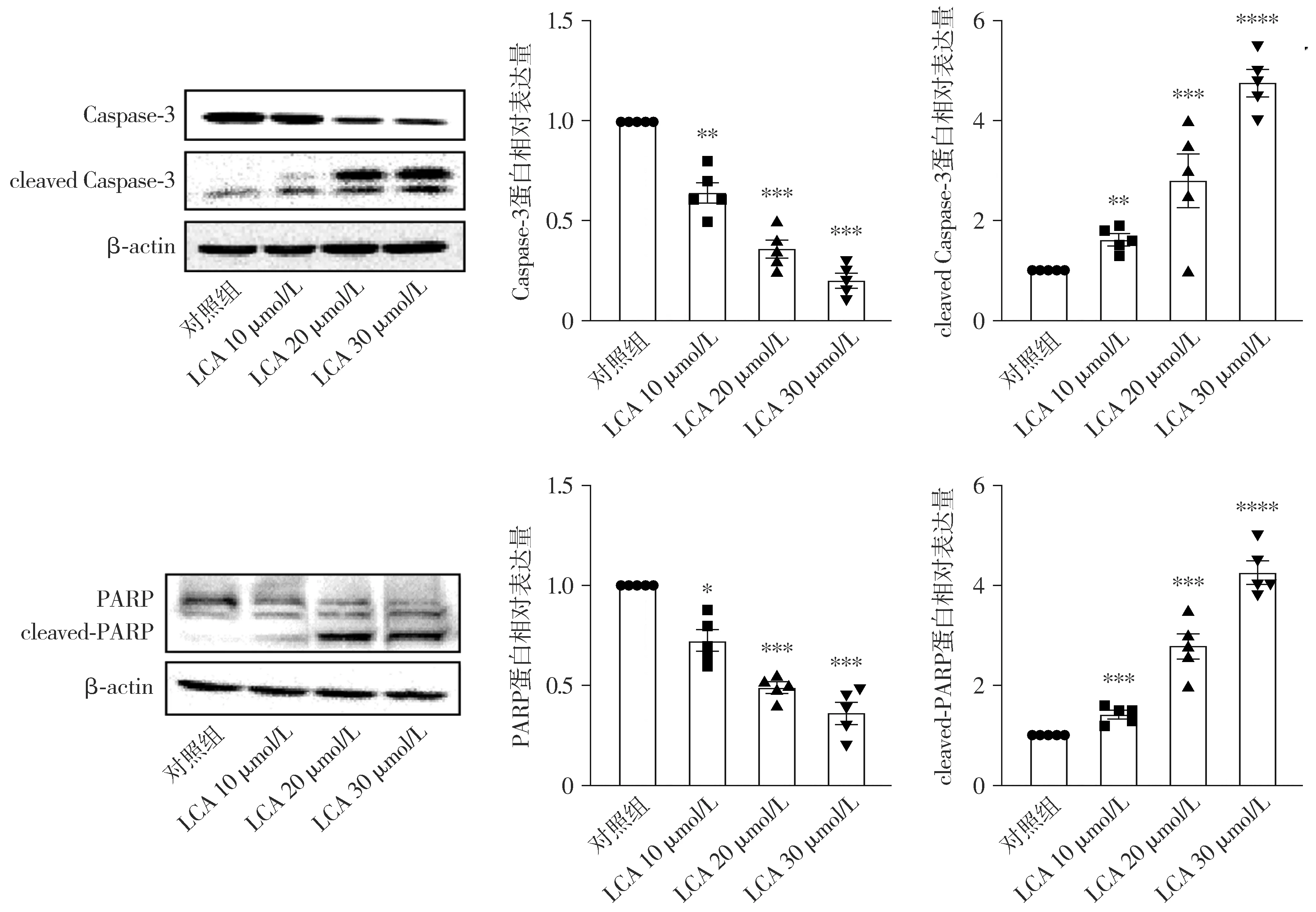
与对照组比较,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1图3 不同浓度LCA对巨噬细胞Caspase-3和PARP蛋白表达及活化的影响 (n=5)Figure 3 Effects of different concentrations of LCA on the expression and activation of Caspase-3 and PARP protein in macrophages (n=5)
另外,与对照组相比,实验组巨噬细胞内cleaved-Caspase-3、cleaved-PARP蛋白的表达量随着LCA处理时间的增加而增加,并与对照组比较差异均具有统计学意义(P<0.05,见图4)。
2.4 LCA诱导巨噬细胞发生凋亡
用TUNEL试剂盒检测LCA对巨噬细胞凋亡的影响,结果显示,与对照组相比,LCA组被TUNEL标记为红色的细胞明显增多(见图5)。
3 讨论
既往研究显示LCA对人神经母细胞瘤、乳腺癌和前列腺癌细胞具有选择性毒性,可抑制细胞的活性与增殖,并诱导前列腺癌细胞的凋亡与坏死[4,5]。LCA可促进前列腺癌细胞、肝癌细胞发生内质网应激,并诱导凋亡相关分子的表达[6]。巨噬细胞分布广泛,是机体免疫系统的重要组成部分,具有多种生理功能,同时参与动脉粥样硬化的发病与发展,在晚期动脉粥样硬化过程中,内质网应激与巨噬细胞凋亡密切相关[9]。然而,目前少有相关研究去探索LCA对小鼠腹腔巨噬细胞内质网应激和凋亡的作用。本研究结果表明LCA能够诱导巨噬细胞发生内质网应激和凋亡及最佳作用时间和浓度点,同时为后续的实验研究提供基础。内质网应激诱导的凋亡与蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase, PERK)信号通路、肌醇需求激酶(inositol-requiring enzyme, IRE)信号通路和Caspase经典通路相关。以上3种途径均可通过增加Chop蛋白的表达促进细胞凋亡,但目前认为PERK通路是增加Chop蛋白的主要途径[10,11]。IRE信号通路则主要通过激活c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)和p38MAPK诱导细胞凋亡,其中磷酸化的p38MAPK也可增加Chop蛋白的表达[12]。Caspase家族在诱导细胞凋亡的分子机制中发挥着重要的作用,其中Caspase-3被认为是关键的蛋白酶,cleaved-Caspase-3是Caspase-3的活化形式,有活性的Caspase-3会裂解PARP(一种DNA修复酶)成为cleaved-PARP,从而诱导凋亡[13]。本实验结果证明LCA增加巨噬细胞Chop、p-p38MAPK和cleaved-Caspase-3、cleaved-PARP蛋白的表达,并呈浓度和时间依赖性,同时增加TUNEL染色阳性的巨噬细胞。因此,通过本研究结果推测LCA可能通过促进磷酸化p38MAPK和Chop蛋白的表达,促进巨噬细胞通过内质网应激途径发生凋亡。其他的研究也已经观察到胆汁酸诱导内质网应激[14]。在HepG2细胞中,次级胆汁酸LCA和脱氧胆酸(deoxycholic acid, DCA)的毒性最大,其次是鹅脱氧胆酸(chenodeoxycholic acid, CDCA),但是它们浓度为100 μmol/L及以上时诱导细胞死亡,其显著高于我们发现的对小鼠腹腔巨噬细胞有毒的LCA浓度[14]。同样的研究人员发现,在暴露于100 μmol/L LCA、DCA或CDCA 24 h后,内质网应激相关基因的表达增加,如葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)和Chop[14]。

与对照组比较,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1图4 不同时间的LCA干预对巨噬细胞Caspase-3和PARP蛋白表达及活化的影响 (n=5)Figure 4 Effects of LCA intervention for different time on the expression and activation of Caspase-3 and PARP protein in macrophages (n=5)
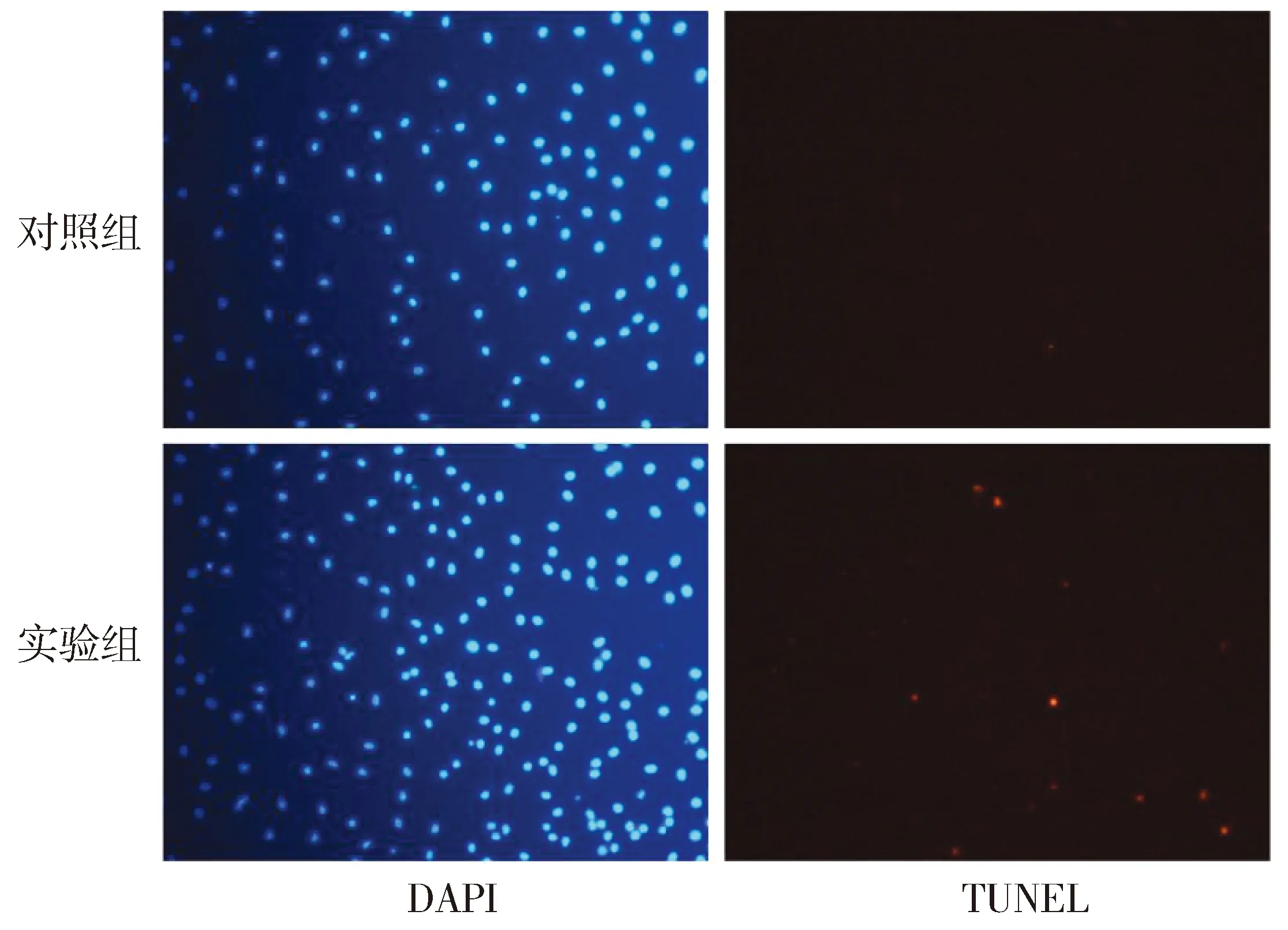
图5 TUNEL染色检测LCA对巨噬细胞凋亡的影响 (×400)Figure 5 Effect of LCA on apoptosis of macrophages by TUNEL staining (×400)
总之,本实验表明了LCA能够通过激活内质网应激和凋亡相关的信号途径,进而诱导巨噬细胞发生内质网应激最终使其发生凋亡。本研究为LCA对巨噬细胞凋亡的影响提供了新的证据支持。

