一株奶牛乳房炎源金黄色葡萄球菌短尾噬菌体的分离及其生物学特性分析
王一帆,吴圆圆,屈勇刚,于会举,梁 晏,吴 勤,肖陈城,安 洋,吴敏瑞,赵崇祺,李 岩
(1.石河子大学动物科技学院,石河子 832003;2.石河子大学分析测试中心,石河子 832003;3.新疆生产建设兵团畜牧兽医工作总站,乌鲁木齐 830063)
近年来,我国奶牛存栏数不断发展,居世界第三位。随着奶牛饲养环境、饲养方式和饲料成分改变,致使奶牛乳房炎(bovine mastitis)发病率日趋增长,高达40%左右[1]。目前,奶牛乳房炎的治疗难度越来越大,病原菌的耐药性日趋严峻。据调查我区奶牛乳房炎的治疗成本逐年增高,奶牛乳房炎已经成为困扰我区奶业经济效益及其发展的主要原因之一。金黄色葡萄球菌(Staphylococcus aureus)是引起奶牛乳房炎最主要的病原菌之一,由其引起的乳房炎占50%以上。据杨峰等[2]报道,世界范围内对金黄色葡萄球菌性奶牛乳房炎的研究热点时期是从1995年到2012年,研究热点大致归类于病原菌的分离鉴定、药物敏感性检测和致病机理的研究。期间该领域的发文量自1995年至2012年急速上升,直到2013年起发文量才有下滑趋势。未来一段时间该领域的主要研究可能是金黄色葡萄球菌生物被膜及其噬菌体的相关研究。目前缺少有效的疫苗用于金黄色葡萄球菌感染引起的乳房炎,且抗生素在治疗金黄色葡萄球菌乳房炎时的治愈率往往低于15%。此外,由于抗生素的滥用、细菌基因突变,以及耐药质粒、转座子或整合子在细菌间的传递使得金黄色葡萄球菌对多种药物产生抗性[3],如青霉素类、头孢类、氨基糖苷类、四环素类、头孢类等,导致病原菌对有效的药物产生了耐药性,给奶牛乳房炎的治疗带来巨大的挑战。张倩等[4]研究发现,致奶牛乳房炎金黄色葡萄球菌对阿莫西林、杆菌肽、复方新诺明的耐药率均在80%以上。
因此,新型药物的研究十分迫切,采用噬菌体及其制剂防治奶牛乳房炎,无残留、副作用小,且不影响牛乳品质,相关研究在国外已经倍受青睐[5-8]。国内的杨毓[9]在应用噬菌体治疗金黄色葡萄球菌感染的奶牛乳房炎;吉林大学韩文瑜课题组应用噬菌体与其裂解酶来治疗奶牛乳房炎[10-11],乳腺内的菌含量得到了显著下降,均取得了良好的治疗效果。本研究以奶牛乳房炎金黄色葡萄球菌为宿主菌,分离筛选出1株裂解性短尾噬菌体,并初步分析了其生物学特性,为其在奶牛乳房炎的防治及其制剂的研发应用奠定了基础。
1 材料与方法
1.1 样品采集 采集石河子周边地区奶牛场挤奶厅污水和粪尿混合样品,共8份,将其作为分离噬菌体的来源。
1.2 菌株来源 11株金黄色葡萄球菌(编号为1-11)均为石河子大学动物科技学院传染病实验室分离鉴定并于-20℃下所保存的奶牛乳房炎源菌株。
1.3 宿主菌的准备 将11株金黄色葡萄球菌分别接种到装有LB液体培养基的锥形瓶中,于37℃、160 rpm摇床中进行过夜培养。
1.4 噬菌体的富集 将采集的污水和粪尿混合样品充分搅拌均匀后,用8层纱布过滤后再用2层滤纸过滤,用0.22 μm微孔滤膜过滤除菌,最终得到混合物液体1 L。将滤液接种到LB液体培养基里面,加入11株金黄色葡萄球菌的菌悬液各1 mL,于37℃、160 rpm摇床中培养5 h,放置4℃冰箱保存备用。
1.5 噬菌体的分离和筛选 将放置于-4℃冰箱保存的噬菌体原液在1000×g下离心10 min,取100 μL上清液分别加入到11支试管中,在每个试管中分别加入11株金黄色葡萄球菌的菌悬液各100 μL,充分混匀后静置15 min,使噬菌体和宿主菌充分吸附。采用双层琼脂平板法进行过夜培养,观察平板生长情况。先选取出现噬菌斑所对应的宿主菌接种到5 mL的LB液体培养基中,于37℃、160 rpm摇床中培养8 h,后在噬菌斑出现的的平板中挑取1个边缘整齐光滑、形状较大、色泽较为透亮的噬菌斑接种到相应的宿主菌培养液中,恒温摇床中培养3 h后,取10倍倍比稀释的上清液稀释液与宿主菌混匀吸附后,采用双层琼脂平板法培养,重复3次以上,直至在同一个平板内的噬菌斑形态大小基本一致,即能得到纯的噬菌体。
1.6 噬菌体的电镜观察 参考文献[12],应用PEG沉淀法进行噬菌体颗粒的浓缩,取噬菌体浓缩悬液20 μL滴在铜网上,让其作用15 min,然后用滤纸吸去多余的液体,选用2%磷钨酸染液染色10 min,干燥后电镜下观察噬菌体形态。
1.7 噬菌体的基因型鉴定 使用病毒基因DNA/RNA提取试剂盒提取噬菌体的基因组,将提取的噬菌体核酸分别用DNase I、RNase A和Mung Bean Nuclease于37℃水浴中,酶解2 h后,用0.8%的琼脂糖进行琼脂糖凝胶电泳分析。
1.8 噬菌体的生物学特性
1.8.1 噬菌斑大小 采用双层琼脂平板法观察噬菌斑形态特征并测量噬菌斑的直径。
1.8.2 效价测定 将纯化后的单个噬菌斑与100 μL对数期宿主菌悬液,震荡培养液体至澄清时,取上清液作10倍连续稀释后,分别在噬菌体每个稀释度中取100 μL,加入到100 μL相应宿主菌增菌液中,然后采用双层琼脂平板培养,计算形成噬斑的个数。每组重复3次,最后在计算效价时取其平均值。在计算的时候,选取30~300个噬菌斑的平板计算每毫升未稀释的原液的噬菌体数(噬菌体效价)。噬菌体的滴度(PFU/mL)=密度适当的平板上噬斑数的平均数×稀释倍数×10。
1.8.3 最佳感染复数(multiplicity of infection, MOI)测定 在宿主菌数量体积不变的条件下,按照不同的 MOI(100、10、1、0.1、0.01、0.001、0.0001)加入相应数量体积的噬菌体液,加入液体培养基调整每管总体积使其相同,于37℃条件下、160 rpm摇床中培养3 h,后采用双层琼脂平板法测其每个MOI的效价,最佳感染复数即为产生最高噬菌体效价的MOI。
1.8.4 噬菌谱 将100 μL噬菌体液分别与100 μL的12株大肠杆菌、11株金黄色葡萄球菌混合吸附,测定噬菌体对菌株的裂解能力。
1.8.5 热稳定性 将已知滴度的噬菌体液等体积分装若干,分别至40℃、45℃、50℃、55℃和60℃的恒温水浴中,每间隔10 min取样一次,取6次,用双层琼脂平板法测定存活的噬菌体的数量,重复3次。观察噬菌体生长情况,制作噬菌体热稳性曲线。
1.8.6 pH稳定性 分别取不同(pH2.0~12.0)的液体培养基37℃水浴,待温度平衡后加入已知等体积噬菌体液,经1 h处理后,再用双层琼脂平板法进行计数。制作pH稳定性曲线。
1.8.7 一步生长曲线 将对数期生长的金黄色葡萄球菌与噬菌体按照最佳感染复数MOI=0.001比例混合、吸附,于37℃、160 rpm摇床中培养,分别在第5、10、15、20、25、30、40、50、60、70、80、90、110、130、150、170、190、210 min取样(3个平行样品),测定噬菌体滴度,并取平均值,绘制噬菌体的一步生长曲线。
2 结果
2.1 噬菌体的分离、纯化 通过污水和粪尿混合样品浓缩和噬菌体富集处理后,分离到1株裂解性金黄色葡萄球菌噬菌体,通过双层琼脂平板法对其进行3次以上纯化,得到噬菌斑边缘整齐光滑、大小均一、形态一致、色泽较为透亮的纯化噬菌体(图1),将其命名为P42。

图1 噬菌体P42的噬菌斑形态Fig.1 The plaque of phage P42
2.2 噬菌体P42的电镜观察 纯化后的噬菌体浓缩液经负染后,在透射电子显微镜下观察其形态,如图2所示,噬菌体P42头部呈廿面体的立体对称,头部长约42.67 nm,尾长约16.67 nm。根据2011年国际病毒分类委员会第9次报告提出的噬菌体分类与命名标准,该噬菌体符合有尾噬菌体目(Caudovirales),短尾噬菌体科(Podoviridae)的特征。

图2 噬菌体P42的电镜照片Fig.2 Electron microgragh of phage P42
2.3 噬菌体P42的核酸鉴定 噬菌体P42的基因经DNase I、RNase A和Mung Bean Nuclease消化处理后,对其产物进行琼脂糖凝胶电泳分析,由图3可知,DNase I可消化噬菌体的遗传物质,而RNase A和Mung Bean Nuclease不能将其消化,可以判定噬菌体P42的遗传物质为dsDNA。

图3 噬菌体P42的核酸类型Fig.3 Nucleic acid type of phage P42
2.4 噬菌体P42的生物学特性
2.4.1 噬菌体P42的效价测定 将纯化后的噬菌体作10倍连续稀释后,通过双层琼脂平板法,计算噬菌斑的个数,经过多次平行重复试验后,可得出本试验分离纯化的P42效价为3.01×109PFU/mL。
2.4.2 噬菌体P42的最佳MOI测定 当MOI=0.001时,噬菌体P42感染宿主菌释放的子代噬菌体的数量最多,因此,确定其最佳感染复数为0.001。测定结果见图4。

图4 噬菌体P42的最佳MOI测定Fig.4 Determination of optimal multiplicity of infection for phage P42
2.4.3 噬菌体P42裂解谱的测定 裂解谱的测定结果见表1。由表1可知,此噬菌体目前只能裂解其宿主菌,而对其他10株大肠杆菌型菌株、10株金黄色葡萄球菌均无裂解能力。
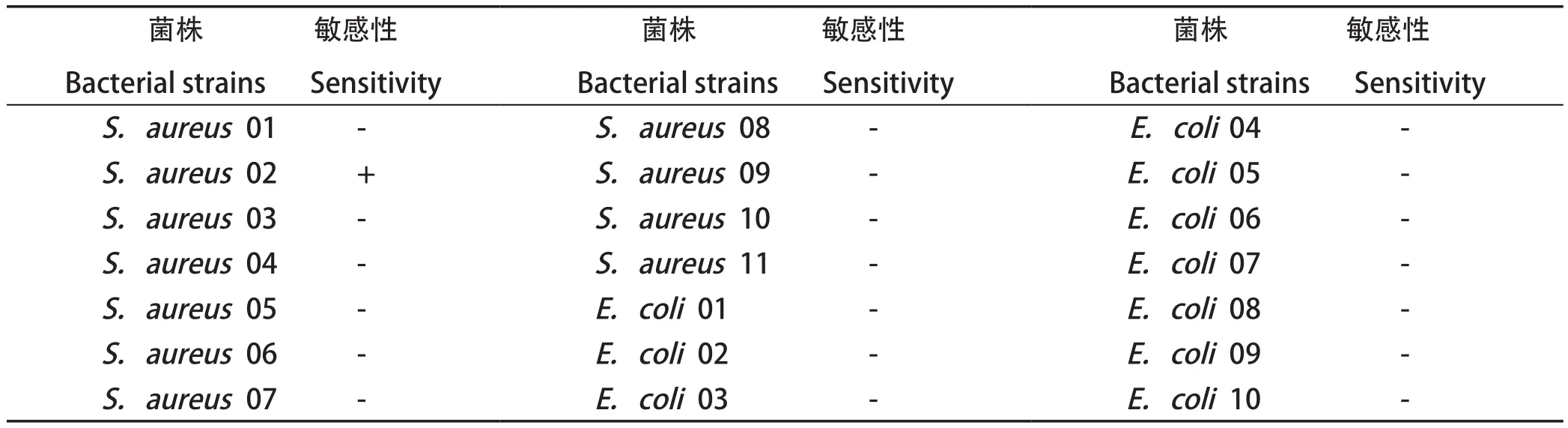
表1 噬菌体P42对21株临床分离株裂解情况Table 1 The host range of phage p42 to 21 strains of clinical isolates
2.4.4 噬菌体P42的热稳定性测定 通过测定噬菌P42对温度的耐受,可看出其在45℃时,活性基本不受影响。当温度高于50℃时,滴度开始下降但不明显;当温度高于55℃时,滴度明显下降;当温度高于60℃时,噬菌体P42失去活性,结果见图5。
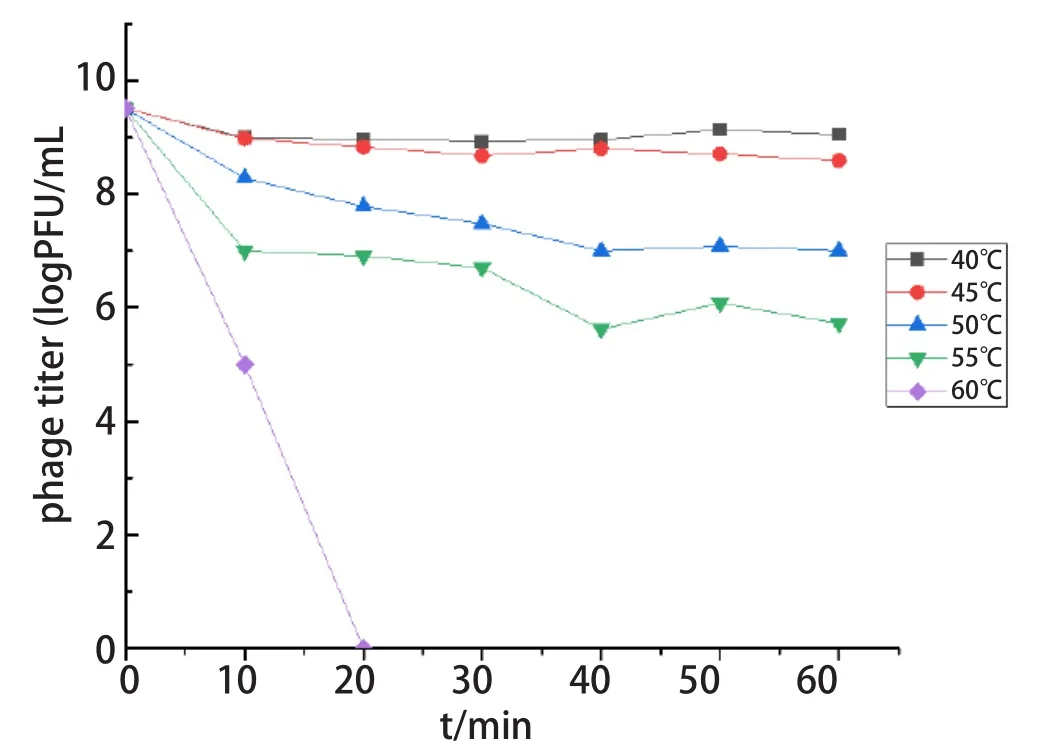
图5 噬菌体P42的热稳定性测定Fig.5 Determination of thermal stability of phage P42
2.4.5 噬菌体P42的pH稳定性测定 测定结果如图6所示。噬菌体P42的pH耐受范围为4.0~9.0,且当pH为7.0时噬菌体活性最好。当pH在2.0和12.0时噬菌体失去活性,表明其不耐强酸强碱。

图6 噬菌体P42的pH稳定性测定Fig.6 Determination of pH stability of phage P42
2.4.6 噬菌体P42的一步生长曲线测定 依照实验数据绘制噬菌体P42的一步生长曲线,如图7所示。噬菌体P42的潜伏期为10 min,这段时间噬菌体的量基本没有增加;暴发期为140 min,在感染后10~150 min噬菌体的量大幅度增加,随后进入平稳期。其裂解量约为126 PFU/cell,说明噬菌体P42有很强的裂解活性,可为奶牛乳房炎的噬菌体生物制剂研发提供材料。

图7 噬菌体P42的一步生长曲线Fig.7 One step growth curve of phage P42
3 讨论
本研究分离到的噬菌体P42是一株短尾科的裂解性金黄色葡萄球菌噬菌体,目前只能裂解其宿主菌,其效价为3.01×109PFU/mL,最佳MOI=0.001,在pH4.0~9.0时,P42的活性没有明显的变化,繁殖迅速,感染宿主菌的潜伏期是10 min,暴发期是140 min,裂解量约为126 PFU/cell。
本试验采用双层琼脂平板方法进行噬菌体P42的分离、纯化与计数。根据《国际病毒分类委员会第9次报告》将噬菌体P42归类为最常见的dsDNA病毒群的成员,且通过电镜观察得知该噬菌体属有尾噬菌体目短尾噬菌体科的一员。目前在研究噬菌体的裂解谱当中,发现噬菌体P42只裂解其宿主菌,对本试验的10株大肠杆菌型菌株及10株金黄色葡萄球菌均无裂解能力。在目前研究中虽然其宿主谱较窄,但其宿主菌在新疆患有乳房炎奶牛样本中较为常见,分布范围较广。对于该株噬菌体的全基因组分析以及其是否能裂解其他菌属需要在后期的试验中进行验证。
通过对噬菌体P42与其宿主菌之间MOI的测定知该噬菌体的最佳MOI=0.001,与范锦戴等[13-14]分离的葡萄球菌噬菌体相比,噬菌体P42对其宿主菌的感染率高。通过研究该噬菌体的一步生长曲线得知,该噬菌体比王倩等[15]和鞠磊等[16]分离报道的噬菌体有着短潜伏期、长暴发期及高裂解量的优点。该噬菌体与汤婷婷等[17]分离到的短尾科裂解性金黄色葡萄球菌噬菌体相比,耐碱能力弱。噬菌体P42是裂解性金黄色葡萄球菌噬菌体中少见的短尾科噬菌体,为建立奶牛乳房炎用噬菌体库奠定基础,很有可能为金黄色葡萄球菌性奶牛乳房炎的防治和治疗提供一种新的途径,本研究为其在临床上的应用及后续的研究奠定了基础。

