结核分枝杆菌PE_PGRS家族蛋白研究进展
尚庆煜,孙慧琳,梁露静,鞠晓红
(吉林医药学院,吉林 132013)
MTB是一类引起人兽共患慢性消耗性传染病-结核病的病原体,严重威胁人类健康,引起人类结核病的主要有人结核分枝杆菌和牛结核分枝杆菌,据报道约10%的人类结核病由牛分枝杆菌引起[1-2]。1998年,英国Sanger中心和法国Pasteur研究所联合完成了结核分枝杆菌H37Rv菌株全基因组测序,开启了MTB的基因组学研究历程,从而发现了一大类富含甘氨酸、N端有保守脯氨酸-谷氨酸序列(Proline-Glutamate, PE)的蛋白家族,命名为PE家族,约占全部基因组编码基因的6%[3]。PE家族又根据编码蛋白质C端含有串联重复序列的不同,进一步分为单独PE(PE_only)和PE_PGRS两个相近亚家族。PE_PGRS家族因C端编码基因富含鸟嘌呤-胞嘧啶基序(polymorphic guanine-cytosine rich sequences,PGRS)而得名,是MTB独有的多基因亚家族,只存在于分枝杆菌属,且绝大多数仅存在于致病性分枝杆菌中,与分枝杆菌的致病性与毒力密切相关。因此,近年来成为世界范围的研究热点之一,作为开发药物、研制疫苗和诊断试剂的特异性靶点[4-5],在结核病的预防、治疗和检测领域具有广阔的发展前景,极具研究价值。故本文对PE_PGRS家族蛋白的组成、结构、表达及功能进行简要综述,为PE_PGRS蛋白的研究应用提供参考。
1 PE_PGRS家族成员
PE_PGRS家族蛋白为一组酸性蛋白,长度约104~1901个氨基酸,主要定位于细胞壁和细胞膜上,构成MTB的表面抗原成分,参与免疫逃逸和抗原变异,对MTB胞内存活极其重要;部分成员也可以以胞外囊泡的形式释放到细胞外环境发挥作用。目前,已命名的PE_PGRS家族成员有63个,分别称为PE_PGRS1-PE_PGRS63,研究中也经常使用其在H37Rv菌株基因组中的基因序号代替PE_PGRS名称,如Rv1818c即指PE_PGRS33。其中,PE_PGRS12只有137个氨基酸,发生移码突变后与PE_PGRS13的749个氨基酸发生融合。二者具体对应关系见表1[6]。
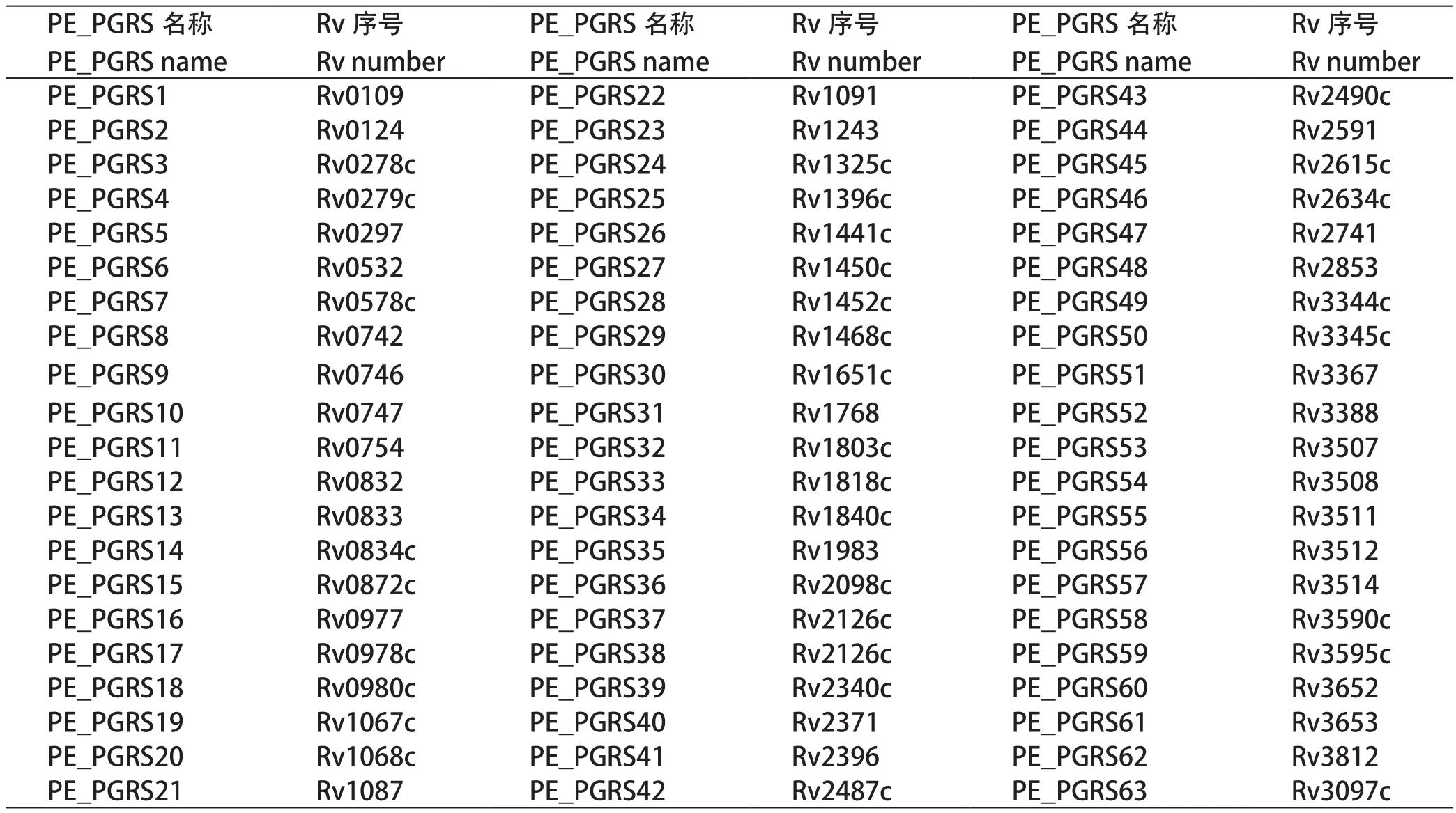
表1 结核分枝杆菌PE_PGRS家族成员及基因定位Table 1 member and gene of PE_PGRS in Mycobacterium tuberculosis
2 PE_PGRS家族蛋白结构
PE_PGRS家族蛋白主要包括高度保守的PE结构域和极富多态性的PGRS结构域,在两个结构域之间有一个短的、由几十个氨基酸组成的连接区,可能与蛋白质在细胞壁上的锚定作用有关。有的家族成员在PGRS结构域之后的C末端还有一个独特结构域(unique domain),其大小可从几个氨基酸到300多个氨基酸数量不等,功能各异。PE_PGRS33蛋白的C末端有血凝素活性,PE_PGRS16和PE_PGRS35蛋白C末端有两个胃蛋白酶特征性基序DTG和DSG,可能是天冬氨酸蛋白酶结构域,称为Mtb-AP[7]。进一步研究发现,所有包含这一结构域的蛋白均属于PE蛋白家族,正常状态下以无活性形式存在,推测可能与PE_PGRS蛋白引发的免疫保护作用有关。家族成员中PE_PGRS62和PE_PGRS63较为特殊,缺乏PGRS结构域,PE_PGRS62 C末端是一段独特的结构域,PE_PGRS63 PE结构域之后序列是脂肪酶活性编码区。
2.1 PE结构域 PE结构域位于N端,长度相对稳定,约含110个氨基酸残基,高度保守,具有特征性脯氨酸-谷氨酸序列,主要负责蛋白的转运和定位,同时也是人类T细胞识别的主要抗原表位。完全缺失PE结构域和丢失N端最前面30个氨基酸的PE_PGRS33蛋白不能转位到细胞表面,只能在细菌的细胞质中找到,蛋白功能丧失;在两个相当保守区域的单个氨基酸替换对蛋白质稳定性有一定影响,但不影响其细胞定位,说明决定胞内合成PE-PGRS蛋白转位的关键序列存在于PE结构域前30个氨基酸中[8]。然而,在完全缺失PGRS结构域的情况下,不同分枝杆菌PE结构域的存在方式发生改变,基因重组耻垢分枝杆菌、MTB和牛分枝杆菌卡介苗(Bacillus Calmette-Guérin, BCG)的PE结构域仍定位于细胞壁,而海分枝杆菌则通过ESX5被分泌到培养基上清液中,说明PE结构域的定位作用需要PGRS结构域辅助完成。
PE_PGRS家族所有成员在PE结构域均含有一个保守的四肽基序DEVS或DXXS(X为任意氨基酸),除PE_PGRS63外,其他蛋白四肽基序均位于N端43-46氨基酸,PE_PGRS63位于N端第17个氨基酸处。其中51个家族成员的核心四肽基序是DEVS,与caspase-3识别基序DEVD/E高度相似,丝氨酸残基磷酸化后可竞争性与caspase-3蛋白结合,抑制宿主启动程序化死亡程序,可能是MTB进化出的又一种生存机制[9]。
2.2 PGRS结构域 PGRS结构域位于PE结构域之后,长度不定(十几个到几百个氨基酸不等),极富多态性并有极强的免疫原性,是与宿主细胞成分相互作用的暴露区域,也是表达B细胞表位的主要区域。PE_PGRS33的PGRS结构域是小鼠和人体体液免疫反应的靶点,PE_PGRS33抗血清能抑制MTB进入巨噬细胞,在体外能中和PE_PGRS33的促炎活性,可作为抗结核治疗的抗原靶位[10]。此外,该结构域还有许多个性化序列,赋予不同家族成员独特性功能。如PE_PGRS5,在该结构域存在内质网定位序列,有助于MTB定位于内质网中,功能发挥主要依赖于TLR4[11];PE_PGRS33依赖该区域定位于宿主细胞线粒体膜,导致细胞死亡,功能发挥主要依赖于TLR2[12]。
富含大量甘氨酸和丙氨酸重复序列是PGRS结构域的特征性标志,通常以Gly-Gly-Ala或Gly-Gly-X(X为任意氨基酸)形式存在,甘氨酸约占氨基酸总量的50%以上,该重复序列在除PE_PGRS63外的成员中至少出现30次。其中,富含甘氨酸的GGXGXD/NXUX(U指非极性或疏水性大残基)非肽序列(nonapeptide sequence)形成一个连接钙的平行β滚筒或平行β螺旋结构,呈典型的钙连接蛋白(calcium binding proteins)特征,MTB和宿主细胞间存在由PE_PGRS介导的依赖于Ca2+的相互作用,通过Ca2+与PE_PGRS蛋白结合,导致巨噬细胞中Ca2+浓度显著下降,抑制吞噬溶酶体的成熟,帮助MTB达到持续感染的目的[13-14]。家族中PE_PGRS8、PE_PGRS12、PE_PGRS17、PE_PGRS60和PE_PGRS62 5个成员该结构缺失,不能与Ca2+结合。
3 PE_PGRS家族编码基因
PE_PGRS家族起源目前还不清楚,可能是细菌在长期进化过程中为适应环境发生基因重组与基因突变双重作用的阳性选择结果,不同选择压力对个体pe_pgrs基因作用不同,最终导致家族成员功能和表达各异[15]。也有人认为可能与新近发现的Ⅶ型分泌系统ESX(early secretory antigenic system)编码基因有关。MTB ESX分泌系统包括5个基因簇,Akhter等[16]认为pe基因可能起源于esx祖先基因区复制一系列esx基因簇的过程。系统发育重建表明,esx基因簇通过多基因复制扩展的同时伴随着PE家族基因的扩展。因而,PE_PGRS家族蛋白可能是ESX5分泌系统特异性底物,合成的蛋白通过ESX5分泌系统转运到细胞膜上,目前已在多个PE_PGRS蛋白的转运中得到证实。pgrs基因散布于致病性MTB整个基因组中,大多数不与其他基因共同转录,由一组异质的转录调控因子控制。
PGRS结构域的编码基因极具多态性,也被称为多态性序列,富含源自9 bp重复序列CGGCGGCAA串联而成的鸟嘌呤(G)-胞嘧啶(C)基序,是一个不完善的短的重复序列,随机聚集于MTB复合群染色体的多个区域,但在染色体中相当稳定,现已作为DNA指纹图谱的遗传标志,用于MTB菌株分型。
比较实验室菌株H37Rv与临床菌株CDC1551pe_pgrs基因序列结果显示[17],pe基因完全相同,最易发生变异的是pgrs基因区的重复序列,以插入和缺失为主,编码产物表现为蛋白缺失或大小差异,甘氨酸和丙氨酸重复序列编码基因的缺失或插入是导致变异的主要原因,推测pgrs的多态性是细菌逃避宿主免疫反应的主要手段。Copin等[18]对94株临床分离菌株的27个pe_pgrs基因序列的差异分析发现,与其他基因组比较,pe_pgrs表现出明显的基因变异,在核苷酸、插入/缺失多样性和dN/dS比值方面均存在显著差异,说明不同家族成员存在广泛的中性选择(neutral selection)、纯化选择(purifyling selection)和多样性选择(diversifying selection),意味家族成员功能的独特性。Camassa等[19]对135株临床分离菌株的研究同样发现,pe_pgrs基因存在单核苷酸突变和低dN/dS比值(0.64),推测纯化突变是MTB对抗有害基因变异的结果。广泛存在的pgrs基因变异结果说明,PGRS结构域是MTB复合群多样性的主要来源,是导致MTB抗原变异的主要原因。
4 PE_PGRS家族蛋白表达
PE_PGRS蛋白表达受生长环境控制,主要包括低氧、营养匮乏和低pH值等因素,不同环境因素对不同PE_PGRS蛋白表达的影响亦不相同,蛋白的差异表达可能在结核病的发病机制和改变宿主对感染的反应方式中发挥作用不同。
Dheenadhayalan等[20]对16个PE_PGRS家族成员表达的研究发现,PE_PGRS27和PE_PGRS50在任何情况下(对数期、低氧、营养匮乏、低pH值、巨噬细胞内)都不表达;PE_PGRS14、PE_PGRS24、PE_PGRS30、PE_PGRS33、PE_PGRS34、PE_PGRS35和PE_PGRS45在体外任何培养条件下均呈组成性表达;PE_PGRS44和PE_PGRS51在对数生长期和富含营养环境中正常表达,在其他生长环境不表达;PE_PGRS26和PE_PGRS55在体外各种培养环境表达均明显下降,PE_PGRS55在低氧环境中培养至30 d不表达;在培养6 d的巨噬细胞内,PE_PGRS1、PE_PGRS26、PE_PGRS55表达明显下调,而PE_PGRS16表达升高8倍,在感染MTB几个月的小鼠组织中也观察到PE_PGRS16和PE_PGRS26的逆向调节,推测可能与细菌在巨噬细胞内持续存活有关。如果能进一步证实PE_PGRS16和PE_PGRS26在感染中的表达特点,那么检测二者的逆向表达性就可能成为诊断MTB潜伏感染的标志,为结核病的早期诊断提供新方向。用表达PE_PGRS16、PE_PGRS26和PE_PGRS33的耻垢分枝杆菌感染人巨噬细胞后6 d,表达PE_PGRS33和PE_PGRS26的菌株存活数量明显高于PE_PGRS16;小鼠感染后10 d,PE_PGRS33和PE_PGRS26菌株在小鼠脾脏和肝脏亦表现为持续高水平生长。PE_PGRS33和PE_PGRS26菌株的持续高存活与细胞死亡相关,细胞培养液检测,乳酸脱氢酶释放增加,IL-10水平升高,而IL-12和NO低水平存在[20]。相反,PE_PGRS16菌株存活率较低与巨噬细胞培养液和小鼠体内NO、IL-12水平较高有关。说明不同PE_PGRS蛋白在宿主细胞中的表达差异可能同时影响MTB病原菌和宿主双方命运,提示研究PE_PGRS家族单个成员功能和表达的重要意义。
5 PE_PGRS家族蛋白功能
PE_PGRS家族成员众多、功能各异,其核心目标是对抗宿主的免疫防御系统,逃避免疫杀伤获得胞内繁殖和生存能力,因而与MTB的存活和毒力密切相关,在结核病的发病和临床进程中发挥重要作用,是影响疾病转归的关键因素。
5.1 介导细菌黏附入侵 黏附定殖能力是MTB感染宿主细胞的先决条件。PE_PGRS家族蛋白大多数属于MTB表面抗原,在介导细菌的黏附并侵入宿主细胞过程中发挥重要作用,这也是其与MTB毒力密切相关的原因之一。PE_PGRS3蛋白在低磷酸盐浓度下特异性表达于菌体表面,其C末端有富含精氨酸的结构域,在重组耻垢分枝杆菌中全长表达时,明显增强细菌对小鼠巨噬细胞和人上皮细胞的黏附能力,感染小鼠后提高了细菌在脾脏组织存留的持久性[21]。PE_PGRS33蛋白通过与宿主细胞表面TLR2结合诱导炎症信号并促进细菌进入巨噬细胞,缺乏PE_PGRS33的菌株进入巨噬细胞的能力严重受损[22]。PE_PGRS60和PE_PGRS61具有纤连蛋白结合蛋白(fibronectin-binding protein, FnBP)特性,可充当与宿主细胞相互作用的黏附分子和信号分子,通过FnBP识别宿主细胞纤连蛋白(fibronectin, Fn)介导细菌黏附宿主细胞[23]。
5.2 调节宿主细胞凋亡 PE_PGRS家族蛋白具有抑制和促进宿主细胞凋亡的双重作用。细胞凋亡通常被认为是在感染早期保护宿主免受MTB侵袭的一种防御机制,然而肺部感染MTB引起的肉芽肿晚期的细胞凋亡则可能更有利于细菌的扩散传播。PE_PGRS家族蛋白在宿主体内形成肉芽肿时可在巨噬细胞中表达,但在肉芽肿形成的不同阶段PE_PGRS蛋白表达的种类和水平存在差异。据此推测,在感染早期表达的PE_PGRS蛋白主要作用是增强MTB的增殖和胞内存活能力,同时抑制宿主细胞凋亡为细菌的繁殖赢得空间和时间;而晚期肉芽肿使胞内寄生菌生存环境进一步恶化时,MTB则表达以促进宿主细胞凋亡为主的家族蛋白,帮助细菌扩散并寻找新宿主。
5.2.1 抑制凋亡 诱导感染细胞凋亡是宿主抵抗MTB的重要手段,然而毒力强的MTB在感染早期有能力抑制宿主细胞的凋亡进程,防止被宿主防御系统杀死,使其在细胞内继续存活和增殖。PE结构域普遍存在保守的DEVS基序中的丝氨酸翻译修饰后,作为底物竞争性结合caspase-3,抑制细胞凋亡,加强了对MTB休眠期和感染状态的控制能力;同时在PGRS结构域存在钙螯合基序,抑制因钙离子内流诱导的细胞凋亡,可能是MTB抑制宿主细胞凋亡的平行策略[9]。
PE_PGRS41通过阻断固有免疫应答和抑制宿主的防御功能来增强细菌在巨噬细胞内的生存能力,主要表现为抑制巨噬细胞活化、产生促炎细胞因子,从而抑制巨噬细胞发生凋亡和自噬,进而延长MTB在细胞内的存留时间,有助于MTB的潜伏性感染[24]。PE_PGRS62重组耻垢分枝杆菌感染巨噬细胞后,巨噬细胞的细胞因子表达受到干扰,细胞凋亡受到抑制,内质网应激反应明显减弱,PE_PGRS62通过破坏内质网应激介导的细胞凋亡促进细菌在巨噬细胞内持续存活[25]。PE_PGRS18是细胞壁相关蛋白,改变宿主细胞产生细胞因子IL-6、IL-1β、IL-12p40和IL-10,减弱细胞凋亡,加强胞内寄生[26]。
5.2.2 促进凋亡 PE_PGRS5是在基因水平转移研究中发现存在于结核分枝杆菌复合群特异基因岛区域的一种T淋巴细胞抗原。感染人类巨噬细胞后4 h表达下调;蛋白质组分析显示,感染后90 d的肺部肉芽肿中存在PE_PGRS5蛋白。PE_PGRS5蛋白定位于宿主细胞内质网,上调未折叠蛋白反应(unfolded protein response, UPR)靶分子GRP78/GRP94和CHOP/ATF4表达,细胞内一氧化氮和活性氧类物质(reactive oxygen species, ROS)产生增多,致使内质网功能紊乱持续;同时,PGRS结构域通过TLR4介导胞内Ca2+释放、破坏细胞内Ca2+稳态,巨噬细胞最终启动caspase8依赖的细胞程序死亡,肉芽肿内细菌得以释放、传播[11]。PE_PGRS33和PE_PGRS17通过上调TNF-α分泌,促进巨噬细胞凋亡[12]。
5.3 结合钙离子 钙结合蛋白通过与宿主细胞钙离子结合,改变胞内Ca2+浓度,在介导巨噬细胞与病原体的黏附和信号活化方面发挥重要作用[27]。PE_PGRS家族蛋白的PGRS结构域普遍存在钙结合蛋白序列,与Ca2+高亲和,介导MTB与宿主细胞的相互作用,促进MTB入侵巨噬细胞,通过TLR2激活相应信号通路,调节一系列促炎因子和抗炎因子的分泌,维持细菌的胞内持续存留时间,细胞内钙离子促进了MTB PE_PGRS蛋白与宿主细胞膜的结合。PE_PGRS33和PE_PGRS61与钙结合后,上调抗炎因子IL-10的分泌,是结核病发病的关键因素。由此可见,拮抗PE_PGRS蛋白与钙离子的结合可能是抗结核病治疗的新方向。
5.4 其他 此外,PE_PGRS家族各成员还通过多种个性化手段抵抗宿主的免疫防御机制在巨噬细胞内生存繁殖。部分家族蛋白可通过调节炎症细胞因子的分泌逃避免疫杀伤,持续在细胞内增殖存留。表达PE_PGRS30和PE_PGRS62的耻垢分枝杆菌感染巨噬细胞后明显减少促炎因子IL-12、TNF-α和IL-6的释放,增进细菌胞内存活能力,其基因失活后,分枝杆菌在巨噬细胞中的复制能力和在肉芽肿中的持留能力明显降低[28]。PE_PGRS17通过改变巨噬细胞内致炎细胞因子的释放而增强自身生存能力、加强致病菌的毒力。表达PE_PGRS17基因的重组耻垢分枝杆菌既能促进宿主细胞分泌IL-10抑制宿主免疫反应,又能诱导巨噬细胞依赖ERK活性上调TNF-α分泌,加速宿主细胞炎症死亡,在促进巨噬细胞大量死亡的同时,通过聚集在少量存活的巨噬细胞中继续存留,推测PE_PGRS17可能在MTB感染不同阶段发挥不同的调节作用。PE_PGRS11 C末端编码一种功能性磷酸甘油酸变位酶(phosphoglycerate mutase),在肺泡上皮细胞通过触发TLR2依赖的Bcl2和COX-2的表达增强对氧化应激的抵抗力,有助于MTB在氧化应激条件下生存。PE_PGRS63在持续感染期间负责提供脂肪酸作为细菌生长的能量来源。PE_PGRS47在MTB入侵巨噬细胞后表达上调,分泌到感染细胞的胞质或胞膜,抑制巨噬细胞自噬,但具体机制尚不清楚[29]。
6 结语
PE_PGRS是一个功能极其复杂的MTB特异的多态性蛋白家族,成员众多、序列多变、差异表达。迄今为止的多数研究只集中于其中少数几个成员的结构和功能,揭示的只是这个庞大家族的冰山一角。家族成员之间的相互关系、基因表达调控方式、信号调节通路及在宿主免疫调节整体网络中的确切机制均有待于进一步阐明,唯有此才能为结核病的治疗、预防及检测提供准确、特异靶位点,开启结核病研究新领域。

