基于域外经验对我国同情用药制度的研究
任 磊,孙圆圆,舒丽芯,张丽杨,张 黎
0 引言
随着我国深化医药卫生体制改革工作的不断推进,尤其是药品审评审批制度改革,在很大程度上提高了我国药品供给能力,但仍然存在临床急需新药上市审批时间过长等问题[1],造成药物研发成果无法及时惠及临床。同情用药制度使危重患者在穷尽现有医疗救治手段的情况下,经过特殊的制度安排,使用尚未批准上市的药物[2]。新冠疫情暴发初期,世界各国已经批准的药品中尚无新冠病毒疫苗或特效药,美国医生通过同情用药制度,对美国首例患者使用吉利德公司研发的还处在临床试验研究阶段的抗病毒药物—瑞德西韦,并取得显著效果。该制度在极大程度上提高了药品的可及性,使患者可以获得及时、有效的治疗,保障患者的生命健康权。但目前我国同情用药制度还有待完善,相关立法研究已落后于实践需要。本文基于我国现阶段同情用药制度现状,与域外同情用药制度的具体内容进行对比,为我国后期完善同情用药制度提供借鉴。
1 我国同情用药制度概述
1.1 法律梳理 自2017年10月8日,由中共中央办公厅、国务院办公厅联合发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),提到“支持拓展性临床试验”,截至目前现行的法律文件中,只有2019年12月1日正式实施新修订的《中华人民共和国药品管理法》(以下简称《药品管理法》)第二十三条以“拓展性同情使用临床试验用药物”的形式对我国同情用药制度做了原则性规定。《拓展性同情使用临床试验用药物管理办法》正式文件尚未正式出台,2017年12月20日,原国家食品药品监督管理总局公布的《拓展性同情使用临床试验用药物管理办法(征求意见稿)》[以下简称《管理办法(征求意见稿)》]只能为我们研究国家同情用药制度做方向性指导,见表1。目前我国缺少具有可操作性的法规、规章等文件对同情用药制度申请人、申请条件、申请程序、责任主体及制度监管等具体内容作出相关规定。

表1 我国同情用药制度相关文件梳理
1.2 内涵界定 现阶段我国对同情用药的内涵界定尚无统一定论,不同学者对其内涵的不同层面进行研究。杨悦[3]认为,同情用药的病情界定应为患有严重或威胁生命疾病。刘颖等[4]认为,需要通过现有治疗方法进行尝试治疗,但没有治疗效果,并且也没有其他可供选择的治疗方法。王璁等[5]提到患者不能通过入选临床试验来得到有效治疗。王助衡[6]提及允许在开展临床试验的机构内给急需的患者使用尚未得到批准上市的药物。虽然不同学者对不同方面的表述存在区别,但基本涵盖病情表述、替代治疗、注册临床试验、使用地点等基本要素。
2 同情用药具体内容
2.1 名称及类别 在我国现有文件中尚未提及同情用药制度字眼,是以拓展性同情使用临床试验用药物(也称“拓展性临床试验”)的形式实现同情用药,两者之间在制度定位、适用条件等方面存在一定差别,但为方便研究,本文将“拓展性临床试验”视为“同情用药”。世界其他国家对同情用药制度的表述也存在差别,例如美国扩展使用(Expanded Access,EA)、加拿大特别准入计划(Special Access Program,SAP)、澳大利亚特别准入计划(Special Access Scheme,SAS)、法国临时使用授权(Temporary Authorization for Use,ATU)、德国同情用药(Compassionate Use,CU)、英国早期获取药物计划(Early Access to Medicines Scheme,EAMS)等,虽然名称表述存在区别,但都包括对尚未批准上市销售药品的同情使用。各国对于同情用药制度基于病情、患者人数、药品属性等因素进行了不同类别的划分,如表2。

表2 部分国家同情用药制度类别划分
2.2 制度定位 《管理办法(征求意见稿)》中提到同情用药可使临床急需用药患者能够尽快获得试验用药,加快临床试验用药物安全性数据的收集,可作为支持性的安全性数据包含在注册申报的资料中,是临床试验的一种形式。但其他部分国家设置目的与我国存在区别,例如加拿大同情用药设定不是为了提倡或鼓励患者可以更早使用药品,也不是为了更好地研发药品,更不是为了让生产企业规避临床试验或药品审评[10]。而美国鼓励公司在公共网站上发布同情用药药物使用信息,以促进重症患者或急需治疗的患者参加。
2.3 适用条件 虽然同情用药可以增加患者用药的可及性,但是同情用药适用条件至关重要,一旦滥用会对患者造成不必要的伤害。美国对新冠患者同情使用瑞德西韦是在患者住院第6天出现病情恶化,现有药物治疗作用不明显的情况下进行的。通过我国《管理办法(征求意见稿)》可总结我国同情用药制度适用条件主要包括:①患有危及生命或严重影响患者生活质量需早期干预且无有效治疗手段的疾病;②患者不能通过参加临床试验来获得临床试验用药物;③在开展临床试验的机构内使用;④患者使用该药物的获益大于风险;⑤患者知情同意;⑥其他,例如该药物已开展临床试验[11]。从相关文件可以推断我国同情用药制度需要符合以上所有条件。其中多个条件与国外基本保持一致,但是药物使用机构等条件与其他国家存在区别,加拿大、法国、澳大利亚等国均未明确在开展临床试验的机构内使用,只需要在医院就可以进行使用。美国还要求对该患者提供临床试验药品不会干扰可能用于此产品开发或上市审评的临床试验[12]。
我国同情用药的药品范围局限在临床试验期的药品,而澳大利亚同情用药的药品范围还包括因商业或其他原因从澳大利亚市场撤出的药品[13]。
2.4 申请人 《药品管理法》未明确同情用药的申请人,但从《管理办法(征求意见稿)》可以看出我国同情用药的注册申请人以企业为主。美国对新冠患者同情使用瑞德西韦进行药物治疗是由医生提出申请,除美国、加拿大、澳大利亚等国家可由医生提出同情用药的申请外,澳大利亚在特定情况下还可以由牙医、护士、药剂师、心理医师等人员提出申请,例如牙医可以申请牙科药品的同情使用;法国nATU是由医生提出申请,cATU是由该药品的制药公司或其授权的代表进行申请。由于同情用药需要对患者病情、药品疗效、是否存在替代性治疗等多方面信息进行掌控,无论是制药公司还是医生提出申请都存在各自的优缺点,例如医生对自己患者病情更为熟悉了解,制药公司对药物安全性、有效性更为了解。
2.5 审评或决策机构 2014年爱尔兰药品管理局批准吉利德公司雷迪帕韦/索非布韦对丙肝患者同情使用;2013年瑞典药品管理局批准百时美施贵宝制药公司达卡他韦对基因1型慢性丙型肝炎患者同情使用。对于同情用药的审评或决策机构多由药品监督管理部门负责,少数由医院伦理委员会直接负责,例如意大利[14],其他部分国家同情用药审评或决策机构如表3。根据《管理办法(征求意见稿)》可以看出,我国同情用药审评或决策机构属于前者,由国家药品监督管理局药品审评中心负责同情用药申请的受理及审评,在临床试验用药物已取得的安全性和有效性数据的基础上,来决定是否批准申请。但根据《药品管理法》,我国的拓展性临床试验不需要药监部门审批,仅需要经过伦理审查即可[15]。
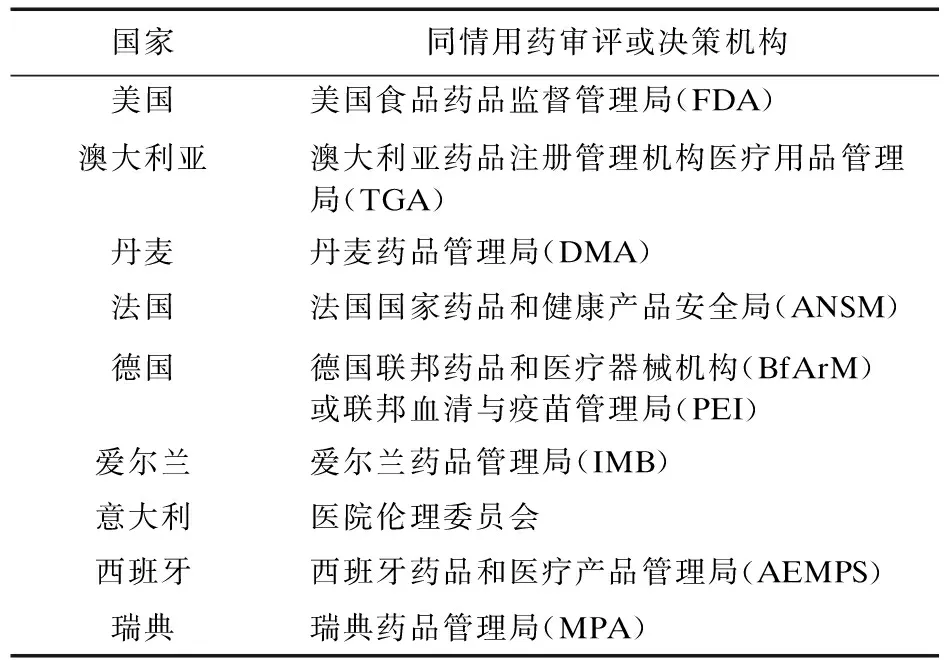
表3 部分国家同情用药审评或决策机构[16]
2.6 职责规定 一个完整同情用药流程大概包括患者、医生、医院、企业、政府等主体。我国《管理办法(征求意见稿)》用较大的篇幅对企业的职责进行规定,例如记录药物分发和剩余药物收回、提交药物使用的总结、判断患者病情、收集药物使用信息和不良事件等,区别于澳大利亚、德国等国,没有过多规定医生的职责,仅包括医生对患者临床获益评估、配合注册申请人进行沟通、按照要求进行药物的使用,主要原因在于我国是将同情用药视为临床试验的一种形式,基本是参照《药物临床试验质量管理规范》进行用药。而国外其他部分国家因同情用药是由医生提出用药申请,医生在同情用药制度体系中受到更多法律约束。
2.7 收费问题 按照《管理办法(征求意见稿)》相关规定,我国同情用药是作为临床试验的一种形式,在拓展性临床试验期间,原则上不允许注册申请人对临床试验用药物收费,及所用药品的支付方原则上是制药公司。不同的国家和地区关于同情用药的药品定价、报销比例以及费用支付方的规定不尽相同[17-18],详见表4。从统计的情况来看,由制药公司进行支付的国家仅占有一定比例,大部分还是有偿使用药品,可通过医疗保险对患者进行补偿。法国在同情用药药品正式上市后,医疗产品经济委员会(Economic Committee for Healthcare Products,CEPS)会与制药公司进行谈判确定药品价格,若低于同情用药期间价格,制药公司需偿还同情用药期间药品销售的差价。

表4 部分国家同情用药所用药品的相关费用情况
3 启示
我国刚刚确立同情用药制度,在很多方面还需不断探索,应以此次新型冠状病毒肺炎为契机,加快我国同情用药制度的完善,以应对今后可能突发的公共卫生事件或为临床急需药品提供制度保障。
3.1 出台相关法律文件,使实施制度有法可依 为保障同情用药制度的顺利开展,世界多个国家除了在法律法规层面作出规定,还会颁布相关指南以指导相关主体实施同情用药制度。现阶段,我国只有《药品管理法》在法律层面对同情用药作出规定,可操作性存在一定限制,需要制定与同情用药制度相配套的法规或规章对其后期的管理和运行进行规定与指导。建议我国可依托现有的《管理办法(征求意见稿)》,经过社会征求意见后,尽快发布正式文件,为同情用药设计更为完备、周全的法律制度[19],对同情用药的具体内容作出详细规定,以实现同情用药制度的实施有法可依。
3.2 完善配套政策体系,与现有制度有机衔接 同情用药制度的运行机制并不是单一制度的存在,与其他制度、政策相互关联,共同构成完整的生态体系。从某种药品同情用药项目启动到制度实施,再到药品正式上市(同情用药结束),每个阶段都会与现有制度、政策进行关联。在同情用药启动阶段,涉及药品效益和风险评估机制、临床试验伦理审查制度、临床试验机构备案管理制度等;在同情用药实施阶段,涉及药品注册管理制度、药品临床试验管理制度、药物警戒制度等;在同情用药结束后阶段,涉及药品招标采购制度、药品医保支付制度等。建议在今后同情用药制度的完善中与其他相关制度体系建立良好衔接机制。
3.3 明确制度具体内容,使建议具有可操作性 基于域外同情用药制度的经验,结合《管理办法(征求意见稿)》的政策导向,根据我国的具体国情,建议对我国同情用药制度进行分类管理,对单个或少量患者以及病情特别紧急的申请与其他申请进行区分,方便管理,同时提高药物可及性;我国将同情用药作为临床试验的一种形式,建议在以企业提出申请的基础上,完善同情用药申请通道,发挥医生主体的专业优势,例如可增加医生与企业的沟通机制,医生通过与企业进行沟通实现同情用药的申请;建议扩大同情用药使用机构范围,使符合一定资质的医院也具有使用药品的权限;在同情用药的审评与决策方面,建议发挥药品监督管理部门和伦理委员会共同作用机制,可以根据同情用药分类进行不同的规定;同情用药区别于注册临床试验,建议对医生、企业、政府、医院、患者等各方主体的职责进行更为详细的规定;鉴于我国现阶段主要是由企业提出同情用药的申请,建议继续维持不收费的模式,但在后期拓展申请通道后,可考虑通过医疗保险支付的方式改善企业成本负担。
本文对我国同情用药制度的研究基于《药品管理法》和《管理办法(征求意见稿)》,但因后者在《药品管理法》之前发布,且尚无正式文件,因此在研究过程中可能存在一定偏差。

