甜菜幼苗对氮胁迫及复氮后的生理生化响应
赵阳,石俊婷,芮秀丽,李佳佳,魏多,刘大丽
(1.国家甜菜种质中期库,哈尔滨 150080;2.黑龙江大学现代农业与生态环境学院,哈尔滨 150080)
0 引言
甜菜是我国重要的糖料作物,是制糖工业的主要原料之一,其主要种植区分布在东北、华北和西北等地区[1]。甜菜具有较高的营养价值和商用价值,其产量和品质对人类的生活需求和制糖工业的发展有着重要的影响[2]。而甜菜单产低,是制约我国甜菜糖业发展的重要问题之一。
氮是甜菜生长过程中不可替代的重要营养元素,是植物体内蛋白质、核酸、磷脂、生物碱和某些植物生长激素的重要组分之一[3]。氮能够促进植物新叶生长,增加叶片厚度,增大叶面积[4]。氮素不仅是植物体内叶绿素的重要组成部分,而且氮含量可以通过其他途径间接影响植物的叶绿素含量和光合作用[5]。研究表明,在甜菜生长的过程中,氮素对甜菜的生长发育、块根含糖和品质的影响非常之大。当供给不足时,甜菜往往会表现出特定的缺乏症状,产量降低,品质下降,限制经济效益。虽然植物干物质积累量与施氮量呈显著正相关,但当施氮量超过甜菜最佳生长所需量时,则会导致根中的干物质和蔗糖的含量下降。施氮量与含糖率呈显著负相关,随着施氮量的增加,块根中造蜜性物质、有害氮含量等含量增加使甜菜品质下降,同时细胞渗透压增大促进对水分的吸收,最终导致甜菜含糖率降低[6-7]。过量氮肥投入还会使生产成本增加,造成氮肥资源浪费和土壤退化等环境风险[8]。因此科学合理施氮对提高甜菜的氮素利用率、降低生态环境污染具有重要意义[9]。合理施氮、按需施氮、提高氮的利用率,是提高甜菜块根产量,提高经济效益的有效措施。
在作物生产中,不仅需要关注其叶与根的生物量的积累,还需要关注其体内活性成分在不同氮水平下的变化,如超氧化物歧化酶(SOD)、谷胱甘肽转移酶(GST)和过氧化物酶(POD)等。在植物正常生理状态下,机体产生和清除自由基的速率处于动态平衡状态[10]。逆境胁迫条件下,植物体内产生的大量活性氧会损伤机体的蛋白质结构、细胞的结构和功能、细胞膜的通透性等[11]。抗氧化酶系统可以有效地清除活性氧,使机体维持稳定。超氧化物歧化酶(SOD)作为重要的抗氧化酶之一,可以有效清除机体内的活性氧、减轻膜质过氧化对机体造成的损伤[12]。研究表明,受到轻度或短期氮胁迫植物的SOD 活性会逐渐增加,受到严重或长期氮胁迫的植物SOD 活性会逐渐降低[13]。脯氨酸(Pro)在植物抵抗逆境胁迫过程中起着重要的作用。在如干旱、高温、高盐、冰冻、重金属等逆境胁迫下,植物会在体内积累大量脯氨酸来调节渗透平衡,维持蛋白质、膜和亚细胞结构的稳定[14]。脯氨酸的积累能够有效缓解逆境胁迫条件对植物抗氧化系统造成的影响和伤害。因此,脯氨酸含量可以作为衡量植物抗性的指标[15]。丙二醛(MDA)是膜脂过氧化的主要产物,其含量反映出逆境胁迫下植物受害的程度和逆境条件的强弱[16]。在植物受到如氮等胁迫时,植物所产生的自由基会引发膜脂过氧化作用,使丙二醛生成和积累,导致膜的流动性降低,膜的通透性增强。
目前,虽然一些学者对氮素施用量与甜菜的表型和产量等方面的关系进行了研究[6-7],但鲜少研究和关注甜菜的低氮、缺氮以及复氮生理变化。因此,本试验分析了氮胁迫对甜菜根和叶中的过氧化物酶(POD)、谷胱甘肽转移酶(GST)和超氧化物歧化酶(SOD)活性、脯氨酸(Pro)和丙二醛(MDA)含量的影响,揭示甜菜的氮胁迫下的应答机制,为氮胁迫生理研究提供依据。
1 材料与方法
1.1 供试材料
试验在黑龙江大学国家甜菜种质中期库实验室进行,选取具有发芽率高、颗粒大且饱满、相对大小一致的种子,幼苗健壮的甜菜资源‘780016B/12优’为材料。
1.2 甜菜培养及氮胁迫处理
将种子在2‰的福美双溶液中浸泡过夜,蒸馏水冲洗后,用盛有蛭石的培养槽进行为期9 d 的育苗。当两片子叶展开后,将幼苗移栽到昼夜温度分别为25 ℃和18 ℃,光照强度为200µmol/(m2·s),每天连续光照14 h 的条件进行培养。当甜菜幼苗第二对真叶长出时,将幼苗移至缺氮N0(0 mmol/L)、低氮N1.5(1.5 mmol/L)和对照N10(10 mmol/L)的改良Hoagland 营养液中[17],分别在0、12、24 和48 h 对甜菜幼苗进行生理指标测定。同时,将氮胁迫处理后的幼苗进行恢复供氮,复氮24 h和48 h后,对甜菜幼苗的各生理指标进行测定。
1.3 生理生化指标测定
采用氮蓝四唑(NBT)法测定超氧化物歧化酶(SOD)活性[18];采用NBT 光还原法测定植物SOD 及SOD标准品酶活性[19];采用愈创木酚比色法测定过氧化物酶(POD)活性[20],利用H2O2/过氧化物酶(POD)/愈创木酚(GA)反应产物,在470 nm 的吸光度去定量POD 活性[21];用硫代巴比妥酸法测定丙二醛(MDA)含量,用酸性茚三酮法测定脯氨酸含量[22];用谷胱甘肽-S转移酶(GSH-ST)试剂盒(南京建成生物工程研究所)测定谷胱甘肽转移酶(GST)。
1.4 数据处理
用Microsoft Excel 2010软件进行数据处理和作图(表),用SPSS 23.0软件进行数据差异及显著性分析。
2 结果与分析
2.1 缺氮、低氮胁迫和复氮对甜菜脯氨酸含量的影响
与正常供氮培养条件相比,甜菜在缺氮、低氮以及复氮处理后,其体内的各项生理生化指标均产生了不同程度变化。如图1 所示,甜菜幼苗缺氮和低氮胁迫处理后,根与叶中脯氨酸(Pro)含量先缓慢下降后迅速升高,而后增幅趋于平缓。
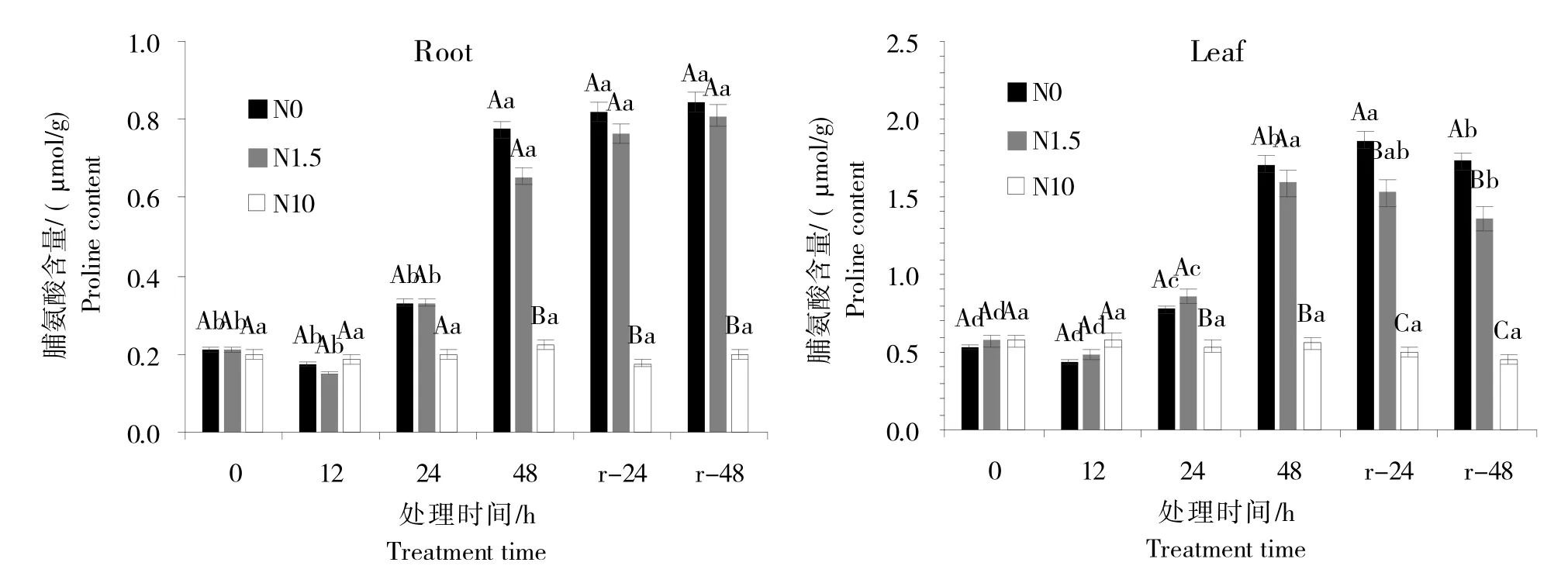
图1 不同氮处理水平对甜菜幼苗体内脯氨酸含量的影响Fig.1 Effect of different nitrogen treatments on proline content in sugar beet seedlings
甜菜幼苗根和叶在N0处理中,脯氨酸(Pro)含量在12 h后开始增加,在处理48 h后与初始时相比分别增加了265.54%和219.24%;与对照组相比分别增加了245.99%和205.57%。在N1.5 处理中,根和叶中脯氨酸含量在48 h 后与初始时相比分别增加了209.04%和178.20%;与对照组相比,分别增加了192.51%和184.15%。复氮后Pro含量变化不明显,根和叶中脯氨酸含量在N10对照组中均无明显变化。
2.2 缺氮、低氮胁迫和复氮对甜菜体内丙二醛(MDA)含量的影响
逆境胁迫会对细胞造成膜质过氧化。研究表明,在甜菜幼苗的根与叶中,丙二醛随着氮处理(N0 与N1.5)时间的增长,其含量也显著增加;N0处理中,在缺氮、低氮胁迫处理48 h后,根和叶中MDA 的含量与对照组相比分别上升了350.20%和129.17%;N1.5处理中,在处理48 h后,根和叶中MDA 的含量与对照组相比分别上升了325.80%和87.50%;复氮处理后其含量虽上升,但无显著变化。同一处理条件下不同处理时期MDA 含量存在显著差异,同一处理时期不同处理条件也存在一定差异。胁迫处理过程中,N0 组幼苗MDA含量大于N1.5组,对照组MDA含量均显著小于N0、N1.5处理组(图2)。
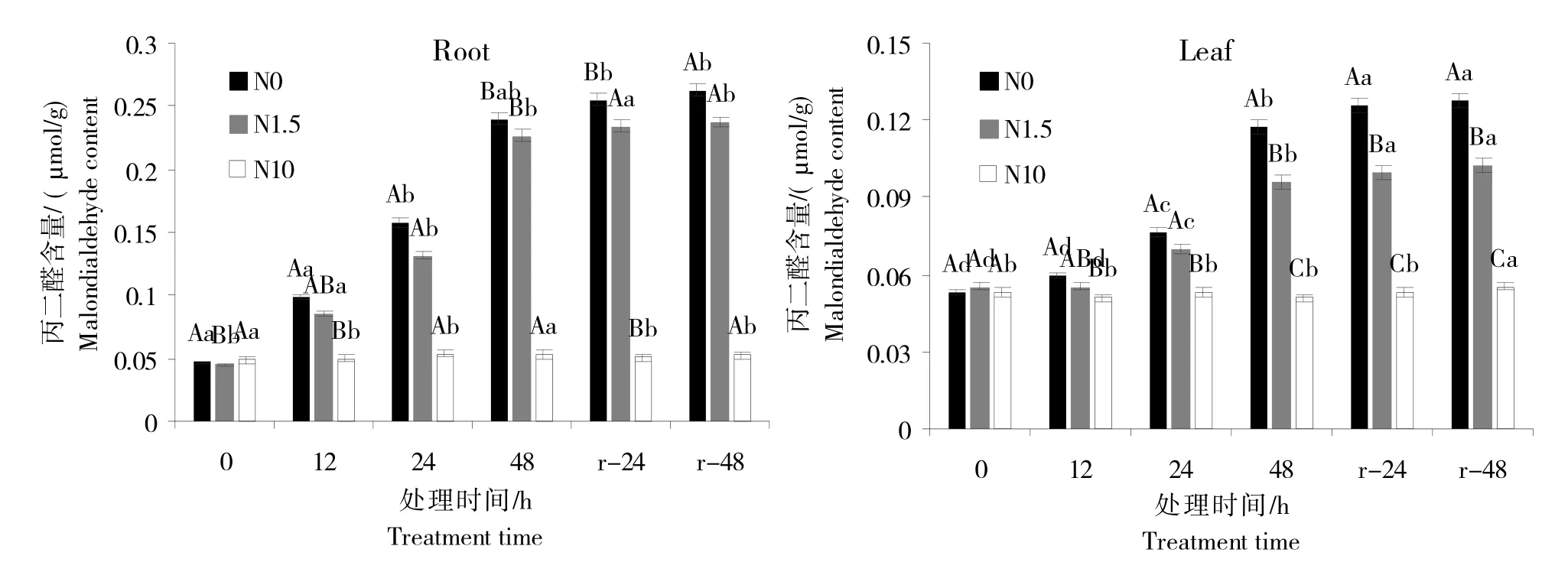
图2 甜菜幼苗在缺氮、低氮和复氮条件下的丙二醛含量Fig.2 The content of malondialdehyde in sugar beet seedlings under nitrogen deficiency,low nitrogen and nitrogen resupply conditions
2.3 缺氮、低氮胁迫和复氮对甜菜体内POD和SOD活性的影响
超氧化物歧化酶(SOD)和过氧化物酶(POD)作为清除氧自由基的关键酶,在植物细胞脂膜过氧化过程中发挥着重要作用[23]。在N0和N1.5缺氮、低氮胁迫处理48 h后,甜菜幼苗根和叶中POD 活性均达到了最高值,N0 处理下根和叶中POD 的活性与N10 相比分别增加了214.21%和222.15%,N1.5 处理下根和叶中POD的活性与N10 相比分别增加了153.43%和162.01%。复氮48 h 后甜菜根和叶中POD 活性均有所下降,但仍旧比对照组的活性高(图3A、B)。
随着胁迫时间的增加及氮水平的降低,甜菜幼苗根和叶中SOD 活性呈显著上升趋势(图3C、D),在缺氮、低氮胁迫处理48 h后,根和叶中SOD的活性达到了最大值;在N0处理下,根和叶中SOD活性与N10相比分别增加了85.67%和79.17%;在N1.5 处理下,根和叶中SOD 活性与N10 相比分别增加了75.90%和61.45%;在处理48 h 后,缺氮处理比低氮处理对SOD 和POD 活性的影响更大,其中低氮处理下根中SOD 和POD 的活性与缺氮时相比分别低5.27%和19.34%;叶中SOD 和POD 的活性与缺氮时相比分别低9.89%和18.67%(图3)。在恢复正常供氮后,N0 与N1.5 处理下甜菜幼苗根与叶中的SOD 活性虽然有所降低,但仍然高于正常生长条件下的酶活性。
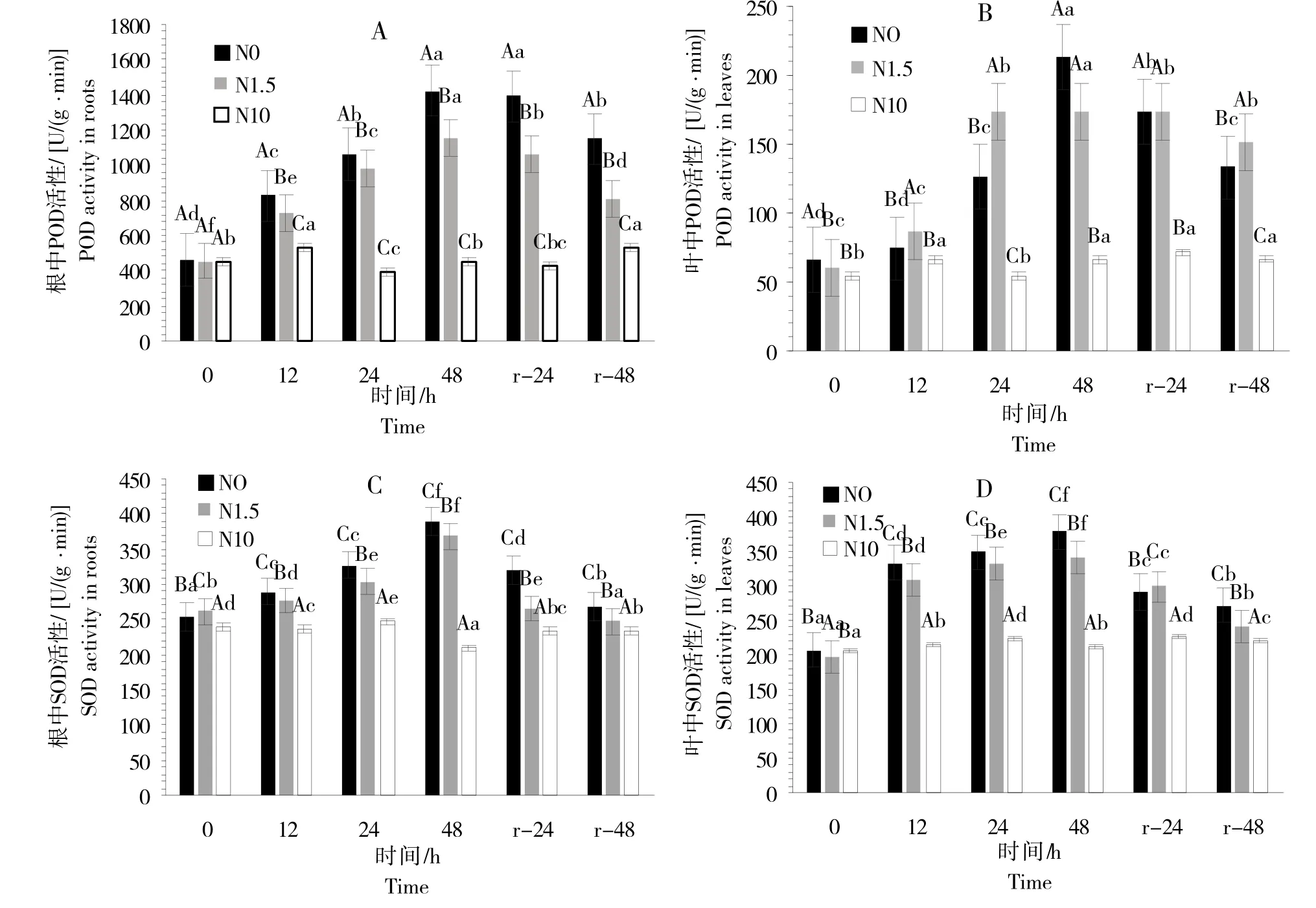
图3 不同氮处理水平对甜菜幼苗叶片和根中POD和SOD酶活性的影响Fig.3 Effects of different nitrogen treatments on POD and SOD activities in leaves and roots of sugar beet seedlings
2.4 缺氮、低氮胁迫和复氮对甜菜体内GST活性的影响
由表1可知,缺氮或低氮处理前期(12 h),甜菜幼苗根和叶中谷胱氨肽转移酶(GST)的含量变化不明显;随着缺氮时间的增长,GST 的活性显著增加,48 h 后,与对照相比,N0 处理甜菜幼苗根和叶中GST 活性分别增加了683.86%和258.23%;N1.5 处理分别增加了475.45%和224.81%。恢复供氮24 h,甜菜叶片和根部的GST 活性仍旧有所增加,叶中GST 活性增长速率要高于根部,但都达到了最高值。复氮24 h 后,N0 处理下,甜菜根和叶中GST 的活性较N10 相比分别增加了1175.30%和604.01%;N1.5 处理下,根和叶中GST 的活性较N10 相比分别增加了778.44%和480.21%。在恢复供氮48 h 后,GST活性开始下降,但仍旧比对照组GST活性高。

表1 不同氮处理条件下甜菜体内GST 活性的变化(单位:U/mg prot)Table 1 Changes in GST activity in beets under different nitrogen treatment conditions
3 讨论
氮素是植物所需的重要营养物质,在植物生长发育中起到关键作用。氮是植物体内许多重要有机化合物的组分,也是遗传物质的基础[24]。无论是土壤中的低氮含量或是甜菜品种本身的低氮利用率,均不利于甜菜的生产和该产业的可持续性发展[25]。因此,本试验试图通过研究在缺氮和低氮胁迫下,甜菜体内的各项生理指标的变化,以及在复氮后,各指标的的恢复情况,探索甜菜应对氮胁迫的生理机制。
本研究通过对不同浓度氮胁迫处理下的甜菜进行生理生化指标的分析发现:低氮胁迫下,甜菜发生细胞质膜损伤,GST 和POD 的活性不断增加到较高的水平。植物处于逆境时,细胞内活性氧产生与消除间平衡被破坏,植物开始启动相应防御系统[18]。SOD、POD、GST 是植物体内主要的ROS 酶促清除系统[26]。低氮胁迫下,甜菜体内含氧自由基含量可能增多,为抵御体内含氧自由基的产生,植物体内的抗氧化酶活性增强[27],延缓叶片衰老,从而使甜菜更好地适应逆境胁迫[28]。植物中丙二醛(MDA)含量的多少是植物细胞膜受到伤害程度的重要体现,MDA 含量高,说明植物细胞膜质过氧化程度高,细胞膜受到的伤害严重[29-30]。低氮胁迫下,甜菜体内MDA 的含量随着胁迫时间的延长而增加,这与王俊、尹大川等[28-29]的试验结果相似,MDA 和含氧自由基的积累,会影响甜菜幼苗的生长。脯氨酸(Pro)是植物蛋白质的重要组成成分之一,在植物中以游离态形式广泛存在。在干旱、盐碱、高温、低温和冰冻胁迫条件下,植物体内的Pro含量会显著增加,因此,植物体内Pro 的含量在一定程度上反映了植物的抗逆性[31]。甜菜体内Pro 的含量随着低氮胁迫时间的延长而增多,推测其可能通过细胞质内渗透调节来减缓胁迫环境对植物的伤害。但仍旧无法恢复到正常数值,在一定程度上,对细胞仍有损害。
4 结论
本研究通过在缺氮、低氮和恢复供氮条件下,甜菜幼苗体内重要生理指标的对比研究发现,甜菜幼苗通过提高超氧化物歧化酶(SOD)、过氧化物酶(POD)、谷胱甘肽转移酶(GST)活性以及脯氨酸(Pro)含量来适应氮胁迫,应对由于丙二醛(MDA)含量增高的细胞质膜损伤。而在恢复正常供氮后,甜菜机体的生理活性在短时间内很难恢复到正常水平。

