基于生物信息学和机器学习的心肌梗死后心室重构关键基因的筛选
李兴渊,朱明军,彭广操,王建茹
河南中医药大学第一附属医院心内科 郑州 450000
心肌梗死(myocardial infarction,MI)作为冠心病中最危险的类型,是当前全球范围内人类死亡的主要原因之一[1-4]。随着溶栓、冠脉介入等治疗手段的应用和普及,MI的病死率显著下降,但MI后心力衰竭和不良心血管事件的风险明显增加;MI后心室重构(ventricular remodeling post-myocardial infarction,VRpMI)是导致上述风险的重要病理基础[1-6]。VRpMI是指MI后心肌细胞、非心肌细胞和细胞外基质发生改变,导致心室持续发生形状和功能上的病理性改变,表现为左心室扩大、左心室射血分数降低和(或)局部室壁活动异常等[4-5]。研究[2,6]显示,近半数的MI患者在MI后1 a内出现了心室重构且大多发生在前3个月。临床上,常通过生化指标、超声心动图、心脏磁共振成像等手段诊断和评估VRpMI,但仍缺乏更准确的评估方法或体系[4,7]。因此,积极探索VRpMI病理过程中潜在的生物标志物及病理机制,从而挖掘有效的诊断、防治心室重构的方法,具有重要意义。
随着高通量测序技术的发展和推广应用,许多疾病病理过程中的转录组等信息可被获取,这些海量的数据将极大地助力人类深入探索疾病的发生、发展和转归等的机制和规律[8-9]。加权基因共表达网络分析(weighted gene co-expression network analysis,WGCNA)作为生物信息学中一种高频运用的方法,常用于分析样本性状与基因间的关联模式,在筛选疾病生物标志物或潜在防治靶点方面表现出了明显优势,现已在多种疾病中成功应用[10-11]。机器学习作为人工智能的一个子集,已被广泛应用于多个医学领域[12-13]。在心血管方面,机器学习已被应用于探索疾病生物标志物、发病机制、治疗靶点、预测生存结局及保健等方面[13-16]。本研究基于高通量测序数据,利用生物信息学和机器学习相结合的方法,筛选VRpMI病理过程中潜在的生物标志物及分子机制,以期为VRpMI的防治提供新的思路。
1 材料与方法
1.1 数据来源及预处理从GEO数据库(http://www.ncbi.nlm.nih.gov/geo/)中下载GSE132143数据集。提取数据集中NextSeq 500测序系统检测的健康人心室组织(正常组,12个样本)和VRpMI患者心室组织(VRpMI组,20个样本)的转录组信息。基于人类参考基因组GRCh38,提取“gene_biotype”为“protein_coding”的注释信息,将健康人和VRpMI患者心室组织转录组测序数据的基因ID转化为基因名,剔除基因数为0的基因后将数据保存为“human_MI.txt”文件,用于后续筛选差异表达基因(differentially expressed gene,DEG)。同时,下载GSE132143数据集中猪(n=9)MI后6个月左室梗死区和梗死远端区域组织的测序数据,并使用edgeR包中calcNormFactors函数的TMM算法对测序数据进行标准化校正,保存为“Swine_MI_6m.txt”文件。此外,下载基因芯片数据集GSE775及其平台文件GPL81-57556,该数据集为不同时间点正常小鼠(n=3)和VRpMI小鼠(n=3)左室心肌组织基因表达数据,分别提取MI后48 h和8周的数据,并取以2为底的对数,然后分别保存为“mouse_MI_48h.txt”和“mouse_MI_8w.txt”文件。
1.2 DEG的筛选利用edgeR包,以|log2[差异倍数(fold change,FC)]|>2和校正后的P<0.05为阈值,对“human_MI.txt”文件中的表达数据进行分析,筛选DEG,并利用ggplot2和pheatmap包进行可视化处理。
1.3 WGCNA将“human_MI.txt”文件中各样本中基因的基因数转换成TPM模式,并保存为“data_tpms.txt”文件,然后对样本进行聚类并剔除离群样本,形成数据矩阵。利用WGCNA包计算最佳软阈值并据此将数据矩阵依次转化为邻接矩阵、TOM矩阵,进而进行基因聚类;将模块基因数目设为30,通过动态剪切树法识别基因模块,对相似模块进行聚类和合并;计算基因模块与组别信息之间的相关系数及P值,选择与正常组样本正相关性最强的基因模块进行后续分析。
1.4 重要DEG的筛选以及疾病本体(disease ontology,DO)和基因功能富集分析利用venn包将1.2中筛选出的DEG和1.3中选出的与正常组样本正相关性最强的模块中的基因取交集,获取重要DEG。分别利用enrichDO函数、clusterProfiler包对重要DEG进行DO富集分析、GO分析和KEGG通路富集分析。
1.5 关键基因的筛选及验证分别利用基于glmnet包的最小绝对值收敛和选择算子(least absolute shrinkage and selection operator,LASSO)算法和基于e1071包的支持向量机-递归特征消除(support vector machine-recursive feature elimination,SVM-RFE)算法从重要DEG中筛选特征基因,然后利用venn包对两者取交集,获得关键基因。同时,基于正常组和VRpMI组心室关键基因的表达量,利用ROC曲线评价关键基因诊断VRpMI的效能;分别从“mouse_MI_48h.txt”、“mouse_MI_8w.txt”和“Swine_MI_6m.txt”文件中提取关键基因的表达量,进行组间比较,采用pROC包绘制关键基因的ROC曲线,并用这些外部数据来评价关键基因的诊断效能。
1.6 关键基因的基因集富集分析(gene set enrichment analysis,GSEA)以关键基因在“data_tpms.txt”文件中所有样本表达量的中位数为依据,将文件中的关键基因分为高表达组和低表达组。利用GSEA 4.1.0软件,选择c2.cp.kegg.v7.4.symbols作为参考基因集进行GSEA。以标准化富集得分的绝对数>1、名义P值<0.05和错误发现率(false discovery rate,FDR)<0.25为阈值筛选阳性基因集。
2 结果
2.1 DEG的筛选结果差异分析共筛选出716个DEG,其中上调585个,下调131个(图1)。
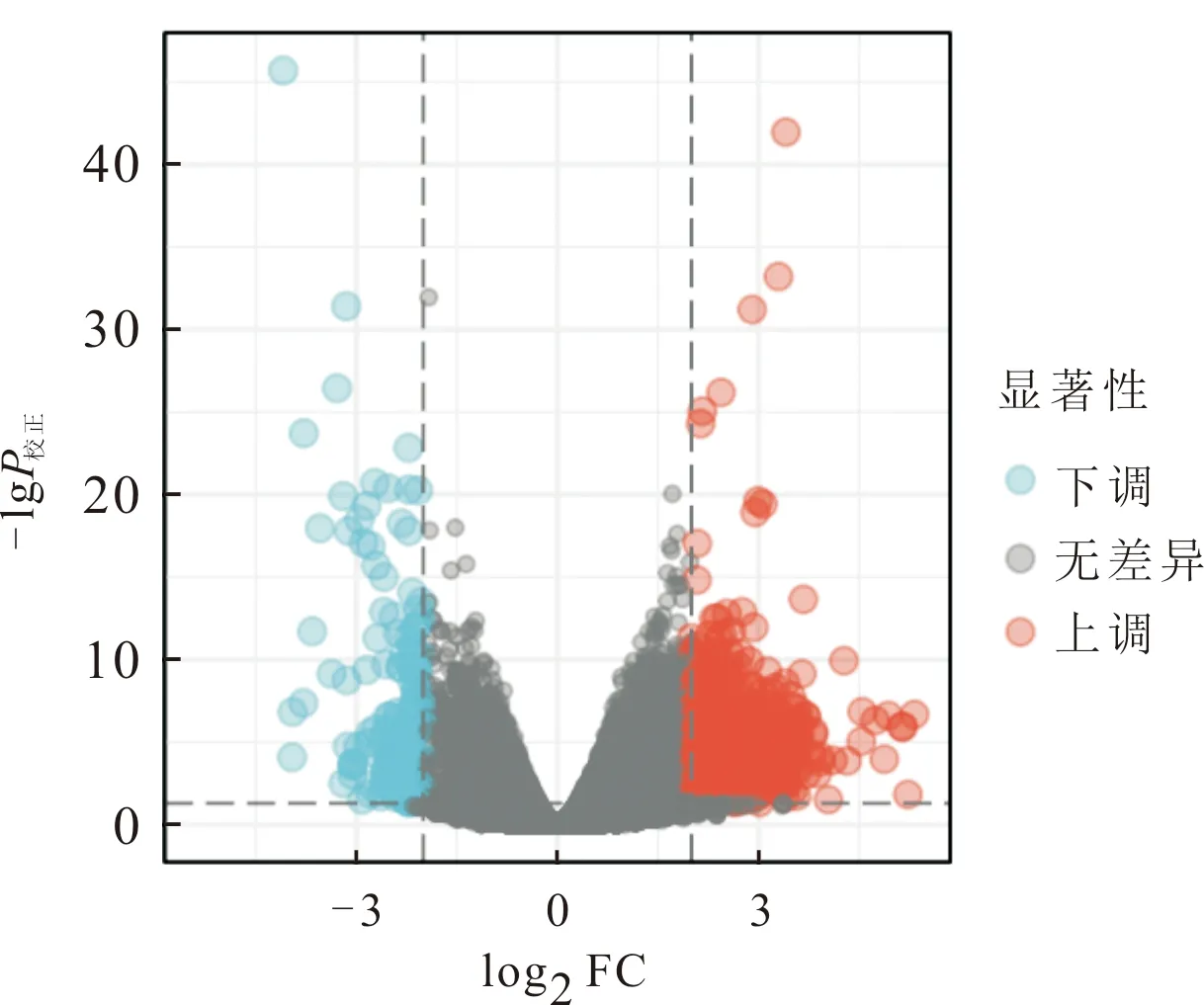
上:火山图(蓝点为下调的DEG,灰点为表达无差异的基因,红点为上调的DEG);下:前20个上调、下调DEG的热图
2.2 WGCNA结果从1~20中选取软阈值开展网络拓扑分析,当软阈值为7时能够使邻接函数较好满足无尺度条件且R2>0.8(图2A、B)。随后,利用动态剪切树法得到6个基因模块(图2C)。图2D展示了6个基因模块与组别信息之间的相关系数及P值,其中棕色模块与组别信息的相关性最高(|r|=0.85,P<0.001),共包括7 288个基因(图2D、E)。因此,选择棕色模块中的基因开展后续研究。
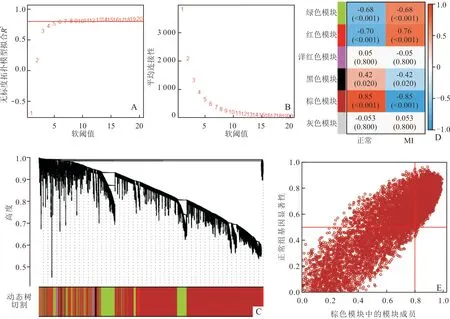
A:软阈值参数与尺度独立性分析;B:软阈值参数与平均连接性分析;C:基因聚类树与基因模块;D:临床性状与基因模块的相关性热图;E:棕色模块与正常组性状的散点图
2.3 重要DEG的筛选以及DO和基因功能富集分析如图3A所示,棕色模块中的7 288个基因与716个DEG取交集后获得355个重要DEG。DO富集分析结果(图3B)显示,依据BH法校正后的P<0.05,共富集到了24种疾病(图中展示20种),包括动脉粥样硬化、动脉粥样硬化性心血管疾病、牙周病、肺疾病、脑梗死等。GO富集分析结果(图3C)显示,依据P<0.05确定了492个GO条目。生物学过程条目370条,主要涉及药物分解代谢过程、免疫反应、炎症反应等;细胞组分条目32条,主要涉及含细胞外基质的胶原蛋白、胞质囊泡腔、运输囊泡等。分子功能条目90条,主要涉及细胞外基质结构成分、晚期糖基化终产物(receptor for advanced glycation end,RAGE)受体结合、血红素结合等。KEGG富集分析结果(图3D)显示,依据P<0.05共映射出15条信号通路,包括蛋白质消化吸收,鞘脂代谢,Apelin、PI3K-Akt、松弛素和Ras信号通路等。
2.4 关键基因的筛选及验证如图4A、B、C所示,采用LASSO算法从355个重要DEG中筛选出了10个特征基因,采用SVM-RFE算法则筛选出了6个特征基因,两者取交集后鉴定出神经元正五聚蛋白2(neuronal pentraxin 2,NPTX2)为关键基因。其log2FC=-2.442,FDR<0.001,提示其在VRpMI中低表达。
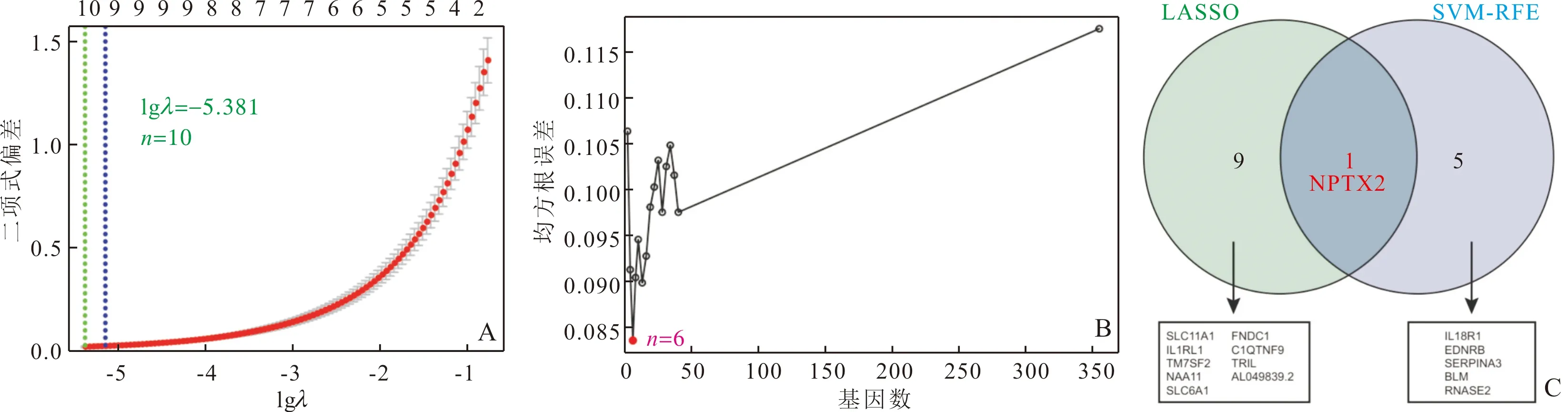
A:LASSO算法筛选的特征基因;B:SVM-RFE算法筛选的特征基因;C:两种机器学习算法筛选关键基因的韦恩图
NPTX2在小鼠MI后48 h和8周时表达水平较正常小鼠心肌组织低(图5A、B);猪MI后心肌梗死区域NPTX2的表达水平较心肌远端区域低(图5C)。基于健康人和VRpMI患者心室组织转录组测序数据(内部数据)绘制诊断VRpMI的ROC曲线,AUC(95%CI)为0.996(0.984~1.000),表明NPTX2具有良好的诊断效能(图6A)。利用小鼠、猪MI模型数据分别对NPTX2的诊断效能进行外部验证,结果表明NPTX2在两个数据集的AUC(95%CI)值分别达到了0.972(0.895~1.000)和0.963(0.882~1.000),诊断效能较高(图6B、C)。
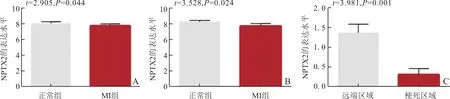
A、B:分别为正常小鼠和MI小鼠48 h和8周心肌组织NPTX2的表达;C:猪MI模型心肌远端区域和梗死区域NPTX2的表达
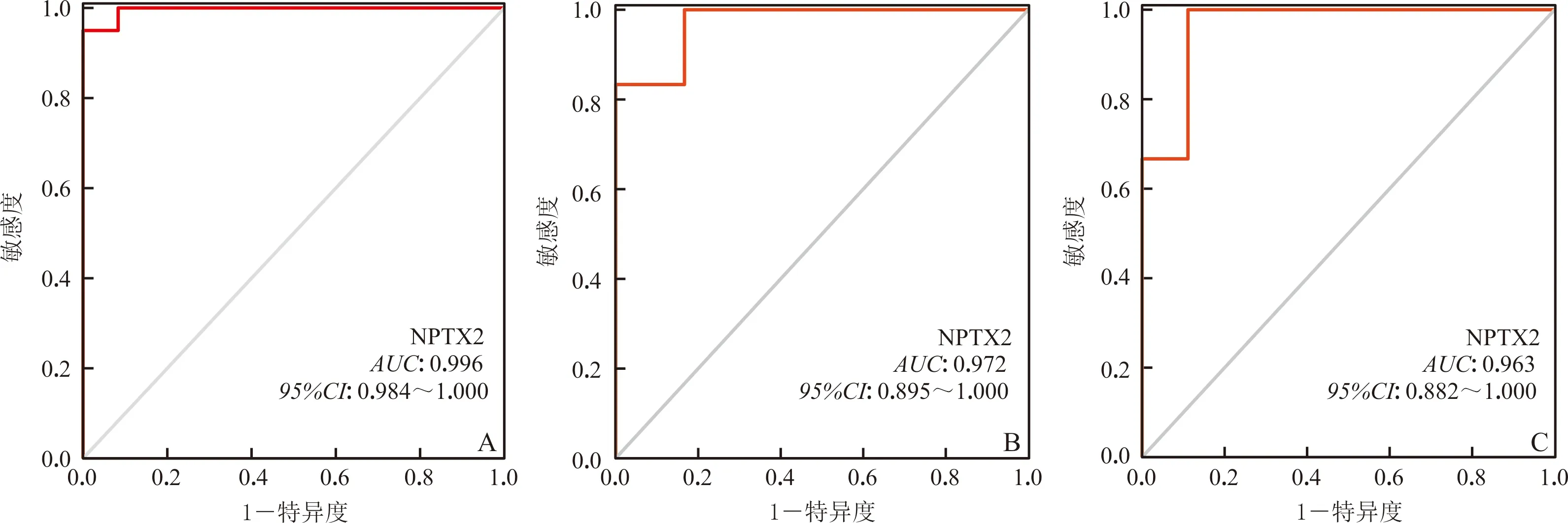
A、B、C:基于人、小鼠、猪的数据所得的NPTX2的ROC曲线
2.5 关键基因的GSEANPTX2在低表达组中未富集到阳性基因集;在高表达组中富集到了19个阳性基因集,主要涉及心肌收缩、氨基酸代谢、鞘脂类代谢、细胞凋亡、谷胱甘肽代谢、烟酸盐和烟酰胺代谢等(图7)。
3 讨论
VRpMI可导致心功能恶化、心力衰竭、恶性心律失常,甚至心源性死亡,是影响MI后心脏事件发生率和远期预后的主要因素。现阶段的研究[7,17]发现心肌肥大、心肌纤维化、炎症免疫反应、能量代谢紊乱、细胞凋亡、自噬和焦亡、神经内分泌系统的激活等介导了VRpMI,但其详细的作用机制仍不清楚。因此,积极阐释VRpMI的病理机制,对于预防、延缓甚至逆转心室重构至关重要。
本研究共鉴定出355个重要DEG,它们可通过调控炎症免疫反应、细胞外基质结构成分、Apelin、PI3K-Akt、松弛素等通路和生物学功能介导VRpMI的病理过程。研究[18]显示,Apelin具有抗氧化应激、抗肾素血管紧张素醛固酮系统、正性肌力等作用,参与了心肌肥厚、心力衰竭、高血压、动脉粥样硬化、VRpMI等疾病的病理过程,Apelin介导的药物治疗可能会在VRpMI患者中发挥重要作用。PI3k-Akt信号通路是多个小分子药物治疗VRpMI的靶点,其参与VRpMI的主要病理机制与抗氧化应激、调控自噬水平、减少心肌细胞凋亡和炎症反应等有关[19-21]。此外,松弛素可通过减少心肌细胞凋亡和心肌纤维化胶原沉积来延缓VRpMI[22]。通过文献复习,我们不难发现这些重要DEG介导VRpMI的分子机制与既往文献报道的结果存在一些吻合,这在一定程度上佐证了本研究结果的科学性和准确性。
VRpMI可分为早期和晚期重构,早期重构常在MI后72 h内发生,以梗死面积扩大和心室腔扩张、心肌细胞坏死及心肌顿抑等为特点;晚期重构通常在数周内发生,可以延续数月甚至1 a,以心肌细胞肥大、凋亡和弥漫性纤维化等为主要表现[4]。目前,VRpMI的诊断尚无统一明确的标准,一些生物标志物如N末端B型利钠肽前体、半乳糖凝集素-3、可溶性ST2等在预测VRpMI方面表现出一定的应用价值[4,23]。本研究利用 LASSO、SVM-RFE算法从355个重要DEG中鉴定出了1个VRpMI的潜在生物标志物NPTX2,并发现其在早期重构和晚期重构阶段均处于低表达水平。同时,本研究绘制了依据内部数据和外部数据的NPTX2诊断VRpMI的ROC曲线,发现AUC值均大于0.9,说明NPTX2在诊断VRpMI方面具有良好的效能。
NPTX2又称调节神经元活动的正五聚蛋白,为正五聚蛋白的一个超家族成员,是一种分泌性糖蛋白。Hsu等[24]于1995年首次报道了NPTX2基因,发现其位于人染色体7q21.3-q22.1,长度为11 000 bp,含有4个内含子。NPTX2在人体分布广泛,涉及脑、心、肝、胰、睾丸等多种器官,但起初其功能研究多集中于神经系统[25]。近年来,随着研究的不断深入,发现NPTX2与焦虑[26]、遗传额颞叶痴呆[27]、血管性痴呆[28]、阿尔茨海默病[29-30]、癌症[31]等多种疾病密切相关,甚至可以作为它们的生物标志物。本研究创新性地确证了NPTX2在MI组织低表达,可能是VRpMI潜在的生物标志物。为了进一步阐释NPTX2介导VRpMI病理过程可能的作用机制,本研究对NPTX2开展了单基因GSEA。结果提示,NPTX2可能通过调控心肌收缩、氨基酸代谢、鞘脂类代谢、细胞凋亡、谷胱甘肽代谢、烟酸盐和烟酰胺代谢等信号通路介导VRpMI的病理过程。心肌细胞减少为VRpMI的主要原因之一,而心肌细胞凋亡是导致心肌细胞数量减少的重要原因。研究[32-33]显示,NPTX2低表达可促进骨肉瘤细胞和胃癌细胞的凋亡;而其过表达可诱导神经胶质瘤细胞和胰腺癌细胞的凋亡[34-35]。以上结果提示,NPTX2可调控细胞凋亡,并表现出了双重性的特点。现阶段,除了细胞凋亡外,我们尚未见NPTX2调控其他信号通路的相关报道。
本研究尚存在一定的局限性,主要体现在以下方面:①目前,在GEO数据库中满足研究疾病为VRpMI、检测组织为人心肌组织的样本偏少,且数据集单一,最终导致本研究纳入分析的样本量有限。②VRpMI与性别、年龄、糖尿病、高血压、血脂异常、心肌梗死部位、是否为多支血管病变以及是否合并瓣膜病等因素密切相关,但由于GSE132143数据集中样本临床信息不完善,导致在WGCNA时无法分析基因模块与以上临床信息的关联性,限制了后续有针对性的研究。③基于有限的样本量,为了保证结果的可靠性和精准性,本研究分别采用了WGCNA、LASSO和SVM-RFE算法来鉴定关键基因;同时,利用小鼠和猪的数据对挖掘出的关键基因在VRpMI病理过程中的表达水平和诊断效能进行了外部验证。即使如此,本研究结果仍需在后续临床实践过程中进行佐证。
总之,本研究利用不同的机器学习算法和生物信息学相结合的方法,发现NPTX2在VRpMI病理过程中处于低表达水平,确定了其可能为VRpMI的潜在生物标志物。本研究结果为后续进一步深入探索VRpMI的病理机制、开发新型诊断生物标志物及VRpMI的治疗提供了新的思路和切入点。

