进展期胃癌免疫治疗不良反应的相关因素及预后分析
韩 婷,吕纯鑫,卓 萌,夏 青,刘腾飞,吴秀奇,林晓琳#,肖秀英#
1.上海交通大学医学院附属仁济医院肿瘤科,上海 200127;2.上海市浦东新区浦南医院肿瘤科,上海 200120
与世界范围的发病率、死亡率不同,我国胃癌的发病率位居恶性肿瘤第二位、死亡率位居第三位,具有明显的地域特征[1-2]。大多数胃癌患者在确诊时存在局部或远处转移,已无手术治愈的机会,只能通过综合治疗延长其生存期,包括姑息性化学治疗(化疗)和/或靶向药物治疗;但该类疗法的获益较为有限,患者的中位生存期仅约1年[3]。近年来,免疫治疗在肺癌、肾癌等多个实体瘤中取得了较好的治疗效果[4-5],也给胃癌患者的治疗带来了新的希望[6-7]。 基于ATTRACTION-02研究,纳武利尤单抗(Nivolumab)已在日本、韩国等获批胃癌三线治疗适应证[8],而CHECKMATE-649研究也将胃癌化疗联合免疫治疗正式进入一线治疗行列[9]。在全球范围内,胃癌的新辅助免疫治疗的临床试验(如KEYNOTE-585)正在进行中。程序性死亡蛋白-1(programmed death-1,PD-1)抑制剂主要用于阻断PD-1/PD-L1(程序性死亡蛋白配体-1,programmed death ligand-1)信号通路,通过解除对T细胞的抑制来发挥抗肿瘤效应。其主要的免疫相关不良反应(immune-related adverse events,irAEs)包括皮肤反应、呼吸系统毒性、胃肠道反应、心脏相关反应、内分泌系统毒性等。当下,胃癌免疫治疗的irAEs报道多见于国内外的Ⅰ~Ⅲ期临床研究。然而,临床研究有严格的入组条件,与实际的临床应用之间仍存在一定的差距。目前,关于中国人群临床真实世界的irAEs数据报道相对较少,尤其是在国产PD-1抑制剂的安全性方面。因此,本研究对进展期胃癌患者使用PD-1抑制剂的irAEs发生情况及与免疫疗效的相关性进行分析,并构建预测模型,分析irAEs与患者预后的关系,以期为该类患者治疗方案的个体化选择提供理论依据。
1 对象与方法
1.1 研究对象及其临床特征收集
本研究为回顾性研究,纳入2018 年6 月—2021年10 月于上海交通大学医学院附属仁济医院肿瘤科应用PD-1抑制剂治疗的进展期胃癌患者140例。
收集患者的临床特征:①一般人口学资料,包括年龄(考虑到老年患者与年轻患者免疫状态间的差异,以65 岁作为分类界限)、性别、治疗线数。②肿瘤基本特征,包括TNM 分期、Ki-67指数、人表皮生长因子受体-2 (human epidermal growth factor receptor 2,Her-2)表达、PD-1/PD-L1 表达、错配修复(mismatch repair,MMR)蛋白表达。③接受PD-1 抑制剂治疗前的实验室检测指标,包括肿瘤标志物[甲胎蛋白(alpha-fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原19-9(carbohydrate antigen 19-9, CA19-9)、 CA125、CA153、CA724、细胞角质蛋白19 片段抗原21-1(cyto-keratin 19 fragment antigen 21-1,CYFRA21-1)、CA50、CA242、鳞状细胞癌抗原(squamous cell carcinoma antigen,SCC)、神经元特异性烯醇化酶(neuron specific enolase,NSE)、前列腺特异性抗原(prostate specific antigen,PSA)]、内分泌相关指标[甲状腺相关激素、生长激素、性激素6 项、皮质醇、促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、淀粉酶]、抗核抗体(antinuclear antibody,ANA)表达、血常规指标[白细胞计数、中性粒细胞计数、单核细胞计数、淋巴细胞计数、C 反应蛋白(C-reactive protein,CRP)水平、中性粒细胞计数/淋巴细胞计数、中性粒细胞计数/CRP、白细胞计数/CRP]、淋巴细胞亚群[分化抗原19 (cluster of differentiation 19,CD19)、CD3、CD4、CD8、CD4/CD8、CD56]、细胞因子水平[调节性T 细胞(regulatory T cell,Treg)、干扰素-α(interferon-α,IFN-α)、白介素-17(interleukin-17,IL-17)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-2、IL-4、IL-6、IL-8、IL-10]。
1.2 随访与分组
随访开始于患者接受第1 次免疫治疗后,截止于2021 年12 月30 日。随访期间,记录患者的irAEs 表现(包括发生时间、严重程度和预后)、无进展生存期(progression-free survival, PFS)、 总 生 存 期(overall survival,OS);每2~3 个治疗周期,对患者的免疫治疗相关的血液学指标和肿瘤病灶的影像学进行评估。同时,根据期间患者是否发生irAEs,将其分为irAEs组与非irAEs组。
采用美国国家癌症研究所通用不良事件术语标准(Common Terminology Criteria for Adverse Events,CTCAE)4.0 版本中的分级、分类标准[10],对irAEs进行评估。同时,根据严重程度的不同将irAEs 分为4 个等级:1 级为轻度,无症状或轻微,无需治疗,可继续免疫治疗;2 级为中度,需局部性治疗,或在门诊实施局部或口服糖皮质激素治疗,并暂缓免疫治疗;3 级为严重或医学上有重要意义但不危及生命,需住院治疗,进行系统性糖皮质激素治疗,若激素治疗不佳可考虑使用免疫抑制剂,同时需根据风险/收益评估结果,考虑是否继续免疫治疗;4 级为危及生命,需紧急治疗,或永久停止免疫治疗,同时系统使用糖皮质激素和其他免疫抑制剂。
1.3 治疗方案及疗效评估
所有患者均经静脉输液行PD-1抑制剂免疫治疗,联合或不联合化疗/靶向治疗。使用实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1 版本对患者的疗效进行评估,包括客观缓解率(objective response rate,ORR)、疾病控制率(disease control rate, DCR)、 部 分 缓 解(partial response,PR)、病情稳定(stable disease,SD)、疾病进展(progressive disease,PD)等。
1.4 统计学方法
使用SPSS 23.0、GraphPad Prism 9.0 软件进行数据分析。对定量资料的正态分布进行检验,如符合正态分布,以表示并采用Student'st检验进行组间比较;如不符合正态分布,以M(Q1,Q3)表示并采用Mann-WhitneyU检验进行组间比较。定性资料以频数(百分比)表示,采用χ2检验或Fisher 精确检验进行分析。采用多因素Logistic 回归模型分析影响irAEs的相关因素,并建立irAEs的预测模型。运用受试者操作特征曲线(receiver operating characteristic curve,ROC curve,ROC 曲线)验证模型的预测能力,并计算曲线下面积(area under the curve,AUC)。通过Hosmer-Lemeshow 检验预测模型的拟合度。采用Kaplan-Meier 生存曲线分析irAEs 与预后的相关性。采用Cox比例风险模型分析影响预后的相关因素。P<0.05表示差异具有统计学意义。
2 结果
2.1 患者分组及临床特征分析
在140 例患者中,共计132 例完成随访并纳入研究。在接受PD-1 抑制剂治疗期间,有63 例(47.7%)患者发生irAEs,记为irAEs 组,其余69 例患者记为非irAEs 组。对2 组患者的临床特征进行分析,结果(表1)发现年龄≥65 岁、Ki-67 指数、白细胞计数、中性粒细胞计数、Treg计数的组间差异具有统计学意义(均P<0.05)。
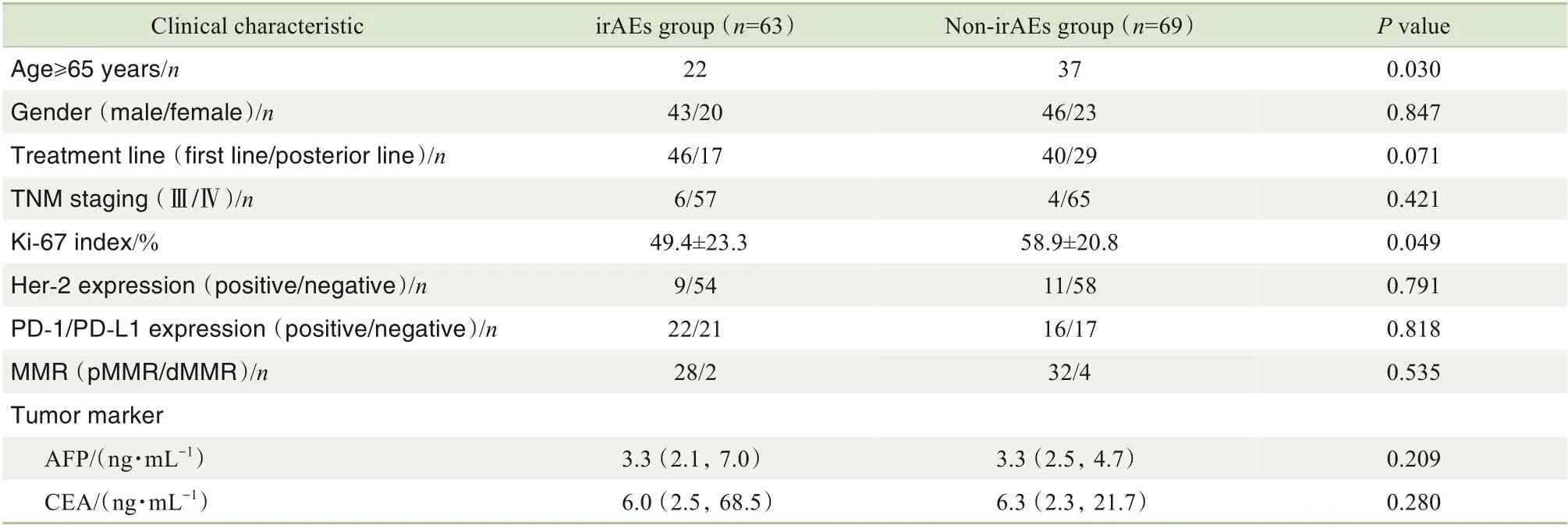
表1 2组患者的临床特征比较Tab 1 Comparison of clinical characteristics between the two groups
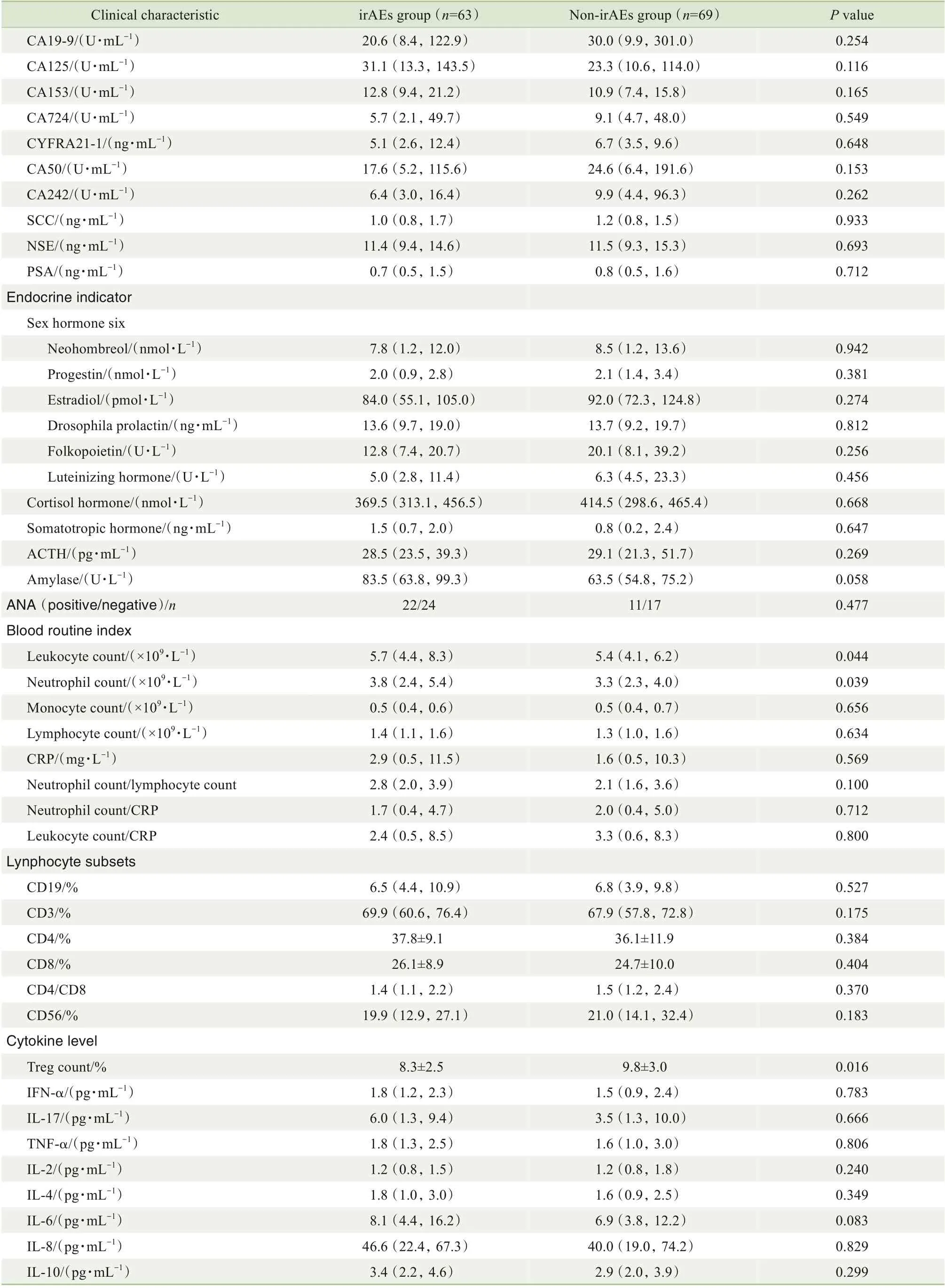
续表
2.2 影响irAEs发生的多因素Logistic回归分析
为进一步分析影响irAEs 发生的相关因素,将上述有统计学意义的5 个变量纳入多因素Logistic 回归分析,结果(表2)显示Treg 计数是影响irAEs 发生的保护因素(P=0.030)。
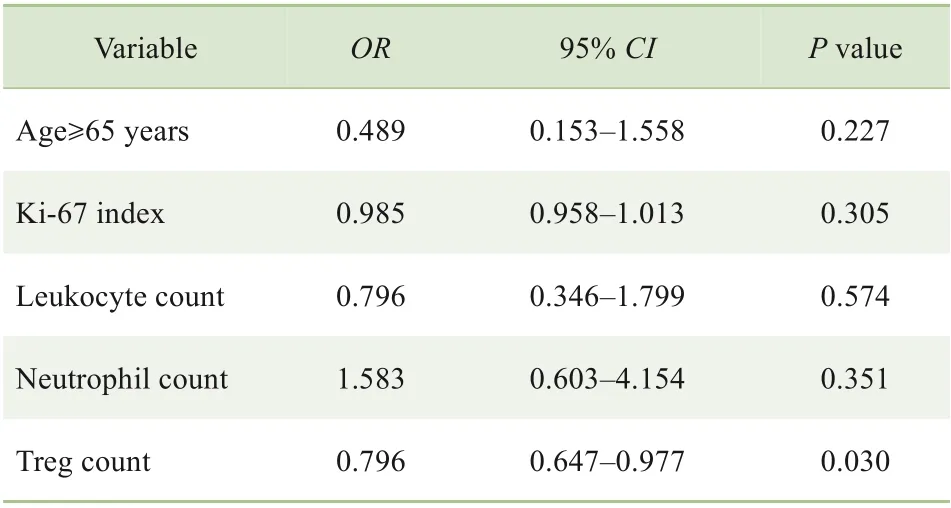
表2 影响irAEs发生的多因素Logistic回归分析Tab 2 Multivariate Logistic regression analysis of the occurrence of irAEs
2.3 患者irAEs的表现
对irAEs组患者进行统计后发现,irAEs的发生多见于治疗后1~24 周,最常见于1~12 周;不同irAEs的起始时间各异,具体见图1。
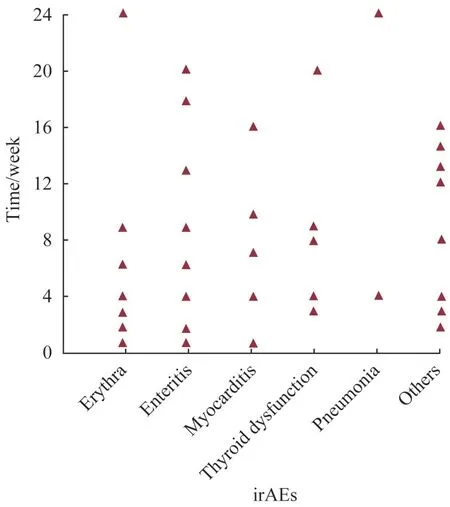
图1 不同irAEs发生的时间分布Fig 1 Occurrence time of different irAEs
在该组的irAEs 中,发生率最高的为皮疹(皮肤反应)。其中,1~2 级患者给予口服激素治疗或暂停相关药物后有好转,3~4 级患者给予静脉激素治疗后好转,4级患者经治疗缓解后永久停止使用PD-1抑制剂治疗。irAEs 组患者的不良反应谱及分级见表3。
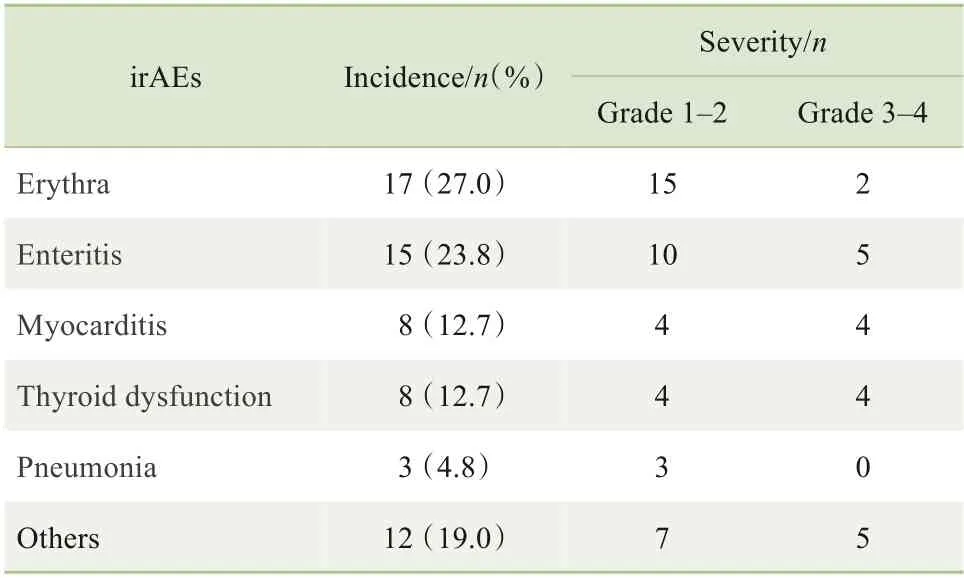
表3 irAEs组患者的不良反应谱及分级(n=63)Tab 3 Adverse reaction spectrum and classification of patients in the irAEs group(n=63)
2.4 irAEs独立预测因子的筛选及预测模型的验证
基于上述分析,我们采用ROC 曲线对影响irAEs 发生的多个单因素及其互相联合指标的预测能力进行验证,结果(图2) 显示,Treg+年龄(≥65 岁)+Ki-67+白细胞计数的联合指标、Treg+年龄(≥65 岁) +Ki-67 的联合指标预测能力均较好(均AUC>0.75),且两联合指标间差异无统计学意义(P=0.802)。考虑到较少因素组成的联合指标更符合临床应用需求,因此本研究选则后者联合指标对irAEs 发生进行预测。随后,Hosmer-Lemeshow 检验提示,Treg+年龄(≥65 岁) +Ki-67 作为预测irAEs 发生的联合变量拟合优度较好,可作为预测irAEs 发生的联合变量。

图2 2个联合指标预测irAEs发生的ROC曲线Fig 2 ROC curve of predicting irAEs with two combined indexes
2.5 患者的疗效评估与预后分析
本研究采用RECIST 1.1版本对所有患者的疗效进行评估,结果发现29例(22.0%)患者发生PR,74例(56.0%)患者为SD,29例(22.0%)患者发生PD;总人群的ORR 为22.0%,DCR 为78.0%。同时,对2 组患者的疗效进行比较,结果(表4)显示PR率、PD率的组间差异均具有统计学意义(均P<0.05)。
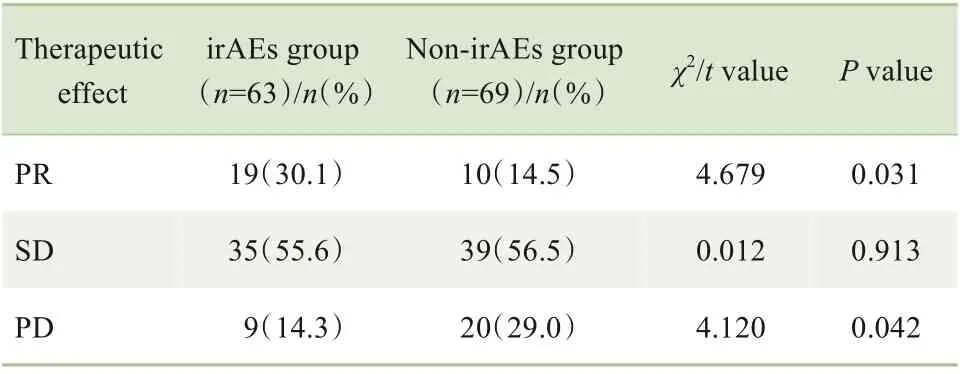
表4 2组患者的疗效比较Tab 4 Comparison of therapeutic effects between the two groups
对2 组患者的PFS、OS 分别行Kaplan-Meier 生存分析,结果(图3)显示,irAEs 组患者的PFS 较非irAEs组有延长(P=0.001),且中位PFS分别为5(5,6)个月、3(3,5)个月;而irAEs 组患者的OS 与非irAEs组间差异无统计学意义(P=0.054),中位OS分别为7(6,8)个月、6(5,7)个月。

图3 2组患者PFS(A)、OS(B)的Kaplan-Meier曲线分析Fig 3 Kaplan-Meier analysis of PFS(A)and OS(B)of patients in the two groups
随后,我们从患者的临床特征中选取常见的影响肿瘤预后(PFS、OS)的因素(如年龄≥65 岁、性别、治疗线数、TNM 分期、Her-2 表达及irAEs)进行Cox 比例风险分析,结果(表5)显示irAEs 是患者PFS 的影响因素(P=0.006);而在OS 的影响因素中,未发现任何具有统计学意义的因素。

表5 影响肿瘤预后因素的Cox比例风险回归分析Tab 5 Cox proportional hazards regression analysis of prognostic factors of cancer
3 讨论
研究[11]显示,PD-1/PD-L1 抑制剂可阻断T 细胞上的PD-1 受体与其配体PD-L1 之间的相互作用,从而恢复T 细胞的功能,增强其对肿瘤细胞的杀伤能力。然而,过度激活的T细胞可引起自身免疫介导的不良反应,对机体各系统、组织产生免疫性损伤即为irAEs[12]。目前,有关irAEs 的研究相对较少。基于此,我们对使用PD-1 抑制剂的进展期胃癌患者的irAEs 的发生及其影响因素、各因素与疗效之间的关系进行了回顾性分析。
在本研究分析的132 例患者中irAEs 的发生率为47.7%,这与既往研究[13](irAEs 的发生率约50%)结果类似。irAEs 的发生时间通常与受累器官相关,从早期发生(免疫治疗后第1 周)至延迟事件(免疫治疗后26 周),主要发生时间窗为4~12 周[14]。本研究发现,irAEs多在治疗后1~24周发生,最常见于1~12 周,与文献[15]报道相符;且在irAEs 组中,发生率最高的是皮疹(占27.0%),与既往研究[16-17]报道(发生率为30%)相近。同时,本研究患者的不良反应多为1~2 级以及非重要脏器的3 级(包括皮疹、甲状腺功能异常),经治疗后均可缓解。因此,在进展期胃癌中的PD-1 抑制剂免疫治疗毒性可管理、安全性较好。
在对患者临床特征的组间比较中,我们发现年龄≥65岁、Ki-67、白细胞计数、中性粒细胞计数、Treg计数是影响患者irAEs 发生的相关因素;多因素Logistic 回归分析发现,Treg 计数为其发生的独立影响因素。而有趣的是,年龄≥65 岁是irAEs 发生的保护性因素,说明年轻人更易出现irAEs;这一现象可能与免疫衰老相关,即年龄的增加可导致造血干细胞向髓样分化增多,且淋巴细胞的生成途径受到抑制[18]使得Treg 计数显著增加[19],从而降低了irAEs的发生。WANG 等[20]的研究发现,Ki-67 指数与肿瘤浸润淋巴细胞有关,即Ki-67 指数越低、肿瘤浸润淋巴细胞越高,这可能会增加irAEs 的发生。目前,有关Ki-67 与irAEs 的研究较少,尚无法明确Ki-67 指数与irAEs 之间的关系,因此仍需更多的研究来验证。
值得注意的是,在我们的研究中,外周血细胞中只有白细胞计数、中性粒细胞计数与irAEs 的发生相关,而淋巴细胞计数、中性粒细胞计数/淋巴细胞计数等均与irAEs的发生无关。这也与FUJISAWA等[21]研究的结果(即肺、胃肠道的黑色素瘤中白细胞计数、中性粒细胞计数升高均与irAEs 发生率相关)相符。但DIEHL等[22]的研究却发现,淋巴细胞计数及中性粒细胞计数/淋巴细胞计数也与irAEs 的发生有关,且淋巴细胞计数越高、irAEs的发生概率也越高。因此,有关外周血细胞与irAEs 之间关系尚需更多的临床研究进一步探讨。
有研究[23-24]发现,Treg在irAEs中发挥着重要作用,而irAEs 的发生与免疫系统的异常激活、T 细胞的活化均密切相关。Treg及其表面表达的多种检查点分子对免疫耐受的维持至关重要,其动态平衡的丧失可导致irAEs的发生[25]。同时,免疫治疗作用可通过肿瘤微环境中抗体依赖细胞介导的细胞毒作用使Treg发生耗竭,进而引起irAEs的发生[26]。这与本研究的结果相符,即Treg 计数是影响irAEs 发生的唯一因素。
目前,根据CTCAE 5.0 版本,将irAEs 的严重程度分为1~4 级。其中,大部分1~2 级irAEs 症状较轻者无需终止免疫治疗,少部分2 级irAEs 症状较重者可口服或静脉使用糖皮质激素治疗[27];而3~4 级irAEs特别是危及生命安全的4 级irAEs者,相关指南中建议终止免疫治疗[28]。如经过系统性治疗仍存在3~4级irAEs的患者,当其恢复到1级后是否再次尝试行免疫治疗目前尚存在争议,还需在综合判断获益与风险的前提下谨慎使用[28]。同时,一项针对因irAEs较重而暂停免疫治疗的患者的研究[29]发现,再次行免疫治疗后,约70%患者会再次出现原先级别的irAEs。因此,尽早发现irAEs对患者治疗策略、预后影响等至关重要;且能否通过临床标志物尽早预测irAEs 的发生,将是目前关注的焦点。在本研究构建的irAEs预测模型中,通过ROC曲线验证发现,使用Treg+Ki-67+年龄(≥65 岁)联合指标预测irAEs 发生有较高的敏感度。在未来的诊疗过程中,此模型或可为患者行免疫治疗的风险进行评估,因而具有一定的临床意义。
在DOWNEY 等[30]发现黑色素瘤患者应用PD-1抑制剂治疗,发生irAEs 的患者的治疗效果更好之后,近年来irAEs 与疗效间的关系逐渐得到了证实[31-33]。在本研究的132 例进展期胃癌患者中,irAEs 组患者的PFS 优于非irAEs 组而OS 未见获益;究其原因,可能是由于本研究将PFS、OS 的截断值均定义为2022 年1 月,其中有36 例(27.3%)患者未达到研究终点所致。因此,本研究获得的PFS、OS并不一定能完全反映出胃癌免疫治疗的真实生存数据。后续,我们还将对这部分患者继续随访,进行数据更新。
本研究尚有一些不足之处:①为单中心、小样本、回顾性研究,研究结论还需要前瞻性随机对照研究加以验证。②部分指标未纳入研究,如嗜酸性粒细胞、乳酸脱氢酶等,且有部分指标的数据缺失导致数据分析不够完整,后续将对相关数据加以补充。③部分irAEs 表现过于主观,比如瘙痒、乏力等,可能会导致irAEs 分组不准确。因此,后续需对irAEs 的表现及分级严格把关,并扩大样本量、减少上述误差等,以提升研究的可靠性。
利益冲突声明/Conflict of Interests
所有作者声明不存在利益冲突。
All authors disclose no relevant conflict of interests.
伦理批准和知情同意/Ethics Approval and Patient Consent
本研究已通过上海交通大学医学院附属仁济医院伦理委员会审批(审批号:KY-2019-123)。所有实验过程均遵照《赫尔辛基宣言》的条例进行。受试对象或其亲属已经签署知情同意书。
The study was reviewed and approved by Ethics Committee of Renji Hospital,Shanghai Jiao Tong University School of Medicine(No.KY-2019-123). All experimental protocols were carried out by following theDeclaration of Helsinki. Consent letters have been signed by the research participants or their relatives.
作者贡献/Authors'Contributions
肖秀英与林晓琳参与实验设计;韩婷与吕纯鑫参与论文的撰写与修改;卓萌与夏青参与数据的统计分析;刘腾飞与吴秀奇参与了数据收集。所有作者均阅读并同意了最终稿件的提交。
The study was designed by XIAO Xiuying and LIN Xiaolin. The manuscript was drafted and revised by HAN Ting and LÜ Chunxin.Statistical analysis was performed by ZHUO Meng and XIA Qing.Data collection was performed by LIU Tengfei and WU Xiuqi.All the authors have read the last version of paper and consented for submission.
·Received:2022-03-11
·Accepted:2022-07-03
·Published online:2022-08-12
参·考·文·献
[1] CAO W, CHEN H D, YU Y W, et al. Changing profiles of cancer burden worldwide and in China: a secondary analysis of the global cancer statistics 2020[J]. Chin Med J(Engl),2021,134(7):783-791.
[2] SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer statistics,2022[J]. CA Cancer J Clin,2022,72(1):7-33.
[3] SMYTH E C,NILSSON M,GRABSCH H I,et al. Gastric cancer[J].Lancet,2020,396(10251):635-648.
[4] AHERN E, SOLOMON B J, HUI R N, et al. Neoadjuvant immunotherapy for non-small cell lung cancer: right drugs, right patient,right time?[J]. J Immunother Cancer,2021,9(6):e002248.
[5] COSMAI L,PIROVANO M,RE SARTÒ G V,et al. Immunotherapy in kidney cancer: how it has changed and what are the challenges for the nephrologist - focus on pembrolizumab[J]. G Ital Nefrol, 2021,38(5):2021-vol5.
[6] JOSHI S S,BADGWELL B D. Current treatment and recent progress in gastric cancer[J]. CA Cancer J Clin,2021,71(3):264-279.
[7] LI K X, ZHANG A, LI X Y, et al. Advances in clinical immunotherapy for gastric cancer[J]. Biochim Biophys Acta Rev Cancer,2021,1876(2):188615.
[8] KANG Y K, BOKU N, SATOH T, et al. Nivolumab in patients with advanced gastric or gastro-oesophageal junction cancer refractory to,or intolerant of, at least two previous chemotherapy regimens (ONO-4538-12, ATTRACTION-2): a randomised, double-blind, placebocontrolled,phase 3 trial[J]. Lancet,2017,390(10111):2461-2471.
[10] Department of Health and Human Services, National Institutes of Health,National Cancer Institute. Common Terminology Criteria for Adverse Events (CTCAE) Version 4.0[EB/OL]. (2009-05-28)[2022-03-10]. https://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03/Archive/CTCAE_4.0_2009-05-29_QuickReference_8.5x11.pdf.
[11] BORST J, BUSSELAAR J, BOSMA D M T, et al. Mechanism of action of PD-1 receptor/ligand targeted cancer immunotherapy[J].Eur J Immunol,2021,51(8):1911-1920.
[12] BAJWA R,CHEEMA A,KHAN T,et al. Adverse effects of immune checkpoint inhibitors (programmed death-1 inhibitors and cytotoxic T-lymphocyte-associated protein-4 inhibitors): results of a retrospective study[J]. J Clin Med Res,2019,11(4):225-236.
[13] TOPALIAN S L, HODI F S, BRAHMER J R, et al. Safety, activity,and immune correlates of anti-PD-1 antibody in cancer[J]. N Engl J Med,2012,366(26):2443-2454.
[14] YEUNG S J, QDAISAT A, CHAFTARI P, et al. Diagnosis and management of immune-related adverse effects of immune checkpoint therapy in the emergency department[J]. J Am Coll Emerg Physicians Open,2020,1(6):1637-1659.
[15] MARTINS F, SOFIYA L, SYKIOTIS G P, et al. Adverse effects of immune-checkpoint inhibitors: epidemiology, management and surveillance[J]. Nat Rev Clin Oncol,2019,16(9):563-580.
[16] KUMAR V, CHAUDHARY N, GARG M, et al. Current diagnosis and management of immune related adverse events (irAEs) induced by immune checkpoint inhibitor therapy[J]. Front Pharmacol, 2017,8:49.
“四水同治”就是高效利用水资源、系统修复水生态、综合治理水环境、科学防治水灾害。针对存在的新老水问题,河南提出,今后各级各部门要协同联动,统筹治理水资源、水生态、水环境、水灾害,改善水生态。今后一个时期,河南将围绕实施国家节水行动、扎实推进河湖管理与保护、充分发挥南水北调工程综合效益、全面提升引黄供配水能力、加快推进重大水利工程建设、实施地下水超采区综合治理、加强水灾害防治、强化乡村水利基础设施建设、科学调配水资源、加快智慧水利建设等十方面重点任务展开“治水”。
[17] APALLA Z, RAPOPORT B, SIBAUD V. Dermatologic immunerelated adverse events: the toxicity spectrum and recommendations for management[J]. Int J Womens Dermatol, 2021, 7(5Part A):625-635.
[18] PANG W W, PRICE E A, SAHOO D, et al. Human bone marrow hematopoietic stem cells are increased in frequency and myeloidbiased with age[J]. Proc Natl Acad Sci USA, 2011, 108(50): 20012-20017.
[19] KUGEL C H 3rd, DOUGLASS S M, WEBSTER M R, et al. Age correlates with response to anti-PD1,reflecting age-related differences in intratumoral effector and regulatory T-cell populations[J]. Clin Cancer Res,2018,24(21):5347-5356.
[20] WANG Y H, ZONG B G, YU Y, et al. Ki67 index changes and tumor-infiltrating lymphocyte levels impact the prognosis of triplenegative breast cancer patients with residual disease after neoadjuvant chemotherapy[J]. Front Oncol,2021,11:668610.
[21] FUJISAWA Y, YOSHINO K, OTSUKA A, et al. Fluctuations in routine blood count might signal severe immune-related adverse events in melanoma patients treated with nivolumab[J]. J Dermatol Sci,2017,88(2):225-231.
[22] DIEHL A, YARCHOAN M, HOPKINS A, et al. Relationships between lymphocyte counts and treatment-related toxicities and clinical responses in patients with solid tumors treated with PD-1 checkpoint inhibitors[J]. Oncotarget,2017,8(69):114268-114280.
[23] TANAKA A, SAKAGUCHI S. Targeting Treg cells in cancer immunotherapy[J]. Eur J Immunol,2019,49(8):1140-1146.
[24] LIU X Y,SHI Y Q,ZHANG D M,et al. Risk factors for immune-related adverse events:what have we learned and what lies ahead?[J]. Biomark Res,2021,9(1):79.
[25] GREISEN S R, DELEURAN B. Checkpoint molecules in rheumatology-or the benefits of being exhausted[J]. Curr Rheumatol Rep,2021,23(4):22.
[26] VARGAS F A, FURNESS A J S, LITCHFIELD K, et al. Fc effector function contributes to the activity of human anti-CTLA-4 antibodies[J].Cancer Cell,2018,33(4):649-663.e4.
[27] 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会指南工作委员会(CSCO)免疫检查点抑制剂临床应用指南2021[M]. 北京:人民卫生出版社,2021:1-176.Guidelines Working Committee of Chinese Society of Clinical Oncology. Guidelines of Chinese Society of Clinical Oncology(CSCO) immune checkpoint inhibitor clinical practice[M]. Beijing:People's Medical Publishing House,2021:1-176.
[28] THOMPSON J A,SCHNEIDER B J,BRAHMER J,et al. Management of immunotherapy-related toxicities,version 1.2019[J]. J Natl Compr Cancer Netw,2019,17(3):255-289.
[29] ALLOUCHERY M, LOMBARD T, MARTIN M, et al. Safety of immune checkpoint inhibitor rechallenge after discontinuation for grade ≥2 immune-related adverse events in patients with cancer[J].J Immunother Cancer,2020,8(2):e001622.
[30] DOWNEY S G, KLAPPER J A, SMITH F O, et al. Prognostic factors related to clinical response in patients with metastatic melanoma treated by CTL-associated antigen-4 blockade[J]. Clin Cancer Res,2007,13(22 Pt 1):6681-6688.
[31] RZEPECKI A K, CHENG H Y, MCLELLAN B N. Cutaneous toxicity as a predictive biomarker for clinical outcome in patients receiving anticancer therapy[J]. J Am Acad Dermatol, 2018, 79(3):545-555.
[32] NAKAMURA Y,TANAKA R,ASAMI Y, et al. Correlation between vitiligo occurrence and clinical benefit in advanced melanoma patients treated with nivolumab: a multi-institutional retrospective study[J]. J Dermatol,2017,44(2):117-122.
[33] ROGADO J, SÁNCHEZ-TORRES J M, ROMERO-LAORDEN N,et al. Immune-related adverse events predict the therapeutic efficacy of anti-PD-1 antibodies in cancer patients[J]. Eur J Cancer, 2019,109:21-27.

