葫芦多糖及其硫酸化修饰物抗新城疫病毒活性
阿得力江·吾斯曼,萨比热·热夏提,希尔艾力·阿不力克木,况 玲,赛福丁·阿不拉
(新疆农业大学 动物医学学院,新疆 乌鲁木齐 830052)
葫芦(Lagenariasiceraria(Molina)standl)是新疆及周边地区常用传统药材,据《本草纲目》记载“葫芦味苦、性寒、有小毒,可用于治疗黄疸肿满、头面肿大、风痰头痛、牙痛、恶疮癣癞、痔疮肿痛、耳出脓等一系列疾病[1]。《新疆中草药》记载,“葫芦具有清热消炎、润肠通便、安神催眠、利尿降糖等作用”[2]。葫芦也是热带地区国家广泛食用的蔬菜,据印度阿育吠陀药典记载葫芦是一种良好的补品,常作为保护心脏药、降血脂药、壮阳药、泻药和利尿药等使用[3-4]。印度及相邻国家葫芦也被用于治疗疼痛、溃疡、发烧、胸咳、哮喘和其他支气管疾病[5]。现代药理学研究表明,葫芦提取物具有抗肿瘤、抗病毒和抗人类免疫缺陷病毒(HIV)活性[3]。葫芦中四环萜类化合物具有良好的驱虫效果,在古巴等地区常用于驱除人体内圆线虫[6]。葫芦总多糖(Lagenariasiceraria(Molina)standl polysaccharide,LSP)能够通过提高小鼠红细胞C3b受体花环形成率,提高血清IL-2细胞因子的分泌,降低TGF-β1的表达,发挥免疫增强作用[7]。LSP对人乳腺癌细胞MCF-7有杀灭的作用[8]。
硫酸多糖(sulfated polysaccharide)是指一种羟基上含有硫酸根的多糖[9]。据报道,富含硫酸根的多糖具有良好的抗病毒、免疫增强、抗氧化等活性[9-10]。姚丽丽等[11]研究显示,紫锥菊多糖经硫酸化修饰后可增强鸡骨髓源树突细胞表面分子CD11c及MHC-Ⅱ的表达,促进NO、IL-2、IL-4及IFN-γ的分泌。银耳多糖和党参多糖经硫酸化修饰后可增强T淋巴细胞增殖作用,提高T淋巴细胞IL-2的mRNA表达水平[12]。研究显示少量植物药中含有一定量的硫酸多糖,大多数植物药中多糖成分为中性多糖[13]。植物药中的中性多糖可通过硫酸化修饰使部分羟基被硫酸基团取代,从而使中性多糖富含大量硫酸根,进而达到改变多糖活性的目的[10,14]。
为了检测硫酸化修饰对LSP抗新城疫病毒(NDV)活性的影响。本试验纯化得到LSP,并对LSP进行硫酸化修饰,通过3种不同的加药方式对LSP及其硫酸化修饰物进行体外抗NDV活性检测,旨在检测LSP及其硫酸化修饰物的抗NDV活性。
1 材料与方法
1.1 主要试剂BCA蛋白测定试剂盒、Hank's液、DMEM培养液、四甲基偶氮唑蓝MTT溶液、胰蛋白酶、PBS溶液均购自北京索莱宝生物科技有限公司;胎牛血清购自江苏恩莫阿赛生物技术有限公司;鸡新城疫系活疫苗购自吉林正业生物制品股份有限公司;9日龄SPF鸡胚购自北京梅里亚维通实验动物技术有限公司;鸡NDV来自NDVⅠ系活疫苗,TCID50为10-7。
1.2 LSP的提取参照文献[15]方法醇沉得到葫芦粗多糖,分别利用BCA法测定蛋白质含量、苯酚硫酸法测定多糖含量,后经Sephadex G-100进行纯化,收集第1个峰,得到LSP,利用BCA试剂盒测定LSP中蛋白含量、苯酚硫酸法测定LSP中糖含量,再将LSP用PBS溶液溶解后0.22 μm的微孔滤膜过滤除菌,4℃保存备用。
1.3 sLSP1.3的制备氯磺酸-吡啶法制备sLSP1.3:将25 mL、4℃预冷的吡啶倒入三颈烧瓶中,置于冰水浴上磁力搅拌,缓慢滴入5 mL氯磺酸,得到白色酯化试剂。取100 mg LSP,加到10 mL N,N-二甲基甲酰胺中。加入上述酯化试剂,80℃反应60 min得到sLSP1.3,采用明胶比浊法[16]测定sLSP1.3中硫酸根的取代度(DS)。
DS=(1.62×S%)/(32-1.02×S%),其中S%表示硫元素的质量分数。
1.4 LSP及sLSP1.3葫芦多糖官能团变化的红外光谱检测分别取2 mg LSP及sLSP1.3样品加入200 mg 溴化钾粉末中研磨均匀,倒入压片机中制备成薄片,利用红外光谱法扫描测定观察LSP及硫酸修饰后sLSP1.3官能团的变化。
1.5 LSP及sLSP1.3安全质量浓度的测定将制备好的LSP及sLSP1.3分别自50.00 mg/L倍比稀释至25.00,12.50 及6.25 mg/L,4个质量浓度分别加入长成单层的鸡胚成纤维细胞(CEF),48 h后,利用MTT法[16]测定D490值。D490值不小于细胞对照组(cell control,CC)的最大质量浓度为该多糖的最大安全质量浓度,同时将以不加药物的完全培养基组作为对照组。
1.6 LSP及sLSP1.3抗NDV感染作用的测定将LSP倍比稀释为40,20,10,5 mg/L 4个质量浓度梯度,sLSP1.3倍比稀释为10.00,5.00,2.50,1.25 mg/L 4个质量浓度梯度。分别通过3种不同加药方式和CEF共培养,第1组为先加多糖后接种病毒,待CEF长成单层后加入不同质量浓度的多糖100 μL/孔,培养4 h后弃掉孔内液体、洗涤3次,每孔加入100 μL 100 TCID50=10-5的病毒液,作用4 h 后弃掉孔内液体,洗涤3次,48 h后,采用MTT法测定D490值;第2组为先接种病毒后加多糖,将CEF单层细胞中加入病毒液100 μL/孔,作用2 h后弃掉孔内液体,洗涤3次,加入不同质量浓度药物多糖100 μL/孔,48 h后,按MTT法测定D490值;第3组为将不同质量浓度的药物多糖和100 TCID50病毒液充分混合4 h后加入CEF单层细胞中,48 h后,按MTT法测定D490值。每个质量浓度重复4个孔,同时设病毒对照组(virus control,VC,只加病毒)和CC(不做任何处理的CEF),并用不同D490值来判定3种加药方式下NDV对CEF感染力[16]。
1.7 动物分组及处理1日龄非免疫健康蛋公鸡(购自天康畜牧)随机均分为4组,每组30羽,分别为LSP、sLSP1.3的4 mg剂量组、VC组和空白对照组(blank control,BC)。21日龄时除空白对照组外其余每羽肌肉注射NDV液0.5 mL,攻毒隔天出现明显临床症状时,各组分别皮下注射相应多糖0.5 mL/羽,BC注射等量生理盐水,1次/d,连续3 d。
每天观察各组的临床症状,记录死亡情况。攻毒后14 d统计死亡率、痊愈率和保护率。分别于攻毒前1 d、攻毒后3,7,14 d每组随机抽取6只翅静脉采血,用β-微量法测定血清抗体效价。

2 结果
2.1 LSP的提取结果水提醇沉法提取后得到粗提LSP,苯酚硫酸法测得多糖含量为37.71%,BCA试剂盒检测蛋白含量为8.42%。通过葡聚糖凝胶柱Sephadex G-100对葫芦粗多糖进行纯化,收集11~35管,得到纯化后的LSP(图1),测得多糖含量为76.80%,蛋白含量为2.31%。表明经葡聚糖凝胶柱Sephadex G-100纯化后大多数蛋白被去除,同时多糖含量得到显著提高。

图1 LSP的Sephadex G-100洗脱图谱
2.2 LSP及sLSP1.3含量测定分别检测硫酸化前后LSP的多糖含量、蛋白含量及硫酸根取代度,结果显示,LSP经硫酸化修饰后得到sLSP1.3的多糖含量有所下降,LSP及sLSP1.3的多糖含量分别为76.80%和56.25%,蛋白含量分别为2.31%和2.18%,sLSP1.3的硫酸根取代度为1.285。表明硫酸化修饰后多糖中一些官能团被硫酸根所取代,多糖含量有所下降,而硫酸化修饰对蛋白含量无影响。
2.3 LSP及sLSP1.3的LSP官能团变化的红外光谱检测结果用红外光谱法检测硫酸化修饰前后LSP官能团的变化,以检测硫酸根是否成功连接至LSP上。结果显示,LSP及sLSP1.3均具有多糖的特征吸收峰,均在3 300~3 500 cm-1有强吸收峰,为多糖O-H基吸收峰,在2 900 cm-1左右中强吸收峰,为(-CH2-)C-H的伸缩吸收峰,以上2种吸收峰为多糖特征峰。LSP及sLSP1.3在1 600~1 700 cm-1之间的强吸收峰是-COOH基团中C=0的非对称伸缩吸收峰,1 400 cm-1左右的吸收峰为-OH吸收峰。sLSP1.3在1 219 cm-1的吸收峰为硫酸根吸收峰,1 000~1 100 cm-1的吸收峰为C-O的振动吸收峰,上述结果表明LSP为多糖类化合物,且其被硫酸根修饰获得了sLSP1.3(图2)。

A.LSP红外光谱图;B.sLSP1.3红外光谱图
2.4 LSP及sLSP1.3安全质量浓度检测结果采用MTT法检测LSP和sLSP1.3的安全质量浓度,结果显示,LSP在50.0 mg/L,sLSP1.3在12.5 mg/L时的D450值不低于此质量浓度下的细胞对照组(P>0.05,图3)。表明LSP在50.0 mg/L、sLSP1.3在12.5 mg/L 时对CEF无毒性,LSP经硫酸化修饰后sLSP1.3对CEF的毒性作用增强。为了便于比较,下述试验中取LSP的最高质量浓度为40.0 mg/L,sLSP1.3的最高质量浓度为10.0 mg/L。

注:同列数据标注不同字母示差异显著(P<0.05)。下同
2.5 先添加多糖后接种病毒时NDV对CEF感染力的检测结果待CEF长成单层后分别加入LSP和sLSP1.3,培养4 h后加入病毒液,48 h后,按MTT法测定D450值,检测LSP及sLSP1.3对NDV的抑制作用,结果显示,LSP在40.0及20.0 mg/L时,sLSP1.3在5.0及2.5 mg/L时对NDV均具有较强的阻断作用。其中sLSP1.3在5.0 mg/L时的D450值显著高于其余各组(P<0.05),且与细胞对照组无显著性差异(P>0.05),与病毒对照组差异显著(P<0.05)(图4)。表明在这种给药方式下,5.0 mg/L sLSP1.3对NDV的阻断作用最强。

图4 先加多糖后接种病毒时NDV对CEF感染力的检测结果
2.6 先接种病毒后添加多糖时NDV对CEF感染力的检测结果LSP及sLSP1.3对NDV的抑制作用结果显示,LSP在40 mg/L时、sLSP1.3在5 mg/L时均具有较好的NDV抑制作用,2种质量浓度下LSP及sLSP1.3组的D450值均显著高于其余各组及病毒对照组(P<0.05),但显著低于细胞对照组(P<0.05),且两者间的差异显著(图5),表明在这种给药方式下,LSP及sLSP1.3均对NDV具有良好的抑制作用。
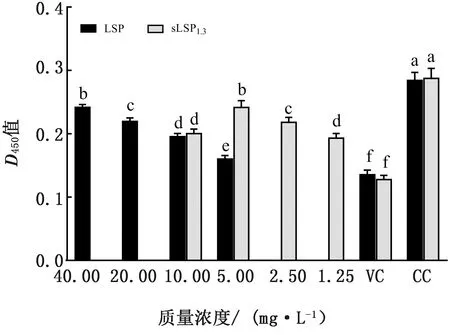
图5 先接种病毒后添加多糖时NDV对CEF感染力的检测结果
2.7 多糖和病毒混合后同时加入时NDV对CEF感染力的检测结果检测LSP及sLSP1.3对NDV的直接杀灭作用,如图6所示,LSP在40及20 mg/L时,sLSP1.3在5.0及2.5 mg/L时均具有较好的NDV杀灭效果,其中sLSP1.3组作用显著高于LSP及其余各质量浓度组,但显著低于细胞对照组(P<0.05),表明sLSP1.3对NDV具有一定的杀灭作用,且作用显著强于sLSP1.3。
2.8 血清抗体效价变化攻毒后3,7 d,攻毒组抗体效价都升高,各治疗组抗体效价均显著高于病毒对照组与空白对照组(P<0.05),LSP组和sLSP1.3组的抗体水平差异不显著(P>0.05);14 d时各治疗组及病毒对照组抗体水平都逐渐升高,sLSP1.3组效价显著高于病毒对照组(P>0.05),LSP 组效价在sLSP1.3组和病毒对照组之间,与两组差异不显著(P>0.05)(表1)。

表1 各组血清抗体效价的变化(log2)
2.9 各组临床疗效攻毒后病毒对照组死亡率高达86.7%(26/30),显著高于sLSP1.3组(P>0.05);治疗组中sLSP1.3组的保护率显著高于LSP组,达33.3%,痊愈率也高于LSP,达16.7%(表2)。

表2 各组治疗效果 %
3 讨论
自然界中有大量的多糖,其相对分子质量大,结构复杂,且具有多种生物学功能。多糖结构和生物活性的研究一直以来是国内外学者们关注的热点[17]。多糖的研究主要集中在多糖提取和鉴定及多糖生物活性上[18]。迄今为止,从植物中分离提取到的多糖有300多种,其中大部分均为中性多糖[18-19]。研究显示,多糖对机体免疫具有良好的增强及调节作用,同时能够通过多重途径起到治疗及防御传染性疾病作用[19]。多糖因多种生活学活性,已成为当前新药研发的热点。但植物中多糖含量有限且提取及纯化工艺较为复杂,且兽医临床上多糖使用量较大,因此学者们采取了多种方法,以求制备出用量少且活性更强的多糖用于畜禽疾病防控[20]。
为了检测硫酸化修饰对LSP抗NDV活性的影响,本试验首先对LSP进行纯化,通过聚糖凝胶柱Sephadex G-100得到纯化后的LSP,多糖含量为76.80%,经硫酸化修饰后的sLSP1.3多糖含量为56.25%,其硫酸根取代度为1.285。红外光谱鉴定结果可知,sLSP1.3在1 219 cm-1处有硫酸根特征吸收峰,进一步证明LSP被硫酸化修饰。考虑到LSP硫酸化修饰前后对细胞活性的影响,通过MTT法对LSP及sLSP1.3进行细胞安全质量浓度检测,在安全质量浓度范围内进行LSP及sLSP1.3体外抗NDV活性测定。为了明确LSP经硫酸化修饰前后抗NDV活性的变化及不同质量浓度sLSP1.3抗NDV活性,对比检测LSP及sLSP1.3体外抗NDV活性作用。研究显示通过药物和病毒的不同作用方式可初步判定,药物对病毒的不同作用活性。通过先添加多糖后接种病毒的方式可以判断药物对病毒感染细胞后的阻断作用,通过先接种病毒后添加多糖的方式可以判断药物对病毒感染细胞后的抑制作用,通过多糖和病毒混合后同时加入的方式可以判断药物对病毒感染细胞后的杀灭作用[21]。因此本试验以3种不同加药方式检测了不同质量浓度下LSP及sLSP1.3体外抗NDV作用。为检测LSP及sLSP1.3对NDV感染CEF的阻断、抑制和杀灭作用,通过先加药物后接种病毒的方式检测CEF的细胞活性,结果显示LSP在5~40 mg/L、sLSP1.3在1.25~5.00 mg/L阻断NDV感染能力均呈浓度依赖型,所有药物组中sLSP1.3在 5 mg/L 时的阻断NDV感染能力最强,显著高于40 mg/L 时的LSP组(P<0.05)。以先接种病毒后加药及药物和病毒感作后加入方式分别检测的LSP及sLSP1.3的NDV抑制作用及杀灭作用也表现出了相同结果。sLSP1.3在5 mg/L时的抑制NDV作用和40 mg/L时的LSP组无显著性差异(P>0.05),杀灭NDV作用显著高于40 mg/L时的LSP组(P<0.05)。从上述结果可知,所有加药方式中sLSP1.3在5 mg/L质量浓度下以先添加多糖后接种病毒的方式对NDV具有最强的杀灭阻断能力,且和细胞对照组无显著性差异(P>0.05)。以上结果可知LSP经硫酸化修饰后抗NDV活性得到显著增强,且在较低质量浓度下就能达到良好的抗NDV效果,显著降低了LSP的使用剂量。本研究为抗病毒中药有效成分的开发和活性检测提供了数据支持。

