盐酸法舒地尔脂质体的制备及其对炎性内皮细胞的改善作用*
莫莹莹,李京涛,梁彬彬,吴 棘
(广西医科大学第一附属医院超声科,南宁 530021)
动脉粥样硬化(atherosclerosis,AS)是一种危害人类健康的慢性心血管疾病,是导致冠心病、脑梗死和外周血管疾病的高危因素[1-2]。RhoA/ROCK通路调节细胞功能,包括细胞迁移、应力纤维形成、收缩性和膜突起,导致AS进展[3]。盐酸法舒地尔是目前应用于临床的RhoA/ROCK 通路选择性阻断剂,在临床上对于心绞痛、脑动脉及冠状动脉痉挛等心脑血管疾病有较好的治疗效果[4-5]。但盐酸法舒地尔生物利用性低,体内半衰期短[6],治疗指数也随之降低。脂质体是临床上应用最成功的纳米药物载体[7],在肿瘤等疾病的临床治疗中得到应用,其具有靶向性、缓释性、提高药物稳定性、降低药物毒性等优点[8]。目前国内、外对于盐酸法舒地尔脂质体的制备工艺的优化及其作用评价研究较少,本研究拟优化盐酸法舒地尔脂质体的制备方法,并评价其对于血管紧张素Ⅱ(Ang Ⅱ)诱导人脐静脉内皮细胞(HUVECs)的炎性保护作用,为AS的预防及治疗提供新的选择。
1 材料与方法
1.1 主要仪器 RE-52AA型旋转蒸发仪(上海亚荣生化仪器厂);超声波细胞破碎仪(Bioruptor Plus,比利时);Nicomp PSS 380ZLS 激光纳米粒度仪(美国);EVOS FL Auto 显微镜(美国Life Technologies公司);超高速冷冻离心机(BECKMAN COULTER,美国);全波长酶标读数仪(Multiskan GO,美国Thermo);Countstar 自动细胞计数仪(IC1000,中国上海);UV-2550紫外分光光度计(日本岛津)。
1.2 主要试剂 胆固醇、二棕榈酰磷脂酰胆碱(DPPC)、CCK8试剂盒、细胞间黏附分子-1(ICAM-1)试剂盒、血管细胞黏附分子-1(VCAM-1)试剂盒(北京索莱宝科技有限公司);二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧基(DSPE-PEG2000-COOH)(湖南华腾制药有限公司);盐酸法舒地尔原料药(上海源叶生物科技有限公司);即用型CE 膜透析袋(美国光谱医学公司);HUVECs 及内皮细胞专用培养基ECM(美国Sciencell 公司);Ang Ⅱ(美国Sigma 公司);DiI 荧光染料试剂盒(上海碧云天生物技术有限公司);一氧化氮(NO)测定试剂盒(南京建成生物有限公司)。
1.3 盐酸法舒地尔脂质体的制备 采用薄膜分散法制备盐酸法舒地尔脂质体。按一定比例称量DPPC、胆固醇、DSPE-PEG2000-COOH,将混合物用氯仿水浴超声充分溶解,置于旋转蒸发器35 ℃减压旋转蒸发使其在瓶底形成均匀的薄膜,放在真空干燥机中干燥过夜。通过主动载药法或被动载药法来包载药物。被动载药法中,用PBS缓冲液稀释的盐酸法舒地尔并结合水浴超声将瓶底的薄膜水化成悬浊液,用超声细胞破碎仪超声10 min(4 ℃,5 s/5 s,on/off,320 W,60 个循环),在4℃超声后用3 000 r/min 离心去除大分子物质,立即吸取上清液转移至透析袋内(透析袋截留分子量1 000 D),用PBS缓冲液透析24 h以除去未包封的药物。用同样的方法制备空白对照脂质体(脂质体内包封的是PBS缓冲液)。主动载药法中,先用醋酸钙溶液水化干燥的薄膜成悬浊液并用0.9%氯化钠溶液透析至适宜的跨膜梯度,将药物在一定温度下孵育,用超声细胞破碎仪均一粒径后离心并透析。制备的脂质体在4 ℃下保存,以备后续研究。
1.4 盐酸法舒地尔脂质体的质量评价 取少量制备好的盐酸法舒地尔脂质体,光学显微镜下观察其形态及分布情况,PSS 纳米粒度仪测定脂质体的平均粒径及平均电位。
用直接法测定载药脂质体的包封率,10µL 脂质体经990 µL 甲醇裂解后超声30 min,离心(10 000 r/min,10 min),将药物从脂质体中分离,用紫外分光光度计在320 nm 测定上清液中盐酸法舒地尔的含量,可得到包封于脂质体内法舒地尔的质量,同时将一定量制备好的盐酸法舒地尔脂质体冻干并称量,即可得盐酸法舒地尔脂质体总质量,根据以下公式计算包封率和载药量:包封率(%)=包封于脂质体内的法舒地尔质量/投入的法舒地尔总质量;载药量(%)=包封于脂质体内的法舒地尔质量/盐酸法舒地尔脂质体总质量。
在透析袋内加入2 mL盐酸法舒地尔脂质体,放入50 mL 离心管内,加入20 mL PBS 缓冲液(pH=7.4),于37 ℃摇床(100 r/min)进行释放实验。分别于0.2 h、0.4 h、0.8 h、1 h、2 h、3 h、4 h、5 h、6 h、7 h、8 h、12 h、24 h取样5 mL,同时补充等量的PBS缓冲液。用同体积PBS 稀释的盐酸法舒地尔作盐酸法舒地尔组。用紫外分光光度计(320 nm)测量取出药物浓度,计算药物累积释放率。
1.5 体外细胞摄取 采用流式细胞仪检测细胞的摄取情况。配制浓度为10 μmol/L的DiI荧光染料,将盐酸法舒地尔脂质体与DiI 染料避光孵育20 min,于4 ℃下12 000 r/min离心10 min,除去游离染料,沉淀重悬即制成带荧光的脂质体。将HUVECs接种于6孔板中,待细胞生长贴壁80%~90%后,加入500 μL 荧光脂质体及1 mL 完全培养基,同时设空白对照孔(只加完全培养基),孵育2 h 后PBS 冲洗3 次,胰酶消化,1 000 r/min 离心3 min,PBS 重悬后用流式细胞仪检测荧光强度。
1.6 实验分组 将HUVECs细胞随机分为4组,(1)对照组:培养液中只加等量的培养液;(2)AngⅡ组:培养液中加入10-7mol/L Ang Ⅱ;(3)载药脂质体组:培养液中加入0.1 mg/mL盐酸法舒地尔脂质体培养8 h,再加入10-7mol/L Ang Ⅱ继续培养;(4)空白脂质体组:培养液中加入0.1 mg/mL 空白法舒地尔脂质体培养8 h,再加入10-7mol/L Ang Ⅱ继续培养。
1.7 CCK8 法检测细胞活力 将HUVECs 细胞接种于96孔板中,取对数生长期细胞,用胰酶消化,完全培养基配制成细胞悬液,待细胞生长贴壁80%~90%后,分组处理细胞(每组6个副孔),另设空白调零孔(不加细胞只加培养液),培养24 h后每孔加入CCK8 缓冲液10µL,同样条件下继续培养2 h 于酶标仪检测450 nm处吸光值。
1.8 细胞培养上清液NO 含量检测 将HUVECs细胞接种于6 孔板中,分组处理后,收集细胞培养液。采用硝酸还原法测定细胞培养上清液中NO含量。操作步骤严格按照试剂盒说明书进行。
1.9 细胞培养上清液VCAM-1、ICAM-1含量检测 将HUVECs细胞接种于6孔板中,分组处理后,收集细胞培养液。采用酶联免疫吸附试验(ELISA)法测定细胞培养上清液中VCAM-1和ICAM-1蛋白水平。操作步骤严格按照试剂盒说明书进行。
1.10 统计学方法 采用SPSS 25.0 统计软件分析数据,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较用LSD-t检验,方差不齐采用Dunnett’s T3 检验,以P<0.05为差异有统计学意义。
2 结果
2.1 盐酸法舒地尔脂质体制备的优化 在醋酸钙浓度120 mmol/L、孵育时间30 min、孵育温度60 ℃条件下,不同药脂比的主动载药法(即醋酸钙梯度法)包封率较被动载药法升高(P<0.01),见表1。
表1 主动载药法与被动载药法包封率比较,n=3

表1 主动载药法与被动载药法包封率比较,n=3
与被动载药法比较,#P<0.01。
在相同的条件下,随着醋酸钙浓度增高,脂质体的包封率也逐渐增高;相同条件下药脂比为1∶15时包封率最高,加大药物投放时包封率逐渐下降;相同条件下孵育时间为30 min时包封率最高,当孵育时间延长至90 min 时,包封率下降;相同条件下孵育温度在60 ℃时包封率最高,见表2。综合考虑制备成本及脂质体稳定性的问题,最终的制备方案为醋酸钙梯度法,醋酸钙浓度120 mmol/L,药脂比为1∶10,孵育时间30 min,孵育温度60 ℃,所制备的脂质体包封率为(91.48±5.64)%,载药量为(41.86±2.35)%。
表2 相同条件下不同醋酸钙浓度、不同药脂比、不同孵育时间和不同孵育温度包封率比较,n=3

表2 相同条件下不同醋酸钙浓度、不同药脂比、不同孵育时间和不同孵育温度包封率比较,n=3
a 条件为药脂比1∶10,孵药时间30 min,孵药温度60 ℃;b条件为醋酸钙浓度120 mmol/L,孵药时间30 min,孵药温度60 ℃;c条件为醋酸钙浓度120 mmol/L,药脂比1∶10,孵药温度60 ℃;d 条件为醋酸钙浓度120 mmol/L,药脂比1∶10,孵药时间30 min。
2.2 盐酸法舒地尔脂质体表征 光学显微镜下可见盐酸法舒地尔脂质体分布均匀(图1)。激光纳米粒度仪测定结果显示:载药脂质体的平均粒径为(185.12±20.90)nm,粒径分布均匀(图2),平均电位为(-25.22±1.23)mV,表面较高的负电产生静电排斥作用,避免了脂质体之间发生聚集现象,有利于脂质体的物理稳定性。
图1 光镜下盐酸法舒地尔脂质体形态分布(×400)

图2 盐酸法舒地尔脂质体粒径分布
2.3 脂质体体外模拟释放实验结果 盐酸法舒地尔在1 h 释药72.63%,在5 h 基本释放全部的药物,达到平台期;而盐酸法舒地尔脂质体在1 h 仅释放37.93%,12 h 达到平台期,24 h 可释放87.62%的药物,从而达到缓释效果,见图3。

图3 体外模拟释药曲线
2.4 细胞摄取 流式细胞仪检测显示荧光强度约为39.30%,说明脂质体可被细胞摄取,见图4。
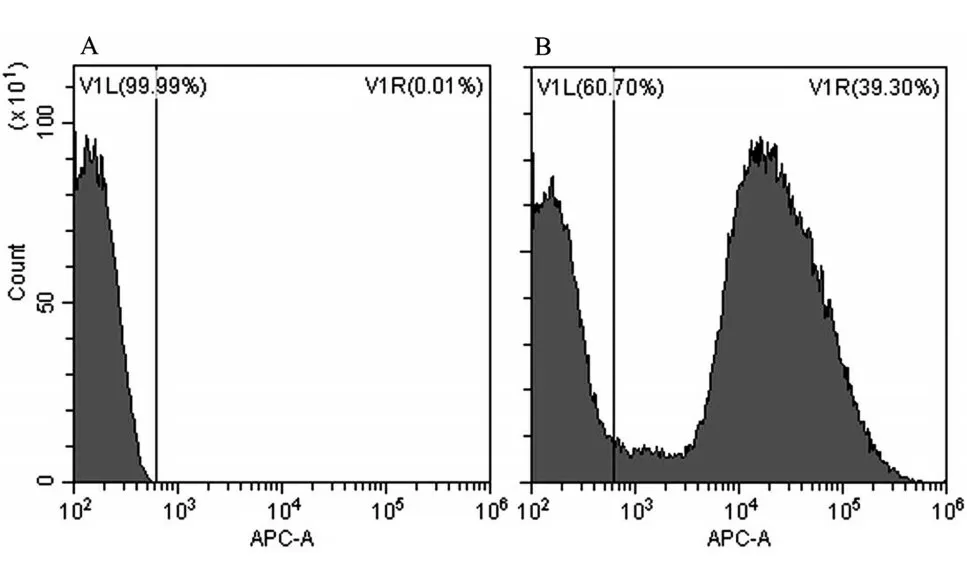
图4 流式细胞仪检测HUVECs对脂质体的摄取率
2.5 脂质体对Ang Ⅱ诱导的内皮细胞活力影响 对照组细胞存活率为100%,Ang Ⅱ组细胞存活率为(69.31±3.00)%,载药脂质体组细胞存活率为(88.38±1.86)%,空白脂质体组细胞存活率为(67.92±3.98)%。与对照组比较,Ang Ⅱ组、载药脂质体组、空白脂质体组细胞存活率均降低(均P<0.01,n=6);与Ang Ⅱ组比较,载药脂质体组细胞存活率升高(P<0.01,n=6)。
2.6 各组内皮细胞培养上清液NO、VCAM-1、ICAM-1含量比较 与对照组比较,Ang Ⅱ组、载药脂质体组、空白脂质体组NO 含量降低,ICAM-1、VCAM-1 含量升高(均P<0.01);与Ang Ⅱ组比较,载药脂质体组NO 含量升高,VCAM-1、ICAM-1 含量降低(均P<0.01);空白脂质体组与Ang Ⅱ组NO、VCAM-1 和ICAM-1 含量比较,差异无统计学意义(P>0.05),见表3。
表3 各组HUVECs细胞培养上清液NO、ICAM-1、VCAM-1含量比较,n=6
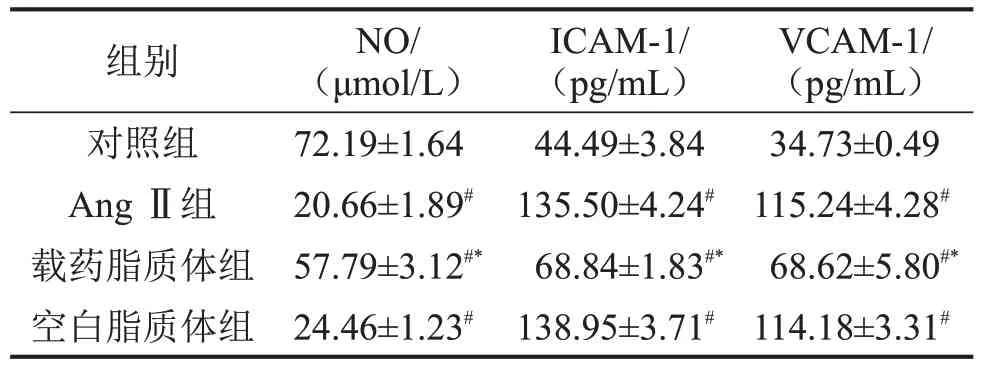
表3 各组HUVECs细胞培养上清液NO、ICAM-1、VCAM-1含量比较,n=6
与对照组比较,#P<0.01;与Ang Ⅱ组比较,*P<0.01。
3 讨论
目前,靶向给药已成为疾病治疗领域的研究热点,脂质体日益被视为靶向药物传递系统的理想载体[9]。由于盐酸法舒地尔是弱酸性亲水分子(pH 为4.5~6.0),在脂类制剂中包封的效率较低,主动载药法可高效提高弱酸或弱碱性的亲水性药物的包封率。醋酸钙梯度法属于主动载药法中的一种,其有利于弱酸性药物的脂质体包载,醋酸钙梯度可诱导产生pH 梯度,高效驱动弱酸性药物使其从脂质体的外水相主动进入到内水相,因此达到优化包封率的效果[10]。本研究通过比较被动和主动载药法,改变药脂比、醋酸钙浓度、孵药时间及温度,优化了盐酸法舒地尔在脂质体中的包封率,使其成为包封率及载药量高的纳米制剂,并可成功被HUVECs摄取。缓释效应是脂质体制剂的重要特征之一,可延长药物的消除半衰期,延长血液循环时间,提高药物利用率和药物治疗指数。盐酸法舒地尔在人体内的半衰期相对较短,约为2~3 h 左右,药效持续时间较短。本研究体外模拟释药结果表明,与盐酸法舒地尔比较,盐酸法舒地尔脂质体的缓释特征更为明显。
RhoA/ROCK 通路参与AS 炎性反应的多个阶段[11-13]。血管氧化应激反应和NO在AS的早期发展中起到关键的作用[14],内皮一氧化氮合酶(eNOS)生物活性减低是内皮功能损伤的表现[15],在生理条件下eNOS 产生NO。炎症因子如ICAM-1、VCAM-1通过促进细胞黏附,参与AS发展的全过程[16]。盐酸法舒地尔通过特异性抑制RhoA/ROCK 信号通路,抑制炎症细胞浸润,减少炎症介质的产生,并上调eNOS 表达,促进NO 生成。Ang Ⅱ在AS 病理生理中起着核心作用[17]。Ang Ⅱ作为血管活性肽,对于血管的影响包括调节内皮功能、氧化应激、炎症、细胞迁移和增殖[18],并通过促进斑块的破裂和高血栓的形成状态加速AS 进展。研究表明,Ang Ⅱ可破坏HUVECs活力、功能及细胞骨架等,在AS发生和发展中起着重要作用[19]。本研究采用Ang Ⅱ诱导HUVECs 成功建立炎性细胞模型,载药脂质体组与Ang Ⅱ组比较,NO 含量升高,VCAM-1、ICAM-1 含量降低,表明载药脂质体中释放的盐酸法舒地尔能够对Ang Ⅱ诱导的炎性内皮细胞起到保护及改善作用。空白脂质体组与Ang Ⅱ组比较,未见明显差异,表明空白脂质体对于炎性细胞无明显改善作用。
综上,本研究所制备的盐酸法舒地尔脂质体对炎性内皮细胞有保护作用,可降低其炎性反应及Ang Ⅱ对内皮细胞的损害。

