紫外-可见分光光度法间接测定硫普罗宁的含量
林 瑜 ,李见能 ,韦小玲 ,潘真真 ,李芳婵 ,谭建宁*
(1.广西中医药大学 药学院,南宁 530200;2.广西大学 化学化工学院,南宁 530004;3.广西中医药大学 教学实验实训中心,南宁 530200)
硫普罗宁是一种甘氨酸衍生物,化学名为N-(2-巯基丙酰基)甘氨酸,其侧链的活性巯基在人体内能发挥多种药理效应,具有良好的解毒作用,可显著修复乙醇性肝损伤,被广泛用于临床肝脏疾病的治疗[1]。目前测定硫普罗宁含量的方法主要有高效液相色谱法[2-4]、液相色谱-串联质谱法[5-6]、紫外-可见分光光度法(UV-Vis)[7-11]、近红外光谱法[12]、拉曼光谱法[13]、荧光分光光度法[14-15]、电化学法[16-17]等,这些方法中,除了UV-Vis以外,其他方法具有操作复杂、仪器成本高、需使用有毒试剂等缺点。文献报道的UV-Vis主要是利用硫普罗宁分子中巯基的还原性,先把一些高价态金属离子(如Cu2+、Fe3+)还原成低价态,再加入显色剂,使其与被还原的金属离子结合后对硫普罗宁进行间接测定,但该方法在测定过程中容易受空气中氧气的影响,稳定性欠佳。硫普罗宁分子中含有孤对电子的仲胺、羟基以及巯基,能与金属离子进行配位,并且研究发现,在弱酸性环境中,硫普罗宁与Pd2+可形成稳定的络合物,该络合物在波长345 nm处有灵敏的特征吸收,且吸光度随硫普罗宁浓度的增大而增强,据此提出了一种间接测定硫普罗宁含量的新方法。
1 试验部分
1.1 仪器与试剂
UV-2100型紫外可见分光光度计;KQ-700TDE型高频数控超声波清洗器;HH-8型恒温水浴锅;1 cm石英比色皿。
硫普罗宁标准溶液:196.0 mg·L-1,称取0.196 0 g硫普罗宁标准品于烧杯中,加水溶解,常温超声3 min,转移至100 mL容量瓶中,用水定容,摇匀,配制成1 960 mg·L-1硫普罗宁标准储备溶液,再用水稀释10倍,得到196.0 mg·L-1硫普罗宁标准溶液。
Pd2+标准溶液:166.7 mg·L-1,称取0.833 3 g二氯化钯,加入5 mol·L-1盐酸溶液10.00 mL,转移至100 mL容量瓶中,用水定容,摇匀,配制成Pd2+质量浓度为8 333 mg·L-1的Pd2+标准储备溶液,再用水稀释50倍,得到166.7 mg·L-1Pd2+标准溶液。
乙酸-乙酸钠缓冲溶液(pH 5.0):称取26.7 g乙酸钠,加水溶解后,加入10.30 mL冰乙酸,将混合溶液转移至500 mL容量瓶中,再用水定容。
所用试剂均为分析纯;试验用水为蒸馏水。
市售的3个不同品牌的硫普罗宁片剂,硫普罗宁标示量均为0.1 g·片-1。
1.2 仪器工作条件
检测波长345 nm;扫描范围200~500 nm;光谱带宽度0.2 nm。
1.3 试验方法
取20片硫普罗宁片剂样品,准确称量、研碎,再称取相当于0.1 g硫普罗宁的粉末于烧杯中,加水溶解后转移至250 mL容量瓶中,用水定容,摇匀,过滤,配制成样品储备溶液。使用时,用水稀释,得到待测样品溶液。
于10 mL比色管中依次加入2.00 mL Pd2+标准溶液、4.00 mL待测样品溶液和1.00 mL乙酸-乙酸钠缓冲溶液(pH 5.0),用水定容,摇匀,静置5~10 min。以硫普罗宁标准溶液为参比,于345 nm处测定体系的吸光度。
2 结果与讨论
2.1 检测波长的选择
在检测波长200~500 nm内,以水为参比,对硫普罗宁标准溶液、Pd2+标准溶液和两者反应后的混合溶液进行测定,结果见图1。
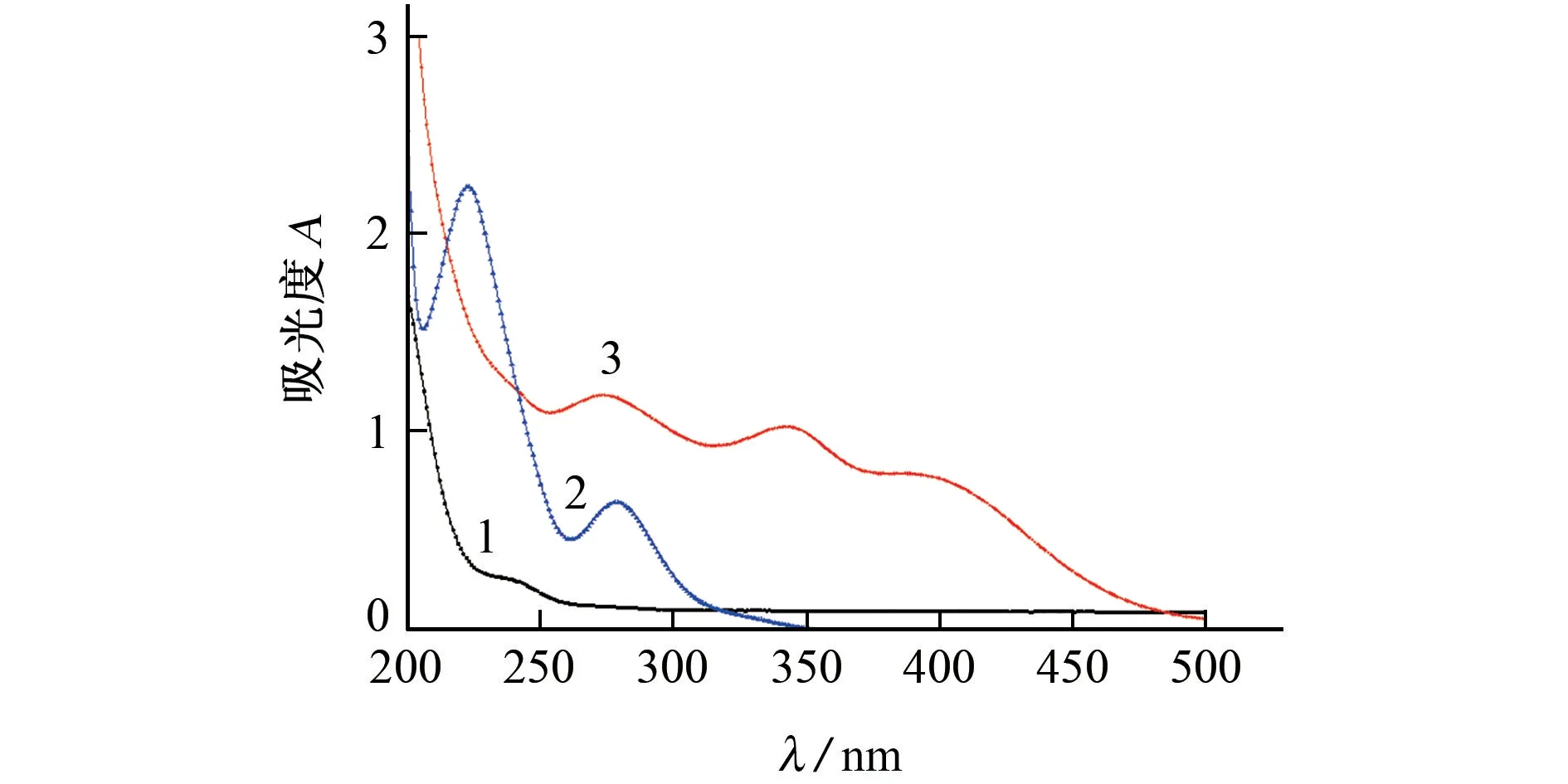
图1 紫外-可见吸收光谱图Fig.1 UV-Vis spectra
由图1可知:硫普罗宁在238 nm处有吸收峰;Pd2+在220 nm和278 nm处有吸收峰;硫普罗宁标准溶液与Pd2+标准溶液反应后,在274,345,395 nm处有吸收峰,其中274 nm附近存在Pd2+吸收干扰,345 nm附近吸收较灵敏,但仍存在硫普罗宁和Pd2+的微量吸收干扰。因此,试验以硫普罗宁标准溶液为参比,于345 nm处进行测定。
2.2 体系酸度及缓冲溶液用量的选择
用0.1 mol·L-1盐酸溶液和0.1 mol·L-1氢氧化钠溶液调节体系酸度,考察了不同酸度(pH 3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0)对体系吸光度的影响。结果表明:当pH小于5.0时,体系的吸光度随pH增大而增大;当pH为5.0时,体系的吸光度较大且稳定;当pH大于5.0时,由于Pd2+发生部分水解,与硫普罗宁配位的Pd2+减少,体系的吸光度随pH增大而减小。选用pH 5.0的乙酸-乙酸钠缓冲溶液,考察了不同用量(0.20,0.40,0.60,0.80,1.00,1.20,1.40,1.60 mL)的该溶液对体系吸光度的影响。结果显示:当乙酸-乙酸钠缓冲溶液(pH 5.0)用量小于1.00 mL时,体系的吸光度随缓冲溶液用量的增加而增大;当加入乙酸-乙酸钠缓冲溶液(pH 5.0)1.00 mL时,体系的吸光度较大;当乙酸-乙酸钠缓冲溶液(pH 5.0)用量大于1.00 mL时,体系的吸光度随缓冲溶液用量的增加而减小,可能是乙酸-乙酸钠和硫普罗宁竞争与Pd2+配位,导致生成的硫普罗宁-Pd2+络合物减少。因此,试验选用1.00 mL乙酸-乙酸钠缓冲溶液(pH 5.0)来调节体系酸度。
2.3 Pd2+标准溶液用量的选择
试验分别考察了不同用量(0.50,1.00,1.50,2.00,2.50,3.00 mL)的166.7 mg·L-1Pd2+标准溶液对体系吸光度的影响。结果显示:当Pd2+标准溶液用量小于2.00 mL时,随用量的增加,体系的吸光度逐渐增强;当Pd2+标准溶液用量不小于2.00 mL时,体系的吸光度较大且基本保持不变。因此,试验选择Pd2+标准溶液的用量为2.00 mL。
2.4 反应温度的选择
试验考察了不同反应温度(10,20,30,40,50,60,70,80℃)对体系吸光度的影响。结果显示:当反应温度小于30℃时,吸光度随反应温度的增大而增大;当反应温度为30℃时,吸光度较大且稳定;当反应温度大于30℃时,由于络合物在高温下发生部分解离,吸光度随反应温度的增大而减小。因此,试验选择反应温度为30℃,即在室温下进行反应。
2.5 放置时间的选择
按照试验方法配制溶液,考察了放置5,10,20,40,60,80,100,120 min时体系吸光度的变化。结果显示:120 min内体系的吸光度基本保持不变,因此配制好溶液后,静置5~10 min即可进行测定。
2.6 试剂加入顺序的选择
试验考察了Pd2+标准溶液、硫普罗宁标准溶液、乙酸-乙酸钠缓冲溶液(pH 5.0)等3个试剂的加入顺序对体系吸光度的影响。结果显示:试剂加入顺序对吸光度有较大影响,当加入顺序为Pd2+标准溶液、硫普罗宁标准溶液、乙酸-乙酸钠缓冲溶液(pH 5.0)时,体系的吸光度较大,Pd2+与硫普罗宁络合后,加入的乙酸-乙酸钠缓冲溶液(pH 5.0)进一步促进络合物的稳定;当加入顺序为硫普罗宁标准溶液、Pd2+标准溶液、乙酸-乙酸钠缓冲溶液(pH 5.0),或者是乙酸-乙酸钠缓冲溶液(pH 5.0)、硫普罗宁标准溶液、Pd2+标准溶液时,体系的吸光度较小且络合物的稳定性较差;当加入顺序为乙酸-乙酸钠缓冲溶液(pH 5.0)、Pd2+标准溶液、硫普罗宁标准溶液时,由于Pd2+优先与乙酸-乙酸钠络合,消耗了大量的Pd2+,未形成硫普罗宁-Pd2+络合物,几乎未检测到吸光度。因此,试验选择试剂的加入顺序为Pd2+标准溶液、硫普罗宁标准溶液(或待测样品溶液)、乙酸-乙酸钠缓冲溶液(pH 5.0)。
2.7 干扰试验
以40.00 mg·L-1硫普罗宁标准溶液为分析对象,考察了药片赋形剂及一些常见离子的干扰情况。结果表明:在±5%的相对误差范围内,800倍的葡萄糖,300倍的乳糖,150倍的硬脂酸、Ca2+,100倍的淀粉,50倍的糊精、Mg2+对硫普罗宁的测定无干扰。
2.8 反应机理的探讨
采用摩尔比法确定硫普罗宁和Pd2+的配位比。按照试验方法测定不同物质的量比(n硫普罗宁∶nPd2+)下体系的吸光度,结果见图2。根据公式(1)、(2)计算络合物稳定常数K稳和解离度α。

式中:M为Pd2+;L为硫普罗宁;cM为Pd2+浓度,1.88×10-4mol·L-1;A为硫普罗宁与Pd2+物质的量比为2∶1时络合物的吸光度,0.998;Amax为图2曲线中两切线交点处的吸光度,1.000。由于络合物发生部分分解,故A<Amax。
计算得α=0.002,K稳=8.82×1014。由图2可知,在pH 5.0溶液中,硫普罗宁与Pd2+形成了物质的量比为2∶1的络合物。

图2 硫普罗宁与Pd2+在不同物质的量比下体系的吸光度Fig.2 Absorbance of system with tiopronin and Pd2+at different molar ratios
2.9 标准曲线和检出限
移取适量的硫普罗宁标准储备溶液,配制成质量浓度分别为0.20,9.80,19.60,29.40,39.20,49.00,60.00 mg·L-1的硫普罗宁标准溶液系列。按照仪器工作条件进行测定,以硫普罗宁的质量浓度为横坐标,其对应的吸光度为纵坐标绘制标准曲线。结果显示:硫普罗宁的质量浓度在0.20~60.00 mg·L-1内与其对应的吸光度呈线性关系,线性回归方程为A=2.250×10-2ρ+0.107 3,相关系数为0.999 1,摩尔吸光系数为5.27×103L·mol-1·cm-1。
测定11次空白溶液的吸光度,计算测定值的标准偏差(s),以3倍标准偏差与线性回归方程斜率(k)的比值计算检出限(3s/k),结果为0.003 5 mg·L-1。
2.10 精密度和回收试验
分别移取0.80 mL 3个不同品牌的样品储备溶液,用水稀释10倍后进行加标回收试验,计算回收率和测定值的相对标准偏差(RSD),结果见表1。

表1 精密度和回收试验结果(n=5)Tab.1 Results of tests for precision and recovery(n=5)
结果显示,回收率为98.0%~103%,RSD为0.83%~3.5%。
2.11 样品分析
按照试验方法移取1.60 mL样品储备溶液,用水稀释10倍后进行测定,结果见表2。

表2 样品分析结果(n=5)Tab.2 Analytical results of the samples(n=5)
结果显示,3个样品的测定值与其标示量基本一致。
2.12 方法比对
将本法与其他UV-Vis测定硫普罗宁所得结果进行比对,结果见表3。

表3 方法比对结果Tab.3 Method comparison results
由表3可知,本法具有更宽的线性范围和较低的检出限。
在弱酸性环境中,硫普罗宁可与Pd2+以2∶1的物质的量比形成稳定的络合物,该络合物在345 nm处有特征吸收,且吸光度与硫普罗宁的质量浓度成正比。据此,本工作提出了UV-Vis间接测定硫普罗宁含量的方法,与其他方法比对,该方法简单、快速、毒性小、成本低、易推广,具有一定的实用性。

