化学动力学疗法的研究现状与技术难点
王培三,齐春霞
1.安徽医科大学生物医学工程学院,安徽合肥,230032;2.合肥师范学院化学与化学工程学院,安徽合肥,230601
自从法国科学家Fenton发现Fe2+可以激活H2O2氧化酒石酸后,Fenton 及其相关反应引起了生物医学领域的极大兴趣[1]。Fe2+和 H2O2之间的反应可以产生高活性羟基自由基(·OH),而高氧化还原电位(E (·OH/H2O) = 2.8 V)的·OH被认为具有最有效的调节细胞代谢过程的能力[2-3]。基于此,2016年中科院上海硅酸盐研究所施剑林研究员团队与步文博教授课题组提出一种利用肿瘤微环境(TME)实现特异性激活产生·OH杀死肿瘤细胞的新型治疗策略,即化学动力学疗法(CDT)[4]。
1 化学动力学疗法的研究现状
众所周知,TME具有乏氧、微酸、H2O2过表达以及谷胱甘肽(GSH)高表达等特点,这为一些针对肿瘤微环境的治疗手段提供必要条件[5-6]。CDT依赖于Fenton/类Fenton反应来促进肿瘤部位产生丰富的·OH,其中纳米药物在酸性TME中释放Fenton化学试剂,将过表达的H2O2转化为高毒性的·OH,进而在癌细胞中引起氧化应激,诱导细胞凋亡,达到肿瘤治疗的目的。值得注意的是,Fenton/类Fenton反应在碱性条件下和非肿瘤区域H2O2低于有效浓度下难以触发,因此CDT是一种高选择性和低毒副作用的肿瘤治疗策略[7]。
2 化学动力学疗法的技术难点
近几年虽然CDT得到广泛的探索和研究,但仍然存在治疗效果不佳的局限,限制其在临床上的应用;主要受到以下三个方面的挑战:(1)肿瘤部位相对较高的pH值不适合大多数Fenton/类Fenton反应的发生;(2)肿瘤内源性H2O2浓度低,不足以连续的产生·OH;(3)肿瘤微环境(TME)中还原性物质(如谷胱甘肽GSH)的高表达削弱了CDT的治疗效果。值得注意的是,Fenton/类Fenton反应通常在较低pH值范围内(pH值3~4)充满活力,而肿瘤酸中毒作为一种常见的微环境应激源,其特点是细胞外pH值呈微酸性(≈6.5),细胞内pH值呈中性(≈7.2)[8],不足以触发Fenton/类Fenton反应。因此,弱酸性TME通常会限制Fenton/类Fenton反应效率,显著降低·OH的产率。为了解决酸度不够的问题,近年来,已尝试使用原位H+生成策略重构TME以增强CDT效应(ECDT)。例如,许多研究已将葡萄糖氧化酶(GOx)整合到Fenton纳米治疗剂中,GOx可以催化葡萄糖氧化成葡萄糖酸,从而形成富含H+的环境,提高肿瘤部位的酸度以增强Fenton/类Fenton反应效率并实现ECDT[9-10]。除了使用GOx原位产生酸外,使用光酸是调节细胞内微环境的另一种常用方法。在光照射下,光酸被激活释放H+,从而实现肿瘤细胞pH的重建[11]。尽管如此,GOx或光酸原位生成H+用于调节细胞内pH值通常是低效的,因为H+产量低且癌细胞中固有的pH稳态系统,而且,这种策略依赖于较长的反应时间来酸化TME[12]。与经典的pH依赖性Fenton/类Fenton反应相比,开发非pH依赖性Fenton/类Fenton试剂有助于增加·OH的产生,尤其是在弱酸性TME中。近年来,一些纳米材料,如金纳米团簇[13]、CoFe2O4纳米颗粒[14]、Au@Ag异质纳米棒[15]以及锰基纳米结构[16]已被证明具有非酸性pH依赖性过氧化物酶模拟活性。这些与pH值无关的纳米材料通过克服pH值限制,在增强癌细胞中的Fenton/类Fenton反应方面表现出巨大的潜力。值得注意的是,锰基纳米材料基于Mn2+引发的类Fenton反应的最佳反应pH值接近TME中的pH值,逐渐成为最具潜力的CDT试剂[17]。
CDT 也可以与其他治疗方式的联合治疗。通过 CDT 与化疗、光热疗法、光动力学疗法、超声动力学疗法、气体疗法、饥饿疗法、免疫疗法等治疗方式的联合(图 1),有助于弥补单一疗法各自的不足,取长补短,实现协同高效肿瘤治疗[18]。
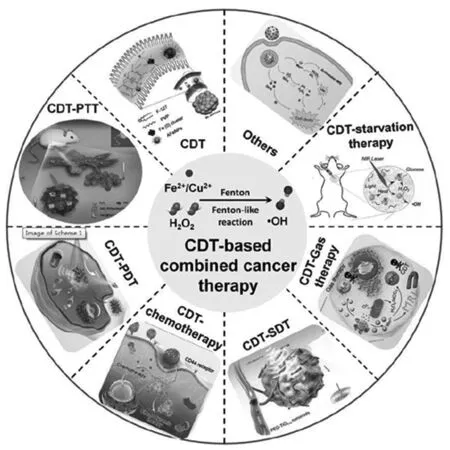
图1 基于 CDT 的各种联合治疗策略
3 化学动力学疗法中如何提高H2O2浓度的研究进展
多种锰基纳米材料(包括MnO[19-20],MnO2[21-22],MnS[23],MnSiO3[24-25])已被设计用于触发肿瘤内Fenton/类Fenton反应以产生·OH,消耗肿瘤内源性H2O2实现CDT。然而,肿瘤细胞内源性过氧化氢水平不足和强大的抗氧化系统限制了·OH的产生并加速了·OH的消耗,从而极大降低了CDT治疗效果。因此,通过增加H2O2浓度和降低肿瘤细胞中的GSH水平来上调癌细胞的氧化电位是增强ECDT的Fenton/类Fenton反应的潜在手段。尽管TME中相对高浓度的H2O2为CDT提供了机会,但越来越多的研究表明,内源性H2O2在CDT过程中仍不能产生足够量的·OH来杀死癌细胞[26]。为克服这一障碍,大量H2O2自供给纳米系统与Fenton纳米药物相结合,以提高Fenton/类Fenton反应和ECDT的效率[27]。这些H2O2自供纳米系统的设计和建立通常围绕两个设计理念进行:一是传递外源性H2O2[28-29],二是原位激活内源性H2O2增强通路,提高H2O2浓度,促进瘤内Fenton/类Fenton反应,提高ECDT的效率[30-31]。在肿瘤抗氧化防御系统中谷胱甘肽(GSH)发挥重要作用,GSH作为还原剂可以直接清除ROS,从而降低CDT的效率。最近的研究表明,通过各种机制消耗GSH是提高CDT治疗性能和选择性的可行方法,可以作为辅助抗癌治疗的重要策略[32]。尽管增加H2O2浓度和降低肿瘤细胞中的GSH水平使得CDT效率得到很大提高,但是实体瘤复杂的生物环境和较低药物渗透率,使得单靠CDT很难彻底根除恶性肿瘤[7,33]。基于CDT的协同治疗策略,包括光热/CDT协同疗法、化学/CDT协同疗法、光动力/CDT协同疗法和声动力/CDT协同疗法,已经引起人们广泛的关注[34]。在众多联合疗法中,光热疗法(PTT)逐渐成为提高CDT疗效的最常用而有效策略,其中光热试剂将近红外光(NIR)能量转化为热能,从而提高肿瘤部位的温度[35]。重要的是,肿瘤区域局部过热会对蛋白质和核酸等细胞内生物分子造成不可逆的损害,破坏肿瘤生物屏障,提高了药物渗透率,同时温和的光热效应可以加速·OH的产生,增强CDT效率,从而提高抗肿瘤效果[36]。因此,开发具有光热效应以及TME响应性消耗GSH、提高内源性H2O2浓度性能的CDT药物具有重要的研究意义和临床价值。
4 结 论
结合前期的工作积累和研究成果,可以从三方面来提高CDT效率(如图1):(1)采用Bi2-xMnxO3纳米球作为类芬顿反应的催化剂,通过调节Bi5+、Mn4+的浓度来提高GSH消耗性能,破坏肿瘤抗氧化系统的平衡,提高CDT效率;(2)高价Bi具有葡萄糖氧化酶活性,能内源性提高H2O2浓度,提高Mn2+驱动的类Fenton反应效率,进而增强CDT;(3)掺杂Bi显著提高Bi2-xMnxO3的光热性能,提高肿瘤部位的温度进而破坏肿瘤内生物分子及加速肿瘤区域血流量,从而提高实体瘤药物渗透性,增强CDT治疗效果。此外,锰(II)因其有5个未配对电子、高自旋数、电子弛豫时间长、顺磁性的特点,早期被开发用作磁共振成像(MRI)的造影剂;铋元素的高原子序数和X射线衰减系数,铋基纳米结构被用作有前景的X射线计算机断层扫描(CT)造影剂,基于材料本身具有多模态成像的功能,引入先进的影像诊断技术CT、MRI和光声成像等,有望实现对肿瘤病灶区时监测以及评估CDT治疗效果。通过材料表面的靶向修 饰,提高肿瘤细胞对Bi2-xMnxO3材料的摄取,更进一步提高材料对肿瘤的治疗效果(如图2)。
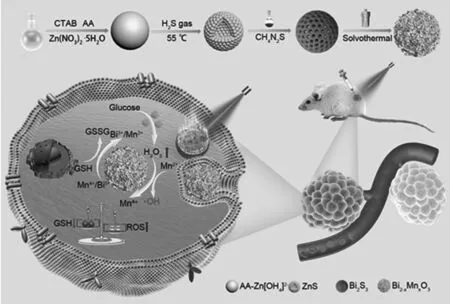
图2 项目提出的研究思路与构建的Bi2-xMnxO3纳米球的能量传递原理
5 展 望
如果能够开发Bi2-xMnxO3纳米球作为非pH依赖性Fenton/类Fenton试剂,技术难点将会攻破。通过MTT实验探究Bi2-xMnxO3纳米材料敏感的肿瘤细胞系,构建合适的肿瘤模型,尾静脉注射后采用CT和MRI成像功能实时观测材料体内分布和代谢过程,检测材料在体内循环过程的生物安全性。研究方法如,选用小鼠结肠癌细胞(CT26)、小鼠乳腺癌细胞(4T1)、小鼠黑色素瘤细胞(B16F10)作为肿瘤细胞模型,通过CCK8法检测Bi2-xMnxO3纳米结构在有光和无光照情况下对三种肿瘤细胞的杀伤效果,通过活性氧检测试剂盒(DCFH-DA)检测相应细胞中的ROS产生含量,并采用红外热成像仪IR780实时检测细胞中的温度,筛选Bi2-xMnxO3纳米结构敏感的肿瘤细胞系,指导构建合适的肿瘤模型。此外,通过ROS清除剂(如N-乙酰基-L-半胱氨酸(NAC))清除CDT治疗的效果,观察纯PPT治疗效果,以此来计算CDT和PTT贡献。然后构建CT26、4T1、B16F10皮下荷瘤小鼠模型。尾静脉注射改性后Bi2-xMnxO3纳米结构,通过Bi2-xMnxO3纳米结构的CT与MRI造影功能指导近红外光照射的治疗时间窗口,每隔2天记录小鼠肿瘤体积大小和体重,观察抑瘤效果,探索Bi2-xMnxO3纳米结构对不同实体瘤的治疗效果。对不同治疗时期的小鼠眼球取血后,离心取血清,用试剂盒检测不同治疗时期小鼠血常规和血生化指标;并分离小鼠主要脏器(心、肝、脾、肺、肾等),通过HE染色检查组织病理学变化,免疫组化检测肿瘤组织中ROS水平变化。通过动物实验评价材料体内的代谢过程的生物安全性以及对多个肿瘤模型的治疗效果,探究体内CDT和PTT协同抗肿瘤的疗效。并通过动物实验的结果指导材料制备条件的选择,实现本课题的全部研究目标,为临床提供重要的参考数据。而Fenton/类Fenton反应通常在较低pH值范围内(pH值3~4)充满活力,在TME中细胞外pH值呈微酸性(≈6.5),细胞内pH值呈中性(≈7.2),不足以触发Fenton/类Fenton反应;锰基纳米材料基于Mn2+引发的类Fenton反应的最佳反应pH值接近TME中的pH值,有效克服传统Fenton/类Fenton试剂对篇pH的依赖性,显著提高CDT效率。且Bi2-xMnxO3纳米球有效破坏肿瘤抗氧化系统、提高肿瘤内源性H2O2浓度,调节Bi5+、Mn4+的浓度来提高GSH消耗性能,破坏肿瘤抗氧化系统的平衡,同时高价Bi具有葡萄糖氧化酶活性,提高肿瘤内源性H2O2浓度,显著提高CDT效率。并且Bi2-xMnxO3纳米球具有良好光热性能,增强CDT效果,掺杂Bi显著提高Bi2-xMnxO3的光热性能,提高肿瘤部位的温度进而破坏肿瘤内生物分子进而杀伤肿瘤细胞,并加速肿瘤区域血流量,提高实体瘤药物渗透性,增强CDT治疗效果。
虽然CDT领域发展迅速,但有些问题依然需要解决:(1)为提升CDT疗效提供指导,可以从分子层面上有效探索高效的CDT途径;(2) 为其具备更高效的Fenton反应或类Fenton反应能力,可以设计和调控过渡金属功能材料的元素组分和其相关拓扑结构,以期增加肿瘤区羟基自由基的浓度;(3) 影像诊断技术不断提高,可以对肿瘤病灶区实时评估和监测CDT治疗效果[37]。
综上所述,如果按照实验分析能够成功实施,将拓展锰基复合材料的化学制备以及在生物纳米科技等领域的应用,为肿瘤的多模态成像与治疗、甚至临床试验提供重要的数据与参考,具有重要的科学意义与社会效益。同时如果能够把催化领域的相关知识为CDT研究方法提供对比性研究思路,将会很好地克服化学动疗法目前的技术难点。

