妊娠家兔生殖轴系KISS1和TrkA的分布特征和表达规律
安笑笑,张博皓,戴丽君,白 旭,石 军,张 霞,张 勇,3,张全伟,赵兴绪,3
(1.甘肃农业大学 生命科学技术学院,甘肃 兰州 730070;2.甘肃省动物生殖生理及繁殖调控重点实验室,甘肃 兰州 730070;3.甘肃农业大学 动物医学院,甘肃 兰州 730070)
诱导排卵型动物(如猫、雪貂和骆驼等)在自然条件下繁殖性能较低[1],主要原因是诱导排卵型动物繁殖季节短、早期胚胎死亡率高[2]。因此,探究诱导排卵动物的繁殖生理特点及相关机制,可有效提升其繁殖性能、优化其生产性状,开发和保护其遗传资源。家兔作为典型的诱导排卵型动物之一,体型小、生性温和、繁殖力高、易于饲养,以其建立诱导排卵动物模型,具有独特的优势,可为其他诱导排卵动物如猫科(狮、虎等)、驼科(双峰驼、羊驼等)的诱导排卵机理和特殊生殖机理的研究提供参考。
哺乳动物生殖轴系(下丘脑-垂体-性腺轴系,Hypothalamus-Pituitary-Gonadal axis,HPG)通过调控生殖激素的分泌调节生殖过程[3]。下丘脑分泌的促性腺激素释放激素(Gonadotropin-releasing hormone,GnRH)一方面可促进卵泡膜细胞增殖[4],进而促进卵泡颗粒细胞和卵泡膜细胞分泌孕酮和雌二醇[5-7];另一方面GnRH通过垂体门脉系统调控腺垂体释放促卵泡素(Follicle stimulating hormone,FSH)和促黄体素(Luteinizing hormone,LH)。这些激素作用于卵巢、子宫和胎盘等生殖组织而影响动物的生殖过程。雌激素能够促进妊娠期间绒毛胎盘内新血管形成和子宫内膜的重塑,进而影响胚胎发育,也可刺激子宫和阴道腺上皮增生促进分娩[8-9]。孕激素对早期胚胎发育和着床具有重要作用[10]。孕激素分泌不足严重影响胚胎着床和生长[11]。雌二醇分泌不足可降低胎儿活产率[11]。吻素(KISS1)首先在人类恶性黑色素瘤杂交体系中发现,被认为是一种新的人类恶性黑色素瘤转移抑制因子[12]。KISS1基因编码多肽类激素Kisspeptins,是一种细胞间信号肽,在生殖的神经内分泌调节中扮演重要角色,通过其受体KISS1R的介导来发挥作用。研究发现,KISS1/KISS1R系统是GnRH脉冲发生的上游分子,可有效刺激GnRH促进垂体释放LH调控生殖过程[12-14]。卵巢KISS1/KISS1R系统可促进孕酮分泌,对动物妊娠维持,提高活产率有显著作用;血液中Kisspeptin低水平可导致孕中后期胎儿生长受限、子痫前期并发症[15]。研究表明,酪氨酸蛋白激酶A(Tyrosine protein kinase A,TrkA)对卵泡发育、排卵、激素合成,甚至卵巢疾病发生等都具有重要的调控作用[16]。TrkA作为神经生长因子(Nerve growth factor,NGF)的高亲和力受体,NGF通过TrkA影响神经元细胞分化、存活,同时也参与调控动物生殖活动。甘肃省动物繁殖生理与生殖调控重点实验室早期率先提出双峰驼为诱导排卵型动物,诱导排卵的关键物质为精清诱导排卵因子(Ovulation inducing factor,OIF),并探明其生理作用是引发母驼垂体释放LH形成排卵峰进而诱发其排卵[17]。后续研究证明,OIF的化学本质为神经生长因子[18]。综上所述,KISS1和TrkA在雌性动物生殖过程发挥重要作用,对初情期的启动、卵泡发育和排卵、以及生殖激素的分泌有促进作用,同时局部作用于生殖器官调控动物繁殖过程。然而,KISS1和TrkA在诱导排卵动物生殖轴中的表达情况尚不完全清楚。自发排卵和诱发排卵动物妊娠过程中KISS1和TrkA功能和作用机制及其异同仍有待深入研究。因此,本研究以妊娠家兔(Oryctolaguscuniculusf.domestica)为研究对象,探讨妊娠家兔生殖轴组织中KISS1和TrkA的分布和表达情况。以期为阐释KISS1和TrkA在诱导排卵动物妊娠过程中的生物学功能和作用机制奠定基础。
1 材料和方法
1.1 试验材料
采集妊娠家兔(n=6,妊娠期14~18 d)生殖轴(下丘脑、垂体、卵巢和子宫)组织,部分组织于4%多聚甲醛固定,用于制作组织石蜡切片;部分组织于-80 ℃冻存,提取RNA和蛋白质用于基因和蛋白表达分析。
主要试剂:兔抗TrkA(Code;bs-0193R)、兔抗β-actin(Code;bs-oo61R)、羊抗兔IgG(Code;bs-o295GHRP)、免疫组织化学试剂盒(Code;sp-0022)购自北京博奥森生物公司;兔抗KISS1(Code;18375-1-AP)购自武汉三鹰生物有限公司;DAB(3,3N-diaminobenzidine)显色试剂盒(Code;G1212-200T)购自塞维尔生物科技有限公司;FastPure Cell/Tissue Total RNA lsolation Kit 试剂盒(Code;RC101-01)购自南京诺唯赞生物科技股份有限公司;Evo-MLV反转录试剂盒Ⅱ(Code;AG11711)购自湖南艾科瑞生物科技有限公司;2×EasyPfuPCR SuperMix(Code;AS111)购自北京全式金生物技术有限公司;ECL Plus 超敏发光液(Code;PE0010),高效RIPA组织/细胞裂解液(Code;R0010)、蛋白酶抑制混合液(100×PIC)(Code;P6730)购自北京索莱宝科技有限公司;BCA蛋白浓度测定试剂盒(Code;AR0140)购自武汉博士德生物工程有限公司;其他均为常规化学试剂(分析纯)。
1.2 试验方法
1.2.1 苏木精-伊红染色和免疫组织化学染色 苏木精-伊红染色(Hematoxylin-Eosin Staining,H&E):将4%多聚甲醛固定好的组织通过石蜡包埋制成组织蜡块,切片机制备石蜡组织切片,经脱蜡、苏木素染色、盐酸酒精分化、流水返蓝、伊红复染、中性树胶封片后,镜下摄片分析。免疫组织化学染色(Immunohistochemistry staining,IHC):组织切片经脱蜡,抗原修复,按照免疫组织化学试剂盒(北京,博奥森)说明[19],依次加入3% H2O2、封闭液(A液)、兔源KISS1(1∶500)和TrkA(1∶500)、4 ℃湿盒过夜孵育、试剂B和试剂C 37 ℃孵育、DAB显色、苏木素复染、1%盐酸酒精分化、流水冲洗返蓝、梯度酒精脱水、二甲苯透明后树胶封片,使用Olympus Dp71生显微镜摄片。每个样品重复3次。
1.2.2 引物设计 根据NCBI数据库中家兔KISS1基因(XM_008268539.2)、TrkA基因(XM_008264290.2)和GAPDH基因(NM_001082253.1)CDS序列,使用Primer 3.0设计各基因特异性引物,由西安擎科泽西生物科技有限责任公司合成(表1,2)。

表1 半定量PCR引物序列及参数Tab.1 The primer sequences and parameter of RT-PCR

表2 实时荧光定量PCR引物序列及参数Tab.2 The primer sequences and parameter of qRT-PCR
1.2.3 总RNA的提取及反转录 无菌条件下,取20 mg 组织经液氮研磨后,按照FastPure Cell/Tissue Total RNA lsolation Kit 试剂盒操作说明[20]提取各组织的总RNA,超微量核酸测定仪测定其纯度和浓度,取700 ng总RNA,根据Evo-MLV反转录试剂盒Ⅱ操作说明合成cDNA,产物于-20 ℃保存备用。
1.2.4 半定量PCR(Semi-quantitative interpretation,RT-PCR) 以cDNA为模板、GAPDH为内参进行PCR反应,反应总体系为20 μL,其中2×EasyPfuPCR SuperMix 10 μL,10 μmol/L 上下游引物各1 μL,cDNA 2 μL,RNase free water 6 μL。PCR反应程序为:95 ℃ 预变性5 min;95 ℃ 变性30 s,58.5 ℃退火35 s,72 ℃延伸35 s,共38个循环;72 ℃延伸5 min。取10 μL PCR产物经1.5%琼脂糖凝胶电泳检测,紫外凝胶系统拍片,ImageJ软件进行图像光密度值分析,KISS1和TrkA分别与内参GAPDH灰度值作比值表示基因相对表达量。每个样品重复3次。
1.2.5 实时荧光定量PCR(Real-time fluorescent quantitative PCR,qRT-PCR) 以cDNA为模板、GAPDH为内参进行qRT-PCR反应,反应总体系为20 μL,其中2×TranStart Tip Green qPCR SuperMix 10 μL,10 μmol/L 上下游引物各1 μL,cDNA 1 μL,RNase free water 7 μL。PCR反应程序采用2步法:90 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,共重复40个循环;每个样品重复3次,待反应结束后,观察溶解曲线与扩增曲线,采集Ct值,使用2-ΔΔct法计算mRNA相对表达量并分析目的基因表达模式。
1.2.6 免疫印迹(Western Blot,WB) 组织经液氮研磨后,加入1 mL含有1%苯甲基磺酰氟(Pheny methanesulfonyl fluoride,PMSF)和1%蛋白酶抑制剂(Protease inhibitor mixture,PIC)混合物的高效组织细胞裂解液(Radio immunoprecipitation assay buffer,RIPA),4 ℃反复裂解1 h,离心后取上清液,取适量蛋白通过BCA蛋白浓度测定试剂盒测定其浓度,部分蛋白与5×蛋白上样缓冲液混合,95 ℃变性10 min,样本置于-20 ℃储存备用。每孔上液总蛋白含量为25 μg,12%十二烷基硫酸钠-聚丙烯酰胺凝胶(Sodiumdodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳分离蛋白,湿转法将蛋白转至聚偏二氟乙烯(Polyvinylidene fluoride,PVDF)膜,5%(m/V)脱脂奶粉室温封闭2 h,兔源β-actin(1∶4 500)、兔源TrkA(1∶300)和兔源KISS1(1∶500)于4 ℃孵育过夜,辣根过氧化物酶(Horseradish peroxidase,HRP)标记的二级抗体羊抗兔IgG(1∶5 000)37 ℃孵育2 h,底物化学发光液(Electronchemi-luminescence,ECL)发光显色、化学发光仪曝光、Image Pro Plus 6.0软件进行图像分析,KISS1和TrkA蛋白灰度值与内参β-actin蛋白灰度值作比值表示蛋白相对表达量。每个样品重复3次。
2 结果与分析
2.1 妊娠家兔生殖轴组织形态学观察
H&E染色结果如图1所示,妊娠家兔下丘脑组织中可见细胞较小、核圆、着色较深的神经内分泌小细胞。细胞较大、呈不规则形状、胞核形态不一、胞质被染成红色为神经内分泌大细胞(图1-A)。腺垂体组织中嗜碱性细胞可见椭圆形或多边形、胞质呈紫色、胞核圆、着色较深;嗜酸性细胞胞质被染成红色、细胞核圆、着色浅;嫌色细胞较小、呈多角形或圆形、细胞质染色较浅、光镜下细胞轮廓不明显(图1-B)。家兔卵巢组织由不同发育阶段的卵泡、结缔组织及疏松组织组成;初级卵泡中明显可见初级卵母细胞、卵泡细胞、透明带组织,结缔组织中含卵巢间质细胞(图1-C);次级卵泡中卵泡细胞层数变多,可见明显的卵泡腔;卵泡细胞最内层是大量颗粒细胞,卵泡膜分化为内外2层(图1-D)。黄体中分布有膜黄体细胞和颗粒黄体细胞,膜黄体细胞数量较少,染色深,多分布于黄体周边;颗粒黄体细胞较大、呈多边形、数量多 (图1-E)。家兔子宫组织可见子宫腺和固有层,其中,固有层细胞数量少,有胚性结缔组织和丰富的血管;子宫腺由排列紧密的单层柱状上皮细胞组成(图1-F)。

A.下丘脑;B.垂体;C和D.卵巢;E.黄体;F.子宫;A~F放大倍数均为400× 。 MNEC.神经内分泌大细胞;PNEC.神经内分泌小细胞;CC.嫌色细胞;BC.嗜碱性细胞;EC.嗜酸性细胞;PO.初级卵母细胞;ZP.透明带;FC.卵泡细胞;PF.初级卵泡;IC.间质细胞;FA.卵泡腔;SG.颗粒层;TFI.卵泡膜内层;TFE.卵泡膜外层;SO.次级卵母细胞;GLC.颗粒黄体细胞;TLC.膜黄体细胞;UG.子宫腺;LP.固有层。图2同。
2.2 妊娠家兔生殖轴组织中KISS1和TrkA蛋白分布
妊娠家兔生殖轴组织中KISS1和TrkA蛋白免疫阳性结果如图2所示,下丘脑组织未见KISS1蛋白免疫阳性表达(图2-A1)。垂体组织各细胞中均有KISS1蛋白免疫阳性反应,主要分布于嗜碱性细胞(图2-A2);卵巢组织透明带可见KISS1蛋白阳性表达(图2-A3);子宫组织未见KISS1蛋白免疫阳性表达(图2-A4)。TrkA蛋白在生殖轴组织中均有阳性表达 (图2-B)。下丘脑神经内分泌小细胞被特异性显色为棕黄色(图2-B1);垂体嗜碱性细胞有明显的TrkA蛋白免疫阳性反应(图2-B2);卵巢颗粒黄体细胞和间质细胞可见TrkA蛋白阳性表达(图2-B3);子宫固有层显示TrkA蛋白阳性分布(图2-B4)。阴性对照组均无阳性反应(图2-C)。
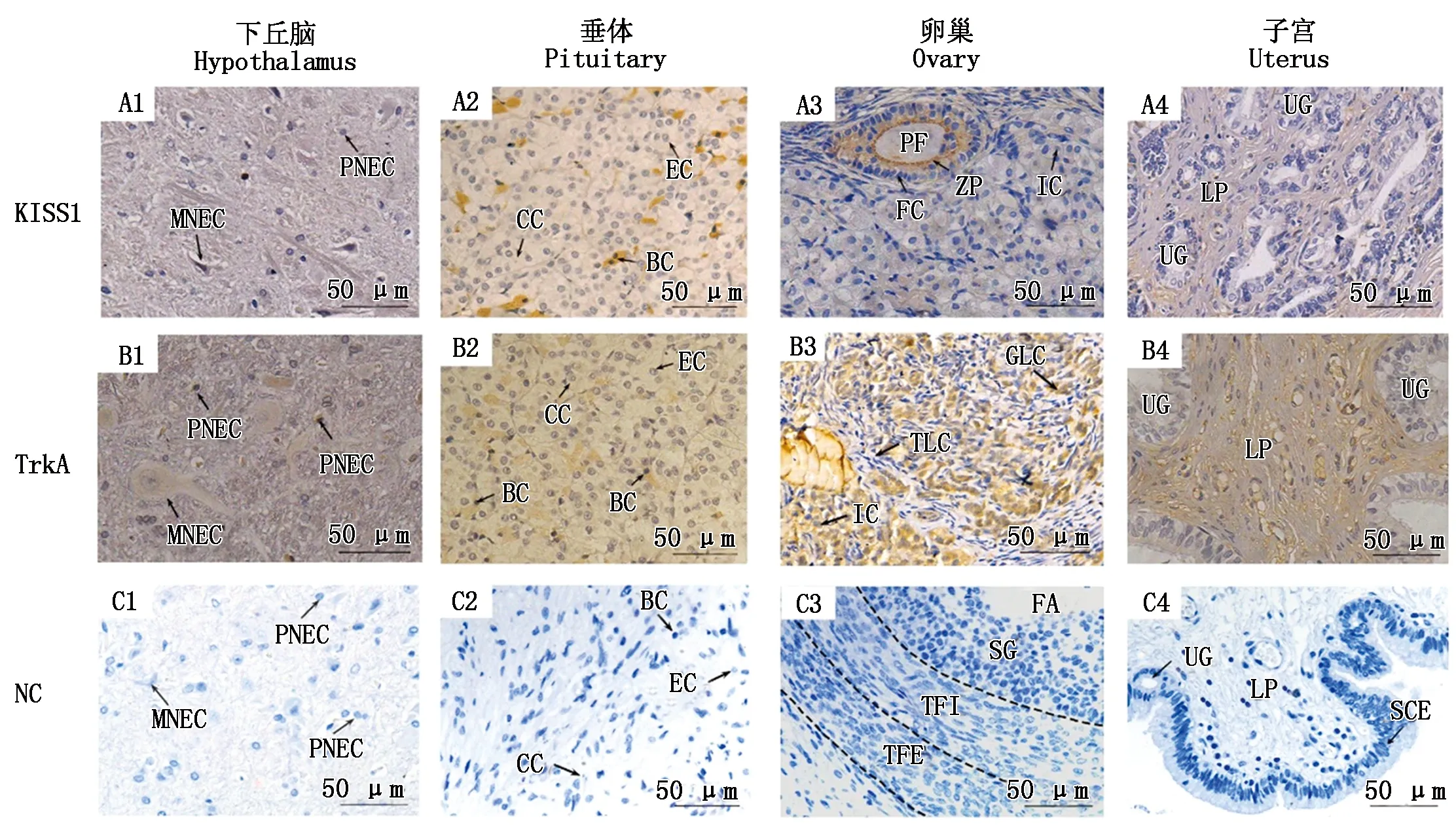
A.KISS1蛋白IHC染色;B.TrkA蛋白IHC染色;C.阴性对照(A~C放大倍数均为400×)。SCE.单层柱状上皮。A.KISS1 protein was stained by immunohistochemically;B.TrkA protein was stained by immunohistochemically;C.Negative control(The magnification of A—C was 400×).SCE.Simple columnar epithelium.
2.3 妊娠家兔生殖轴组织中Kiss1和TrkA基因表达
2.3.1 半定量PCR 妊娠家兔生殖轴组织中KISS1和TrkA基因的表达规律如图3所示,KISS1和TrkA基因在各组织中均有表达(图3-A′)。光密度值统计结果表明,下丘脑、垂体、卵巢组织中KISS1表达量均高于子宫,卵巢组织中KISS1表达丰度最高,下丘脑次之,且各组织存在显著性差异(P<0.05)(图3-B′)。 妊娠家兔卵巢、垂体组织中TrkA基因表达丰度极显著低于子宫组织,其中垂体相对表达量最低,组间差异极显著(P<0.01),下丘脑与子宫组织TrkA表达量无显著差异 (图3-C′)。

A′.琼脂糖凝胶电泳检测妊娠家兔生殖轴组织中KISS1和TrkA mRNA表达丰度。 B′. KISS1 mRNA表达水平。C′.TrkA mRNA表达水平。不同小写字母代表组间差异显著(P<0.05);不同大写字母代表组间差异极显著(P<0.01)。 图4—5同。
2.3.2 实时荧光定量PCR 通过qRT-PCR检测妊娠家兔HPG组织中KISS1和TrkA基因表达模式,结果如图4所示,KISS1和TrkA基因在生殖轴各组织中均有表达。数据显示,KISS1相对表达量从大到小依次是卵巢、下丘脑、垂体、子宫。且卵巢和下丘脑组织与垂体和子宫组织表达量存在显著性差异(P<0.05)(图4-A)。 妊娠家兔垂体、卵巢、子宫组织中TrkA基因表达丰度依次呈上升趋势,下丘脑与子宫组织TrkA表达量无显著差异,与垂体、卵巢组织组间差异极显著(P<0.01)(图4-B)。且qRT-PCR结果与RT-PCR结果趋势一致,但组间差异性与RT-PCR结果不完全一致,这可能与不同引物序列相关。

图4 qRT-PCR分析妊娠家兔生殖轴组织中KISS1和TrkA mRNA表达规律Fig.4 Relative expression levels of KISS1 and TrkA mRNA in the HPG axis of pregnant Oryctolagus cuniculus f. domestica with qRT-PCR
2.4 妊娠家兔生殖轴组织中KISS1和TrkA蛋白表达
妊娠家兔生殖轴组织中KISS1和TrkA蛋白表达如图5所示,KISS1蛋白仅在垂体组织中表达,TrkA蛋白在下丘脑、垂体、卵巢、子宫中均有表达(图5-A)。KISS1蛋白在垂体组织相对表达灰度值统计结果高达180.04(图5-B);子宫组织中TrkA蛋白相对表达量最高,其次依次为卵巢、垂体,下丘脑中表达量最低(图5-C),且各组织间存在显著性差异(P<0.05)。

A.聚丙酰胺凝胶电泳检测妊娠家兔生殖轴组织中KISS1、TrkA和β-actin蛋白表达丰度。A.The protein expression levels of KISS1,TrkA and β-actin in HPG axis tissues of pregnant rabbits were detected by polyproacrylamide gel electrophoresis.
3 结论与讨论
妊娠是哺乳动物种系繁衍的关键生理过程。妊娠维持不仅受孕酮的调节,且依赖生殖轴分泌的生殖激素协调作用。妊娠过程中生殖轴适应性变化、生殖激素信号传递、相关基因及蛋白的时空特异性表达均发挥重要调节作用。妊娠识别后,卵巢合成和分泌的孕酮通过反馈机制抑制下丘脑神经内分泌小细胞和垂体嗜碱性细胞释放GnRH、FSH和LH,从而阻止卵泡发育、排卵,暂时停止母体发情周期。研究报道,自发排卵动物中KISS1和TrkA可通过生殖轴调控动物生殖,也可与其特异性受体或配体结合局部调节生殖轴器官的功能[21-22]。但其在诱导排卵动物中的功能尚不明确,因此,阐明KISS1和TrkA在诱导排卵型动物生殖轴组织中的分布特征、表达规律和其功能将有助于深入探究诱导排卵型动物的生殖机理。
通过H&E染色系统性观察了妊娠家兔HPG组织的形态变化。HPG组织结构清晰完整。下丘脑被分为若干核团,具有分泌催产素和加压素功能的神经内分泌大细胞主要分布在视上核和室旁核,而分布在正中隆起、弓状核的神经内分泌小细胞通过分泌释放激素,经门脉系统到达腺垂体,进而调节腺垂体的生理功能和生殖激素分泌。腺垂体嗜碱性细胞合成和分泌的FSH和LH,协同作用于卵巢可促进卵泡成熟、控制卵子排出、调节卵巢功能[23]。黄体细胞分泌的孕酮作用于子宫,改善子宫营养,维持正常妊娠过程[3]。这些细胞均参与动物生殖和妊娠过程。Smith等[24]研究发现,在绵羊垂体中存在KISS1R表达并刺激LH分泌增加。本研究免疫组织化学染色发现KISS蛋白主要定位于垂体嗜碱性细胞胞浆和透明带中。结果表明,KISS1阳性表达与妊娠维持密切相关。研究报道,Kisspeptin及其受体KISS1R 在自发排卵动物外周组织尤其是与生殖和代谢相关的组织如下丘脑、垂体、卵巢、子宫、胎盘、睾丸、脂肪组织、胰腺和肝脏中广泛表达[21,25-27];妊娠家兔性腺轴组织KISS1蛋白表达与文献报道自发排卵动物在组织中的表达情况存在差异,说明自发排卵动物与诱导排卵动物生殖调控机制存在异同。研究发现,TrkA在雌性动物生殖器官中广泛表达[16,28-29],促性腺激素、雌激素、孕酮等能刺激TrkA及其配体NGF的表达,而NGF也能刺激孕激素和雄激素的释放,影响卵泡发育成熟、控制卵母细胞排出、调节卵巢功能、影响早期胚胎的发育能力[29-30]。本研究发现,TrkA蛋白存在于妊娠家兔所有生殖轴组织中,主要分布在生殖轴各组织内分泌细胞中。结果表明,TrkA可能是通过参与调控生殖轴组织生殖激素的合成和分泌,进而调节家兔的妊娠过程[22,31-33]。RT-PCR和qRT-PCR显示,妊娠家兔HPG组织均有KISS1基因表达,而WB结果显示,KISS1蛋白仅在垂体组织中表达;KISS1基因和蛋白水平表达趋势的不一致可能与真核生物转录和翻译存在时空间隔有关[34]。妊娠家兔TrkA基因和蛋白表达量在子宫中最高,说明TrkA参与调控子宫生理功能和妊娠维持。据报道,TrkA表达异常导致宫颈癌的发生,其表达水平与患者的肿瘤临床病理特征及预后有关[35]。研究结果显示,KISS1和TrkA通过生殖轴组织调控家兔妊娠过程。前人研究也表明,KISS1和TrkA在自发排卵型动物生殖轴内分泌激素的调控过程中发挥重要作用,但对具体调控机制的研究还不完善,仍需深入研究。本研究为诱导排卵动物妊娠过程中KISS1和TrkA的分子功能和机制的深入研究提供参考依据。
KISS1蛋白免疫阳性反应主要定位于妊娠家兔腺垂体嗜碱性细胞,TrkA蛋白在妊娠家兔生殖轴组织中均有免疫表达且主要定位于内分泌细胞。妊娠家兔生殖轴组织中KISS1和TrkA基因与蛋白均有表达且其表达趋势存在差异。结果表明,KISS1和TrkA可能通过调节生殖激素分泌维持诱导排卵型动物妊娠并影响其生殖轴器官的生长发育和功能。这为后续诱导排卵动物繁殖调控机制的研究提供参考依据。

