土茯苓总黄酮通过p38/ERK MAPK通路调控膜性肾病大鼠足细胞上皮-间充质转化的作用机制研究
孙杰瑜,孙博蕊
(中国医科大学附属第一医院,辽宁 沈阳 110000)
膜性肾病(membranous nephropathy,MN)一种自身免疫性疾病,是成人终末期肾病常见原因之一。MN又细分为特发性MN(idiopathic membranous nephropathy,IMN)和继发性MN两种,IMN以肾病综合征为主要临床特征(如蛋白尿、血尿、低白蛋白血症等),而继发性MN还伴有原发病表现。常见发病原因有感染、自身免疫性疾病、恶性肿瘤及药物等[1-2]。因MN疾病异质性,目前治疗方案仍存在争议,迫切需要更具前景的药物进行治疗。土茯苓根茎主要用于治疗重金属中毒、肾炎和炎症性疾病,还可作为功能性成分添加于药膳中。现代药理学研究发现,土茯苓具有多种生物活性,如抗炎、抑菌、抗痛风、肝和心脑血管保护作用[3]。土茯苓提取物中主要有效成分为黄酮类化合物,其中土茯苓总黄酮(smilax glabra flavonoids,SGF)具有较强抗氧化、降尿酸和肝、肾保护作用[4]。本研究拟通过建立大鼠MN模型,探讨SGF对MN模型的作用和机制。
1 材料与方法
1.1 实验动物 100只7周龄SPF级雄性健康SD大鼠,体质量180~220 g,购自安徽医科大学,动物生产许可证号:SCXK(皖)2017-001。购入后保持室内温度(23±2)℃,空气相对湿度(65±5)%,光照昼夜交替循环12 h,适应性饲养1周。尿蛋白试纸定性检测大鼠尿蛋白,结果均为阴性,且测其24 h尿蛋白定量(urine total protein,UTP)均<10 mg。本研究符合动物伦理要求,实验过程严格遵守《实验动物管理条例》。
1.2 药物与试剂 茯苓总黄酮(SGF)(纯度≥98%,批号:191028)购自通化德济药材公司;环孢素口服溶液(国药准字H10930130,批号:190916)购自杭州中美华东制药有限公司;Trizol试剂(批号:15596026)购自美国Invitrogen公司;白细胞介素-4(interleukin-4,IL-4)ELISA试剂盒(批号:SEKR-0004)、转化生长因子β1(transforming growth factor-β1,TGF-β1)ELISA试剂盒(批号:SERK-0012)、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)ELISA试剂盒(批号:SEKR-0009)、DAB显色试剂盒(批号:DA1015)、TUNEL试剂盒(批号:T2190)、RIPA裂解液(批号:R0010)均购自北京索莱宝科技有限公司;弗氏不完全佐剂(批号:F5506)、阳离子牛血清白蛋白(cationic bovine serum albumin,C-BSA)(批号:NA-BD6-1)购自美国Sigma公司;兔抗大鼠细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)(批号:ab184699)、磷酸化细胞外调节蛋白激酶(phosphorylated extracellular regulatory protein kinase,p-ERK)(批号:ab201015)、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)(批 号:ab4822)、磷酸化p38丝裂原活化蛋白激酶(phosphorylated p38 mitogen -activated protein kinase,p -p38MAPK)(批 号:ab178867)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单抗(批号:ab181602)、α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)多抗(批号:ab124964)、裂孔隔膜蛋白分子(Nephrin)多抗(批号:ab216341)和山羊抗兔二抗IgG(批号:ab6721)均购自英国Abcam公司。
1.3 主要仪器 cobas c501型全自动生化分析仪(瑞士Roche公司);Multiskan GO型酶标仪(美国thermofisher公司);NP-T1型脱水机和NP-B1型包埋机(孝感市诺普电子科技有限责任公司);RM2016型病理切片机(德国徕卡公司);7500型实时荧光定量PCR仪(美国ABI公司);DYCZ-24F型电泳仪(北京六一生物科技有限公司)。
1.4 造模与分组 随机取80只大鼠建立MN模型,依据Border法制备C-BSA于-80 ℃冰箱密封存储备用。预免疫:取1 mg C-BSA溶于0.5 mL PBS,加入等体积弗氏不完全佐剂混匀并充分乳化后,在大鼠腋下和腹股沟等多点皮下不同部位注射1 mL C-BSA乳化液进行预免疫,隔日1次,每周3次,共计1周;正式免疫:大鼠尾静脉注射16 mg/kg C-BSA(溶于1 mL pH值=7.4 PBS),隔日1次,每周3次,共计4周[5]。造模结束后,尿蛋白试纸检测大鼠尿蛋白为阳性,并随机处死2只造模大鼠,进行病理学检查,出现肾小球基底膜(glomerular basement membrane,GBM)上皮下免疫复合物沉积,导致GBM弥漫性增厚,即造模成功[6]。除2只大鼠无任何症状外,剩余76只大鼠造模成功。将造模成功大鼠随机分为模型组、SGF低剂量组、SGF高剂量组和阳性药物组,每组19只。余下20只未造模大鼠作为对照组。预免疫:对照组在其相同位置注射等体积的生理盐水与弗氏不完全佐剂混合溶液,隔日1次,每周3次,共计1周;正式免疫:对照组大鼠尾静脉注射等体积生理盐水,隔日1次,每周3次,共计4周。
1.5 实验给药 造模成功24 h后,参照文献[7]用量,SGF低、高剂量组大鼠按15、30 mg/(kg·d)剂量灌胃SGF溶液;阳性药物组大鼠按10 mg/(kg·d)剂量灌胃给予环孢素口服溶液,对照组和模型组大鼠灌胃等体积生理盐水,1次/d,共计6周。
1.6 观察指标
1.6.1 常规指标检测 末次给药后24 h,代谢笼收集当日7:00:00至次日7∶00∶00大鼠24 h尿液,量杯计算总尿量,采用全自动生化分析仪测定24 h UTP。留尿结束后,戊巴比妥钠麻醉大鼠,剖开腹腔,取主动脉血,4 ℃3 000 r/min离心10 min,离心半径20 cm,取血清,全自动生化分析仪检测血清血肌酐(serum creatinine,Scr)、血尿素氮(blood urea nitrogen,BUN)的含量。
1.6.2 血清IL-4、TGF-β1、TNF-α水平检测 常规指标检测结束后,ELISA法检测血清IL-4、TGF-β1、TNF-α含量。严格按照ELISA试剂盒说明书进行操作。
1.6.3 肾脏病理学观察 脱颈椎处死大鼠,左侧肾脏取2 mm×2 mm×10 mm的新鲜皮质,石蜡包埋,切片4 μm,脱蜡20 min,苏木精染色3~5 min,伊红染色2 min,脱水,二甲苯透化10 min,中性树脂封固,光学显微镜观察。
1.6.4 肾脏细胞凋亡检测 取肾脏切片,脱蜡至水,37 ℃蛋白酶K孵育30 min,依据TUNEL试剂盒说明书对切片染色、终止反应、封片等,5个不同视野下显微镜观察肾脏肾小球足细胞(podocyte,PC)凋亡情况,计算凋亡指数(apoptoticindex,AI)。AI(%)=凋亡细胞数/总细胞数×100%。
1.6.5 ERK mRNA、p38MAPK mRNA、Nephrin mRNA、α-SMA mRNA水平检测 取一半右侧肾脏皮质,匀浆,Trizol法提取RNA,测纯度、浓度,逆转录得cDNA,实时荧光定量PCR反应。反应体系:1.8 μL Taq聚合酶、1 μL上下游引物、4 μL模板cDNA、13.2 μL ddH2O。扩增条件:94 ℃预变性30 s、94 ℃变性5 s、59 ℃退火30 s,共40个循环,加熔解曲线,50 ℃降温30 s。GAPDH为内参对照,数据分析采用2-△△Ct法,重复多次,取Ct均值。引物序列见表1。

表1 引物序列
1.6.6 ERK、p-ERK、p38MAPK、p-p38MAPK、Nephrin、α-SMA蛋白水平检测 取剩余右侧肾脏皮质,加RIPA裂解缓冲液,离心取上清,蛋白BCA试剂盒确定总蛋白浓度,100 V电泳分离80 min,250 mA转至PVDF膜,5%脱脂牛奶磷酸盐缓冲液封闭2 h,样品与ERK(1∶500)、p-ERK(1∶250)、p38MAPK(1∶500)、p-p38MAPK(1∶250)、Nephrin(1∶250)和α-SMA(1∶500)一抗4 ℃过夜孵育,TBST缓冲液洗膜,加二抗(HRP标记IgG,1∶2 000)室温孵育2 h,洗膜,曝光,显影。Image J软件测样品条带与GAPDH条带灰度值。计算目标蛋白相对表达量,即目标条带与GAPDH条带灰度比值。
1.7 统计学方法 采用SPSS 27.0统计学软件进行数据分析,计量资料采用“均数±标准差”()表示,采用Levene检验方差齐性,如检验方差齐,多样本计量资料比较采用单因素方差分析,进一步两两比较采用LSD-t检验;如方差不齐,则用Welch's t检验,再行Dunnett's T3检验进行两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠24 h UTP、Scr、BUN水平比较 与对照组比较,模型组大鼠24 h UTP、Scr、BUN水平均明显升高(P<0.05);与模型组比较,SGF低剂量组、SGF高剂量组及阳性药物组大鼠24 h UTP、Scr、BUN水平均明显降低(P<0.05);与SGF低剂量组比较,SGF高剂量组及阳性药物组大鼠24 h UTP、Scr、BUN水平均明显降低(P<0.05),且阳性药物组低于SGF高剂量组(P<0.05)。(见表2)
表2 各组大鼠24 h UTP、Scr、BUN 水平比较()

表2 各组大鼠24 h UTP、Scr、BUN 水平比较()
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与SGF低剂量组比较,cP<0.05;与SGF高剂量组比较,dP<0.05
2.2 各组大鼠血清IL-4、TGF-β1、TNF-α水平比较 与对照组比较,模型组大鼠TNF-α水平明显升高(P<0.05),IL-4、TGF-β1水平明显降低(P<0.05);与模型组比较,SGF低剂量组、SGF高剂量组及阳性药物组大鼠TNF-α水平均明显降低(P<0.05),IL-4、TGF-β1水平均明显升高(P<0.05);与SGF低剂量组比较,SGF高剂量组及阳性药物组TNF-α水平均明显降低(P<0.05),IL-4、TGF-β1水平均明显升高(P<0.05);与SGF高剂量组比较,阳性药物组大鼠TNF-α水平明显降低(P<0.05),IL-4、TGF-β1水平明显升高(P<0.05)。(见表3)
表3 各组大鼠血清IL-4、TGF-β、TNF-α 水平比较()

表3 各组大鼠血清IL-4、TGF-β、TNF-α 水平比较()
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与SGF低剂量组比较,cP<0.05;与SGF高剂量组比较,dP<0.05
2.3 各组大鼠肾脏病理学改变情况 对照组大鼠肾皮质内肾小球结构清晰,形态完整,细胞排列整齐,无系膜与基质增生;模型组大鼠肾小球体积增大,细胞萎缩,系膜与基质出现明显增生,肾小管扩张;SGF低剂量组大鼠肾小球体积增大,系膜与基质增生,基底膜皱曲;SGF高剂量组大鼠肾小球基底膜增生减轻,上皮细胞水肿减轻;阳性药物组大鼠肾小球基底膜增生减轻,细胞萎缩减少,上皮细胞水肿减轻。(见图1)

图1 各组大鼠肾组织病理学改变比较(HE,×400)
2.4 各组大鼠肾脏肾小球足细胞AI比较 凋亡细胞呈棕黄色染色,对照组大鼠几乎未见凋亡细胞;模型组大鼠阳性染色细胞明显增多;SGF低剂量组大鼠肾小球体积增大,棕黄色阳性染色细胞减少;SGF高剂量组大鼠细胞排列紊乱,肾小球结构模糊,阳性染色细胞明显减少;阳性药物组大鼠肾小球结构清晰,基底膜稍增厚,阳性染色细胞减少。(见图2)

图2 各组大鼠肾脏肾小球足细胞凋亡情况(TUNEL,×400)
与对照组比较,模型组大鼠肾皮质组织肾小球足细胞AI明显升高(P<0.05);与模型组比较,SGF低剂量组、SGF高剂量组及阳性药物组大鼠肾皮质组织肾小球足细胞AI均明显降低(P<0.05);与SGF低剂量组比较,SGF高剂量组及阳性药物组大鼠肾皮质组织肾小球足细胞AI均明显降低(P<0.05),且阳性药物组低于SGF高剂量组(P<0.05)。(见表4)
表4 各组大鼠肾脏肾小球足细胞AI 比较()
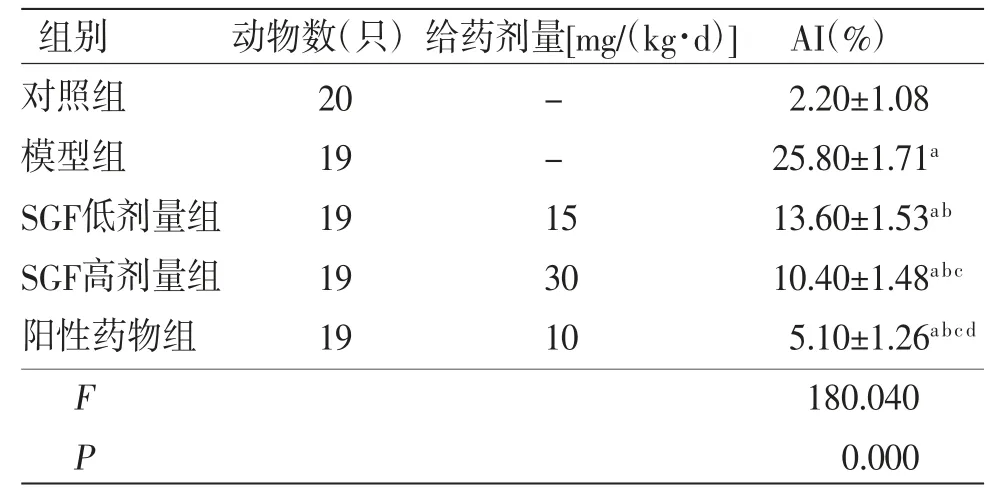
表4 各组大鼠肾脏肾小球足细胞AI 比较()
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与SGF低剂量组比较,cP<0.05;与SGF高剂量组比较,dP<0.05
2.5 各组大鼠肾组织ERK mRNA、p38MAPK mRNA、Nephrin mRNA、α-SMA mRNA相对表达量比较 与对照组比较,模型组大鼠肾组织α-SMA mRNA相对表达量明显升高(P<0.05),Nephrin mRNA相对表达量明显降低(P<0.05);与模型组比较,SGF低剂量组、SGF高剂量组及阳性药物组大鼠肾组织α-SMA mRNA相对表达量均明显降低(P<0.05),Nephrin mRNA相对表达量均明显升高(P<0.05);与SGF低剂量组比较,SGF高剂量组及阳性药物组大鼠肾组织α-SMA mRNA相对表达量均明显降低(P<0.05),Nephrin mRNA相对表达量均明显升高(P<0.05);与SGF高剂量组比较,阳性药物组大鼠肾组织α-SMA mRNA相对表达量明显降低(P<0.05),Nephrin mRNA相对表达量明显升高(P<0.05)。5组大鼠肾组织ERK mRNA、p38MAPK mRNA相对表达量比较,差异均无统计学意义(P>0.05)。(见表5)
表5 各组大鼠肾组织ERK mRNA、p38MAPK mRNA、Nephrin mRNA、α-SMA mRNA 相对表达量比较()

表5 各组大鼠肾组织ERK mRNA、p38MAPK mRNA、Nephrin mRNA、α-SMA mRNA 相对表达量比较()
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与SGF低剂量组比较,cP<0.05;与SGF高剂量组比较,dP<0.05
2.6 各组大鼠肾组织ERK、p-ERK、p38MAPK、p-p38MAPK、Nephrin、α-SMA蛋白相对表达量比较 与对照组比较,模型组大鼠肾组织p-ERK、p-p38MAPK、α-SMA蛋白相对表达量均明显升高(P<0.05),Nephrin蛋白相对表达量明显降低(P<0.05);与模型组比较,SGF低剂量组、SGF高剂量组及阳性药物组大鼠肾组织p-ERK、p-p38MAPK、α-SMA蛋白相对表达量均明显降低(P<0.05),Nephrin蛋白相对表达量均明显升高(P<0.05);与SGF低剂量组比较,SGF高剂量组及阳性药物组大鼠肾组织p-ERK、p-p38MAPK、α-SMA蛋白相对表达量均明显降低(P<0.05),Nephrin蛋白相对表达量均明显升高(P<0.05);与SGF高剂量组比较,阳性药物组大鼠肾组织p-ERK、p-p38MAPK、α-SMA蛋白相对表达量均明显降低(P<0.05),Nephrin蛋白相对表达量均明显升高(P<0.05)。5组大鼠肾组织ERK、p38MAPK蛋白相对表达量比较,差异均无统计学意义(P>0.05)。(见表6、图3)
表6 各组大鼠肾组织ERK、p-ERK、p38MAPK、p-p38MAPK、Nephrin、α-SMA 蛋白相对表达量比较()

表6 各组大鼠肾组织ERK、p-ERK、p38MAPK、p-p38MAPK、Nephrin、α-SMA 蛋白相对表达量比较()
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与SGF低剂量组比较,cP<0.05;与SGF高剂量组比较,dP<0.05

图3 各组大鼠肾组织ERK、p-ERK、p38MAPK、p-p38MAPK、Nephrin、α-SMA 蛋白表达Western blotting 图
3 讨论
IMN是一类以肾小球足细胞(PC)损伤为核心机制的自身免疫性肾脏病,近年来发病率不断攀升,是终末期肾脏病主因[8]。IMN的病理特征普遍认为是PC膜上形成的抗原-抗体复合物,沉积于肾小球基膜(GBM)上皮细胞下,进而激活补体引起肾损害,主要体现为大量蛋白尿、低蛋白血症、渐进性肾功能受损[9]。目前本病发病机制尚不明确,且常用免疫抑制类药物存在诸多不良反应,目前IMN仍缺乏特异性治疗方案。故本研究通过建立MN大鼠模型,探讨SGF对MN大鼠EMT的影响及作用机制。
MN发病机理复杂,且和诸多因素有关。随着PC细胞株构建及生化技术发展,PC应用越来越广泛。PC即肾小球上皮细胞,属于高度特化细胞,拥有规则的间隔足突,与GBM和肾小球内皮细胞一起,维持肾血尿过滤屏障功能。MN发生过程中,由于免疫复合物激活补体级联反应,导致PC受损[10]。PC损伤被确定为MN典型特征,也被认为是诱发蛋白尿和肾小球硬化的关键因素,其损伤导致细胞丢失和蛋白尿产生,且PC丢失已成为早期病理的重要标记物[11]。大量研究表明,PC损伤潜在机制与多种生理变化有关,如细胞因子激活、炎症和细胞凋亡等,但肾损伤PC具体机制尚未阐明[12]。PC损伤可导致阿霉素诱导的肾病综合征大鼠足突广泛融合和严重蛋白尿现象。已有研究证实,PC功能障碍可能通过EMT导致蛋白尿,阻断EMT可逆转早期阶段PC凋亡[13]。本研究发现,药物干预后,大鼠常规生化指标24 h UTP、Scr、BUN水平和血清IL-4、TGF-β1、TNF-α水平降低,肾小球足细胞AI降低,炎症反应得到改善。HE结果显示,SGF高、低剂量组大鼠肾脏病理损伤较模型组出现明显改善,PC足突融合减少,提示SGF可通过减少肾小球PC凋亡,从而减缓大鼠肾脏病变,改善炎症反应,阻止MN发展。
作为MAPK信号通路重要分支,p38和多种病理生理过程密切相关。p38MAPK是MAPK超家族成员重要组成部分。p-p38MAPK表达升高,可导致PC凋亡,进而引起GBM滤过屏障受到破坏,以致产生大量蛋白尿[14]。MAPK通路活化与PC损伤、足突融合、蛋白尿发生有关。Nephrin是PC足突间裂孔膜(slitdiaphragm,SD)结构蛋白成员,特异表达于SD区,是PC上皮细胞表型之一[15]。α-SMA是肌成纤维细胞(myofibroblast,Myo F)标志蛋白,纤维细胞激活可高表达,肾脏固有细胞在转分化成Myo F后合成α-SMA,因此,α-SMA表达高低可间接反映肾脏固有细胞向肌成纤维转化的程度[16]。α-SMA是上皮细胞EMT及纤维化标志蛋白,纤维化是MN向肾小球硬化发展的最终途径。研究发现,在IMN发病过程中,PC发生EMT,上皮细胞样表型标记物Nephrin表达下调,间充质细胞样表型标记物结蛋白(Desmin)表达上调,导致PC形态和功能异常,肾小球滤过屏障受损,形成蛋白尿[17]。本研究结果显示,与模型组比较,SGF高、低剂量组大鼠肾组织Nephrin mRNA和蛋白相对表达量明显升高,α-SMA mRNA和蛋白相对表达量及p-ERK、p-p38MAPK蛋白相对表达量明显降低,说明p38/ERK MAPK通路被抑制,揭示SGF可能通过抑制其通路,进而调控PC损伤与细胞凋亡。
综上所述,SGF能抑制MN大鼠EMT,可能通过调控p38/ERK MAPK通路相关分子表达发挥作用。

