部分发达国家(地区)药物临床试验质量检查现状及启示
赵扬,尚红叶,杜光
(1.国家药品监督管理局高级研修学院研修一部,北京 100073;2.华中科技大学同济医学院附属同济医院药学部,武汉 430030)
国家药品监督管理局、国家卫生健康委员会发布的新版《药物临床试验质量管理规范》(good clinical practice,GCP)已于2020年7月1日起正式实施。新版GCP对药物临床试验质量检查(简称GCP检查)做了更为严格的规定,这标志着我国药物临床研究开启了新的发展阶段。
由国家药品监管部门直接组织或授权组织实施的GCP检查是各国政府对药物临床试验进行监管的主要手段。近年发展起来的基于风险的质量管理(risk based quality management,RBM)理念被越来越广泛地接受[1],并被引入GCP检查中,使得原有的监管检查模式发生巨大变化。2011—2013年,美国食品药品管理局(FDA)相继推出新的临床研究监查指导原则《临床研究监管:基于风险的监查》草案和正式实施版本[2];欧盟药品管理局(European Medicines Agency,EMA)也于2013年12月颁布了《关于临床试验基于风险的质量管理的思考》[3];国际人用药品注册技术协调会(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH)于2016年11月发布的药物临床试验质量管理规范[guideline for good clinical practice,ICH-GCP E6(R2)]中提出建立基于风险的质量管理体系[4]。美国、欧盟、英国、日本等4个发达国家(地区)均定期将上年度GCP检查报告公开披露,内容覆盖检查范围及主要存在的问题。遵循不同国家(地区)的GCP要求,其GCP检查报告采用的统计口径有所不同。
为配合学习新版GCP,笔者对美国、欧盟、英国、日本等发达国家(地区)的GCP检查报告、以及其中发现和提出的问题进行梳理,以期为我国药物临床试验质量管理提供参考。
1 美国GCP检查报告结果
FDA的GCP检查结果一般分为无需行动(no action indicated,NAI)、自愿整改(voluntary action indicated,VAI)、官方行动(official action indicated,OAI)3种情况。
最新检查报告显示[5],FDA在2018财年共开展各类检查1622项,其中对研究者进行检查发现的问题包括:未按照已签署的研究声明或协议/研究计划/适用法规进行研究;病例资料不充分或不准确;受试者/项目(subject)记录不充分;药品/器械处置记录不充分;未严格按照规范履行受试者知情同意等(表1)。
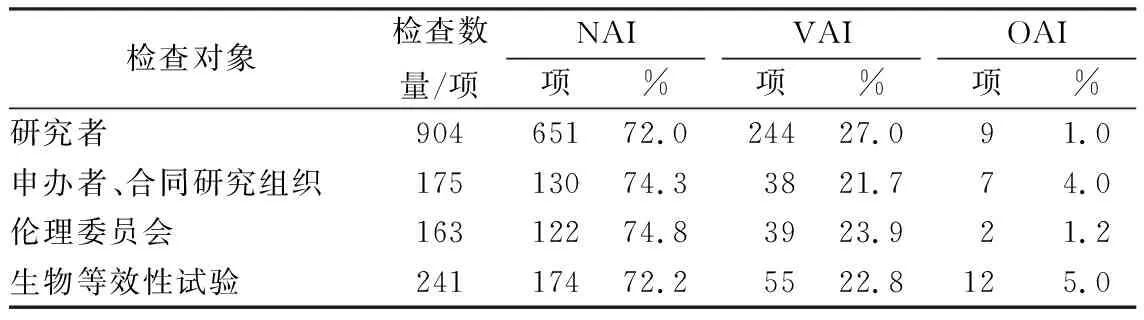
表1 美国GCP检查报告结果统计
对伦理委员会(institutional review board,IRB)进行检查发现的主要问题包括:会议纪要不完善;委员名册不全;首次和持续的研究审查不够;缺乏对违规、中止或终止及时报告等。
对申办者、合同研究组织(contract research organization,CRO)进行检查发现的主要问题包括:无法确保适当监控、无法确保根据整体研究计划和协议进行调查研究、无法及时告知FDA/IRB/研究人员重大的新信息或新不良反应等。
对生物等效性试验进行检查发现的主要问题包括保存记录、编盲、标准操作程序(standard operation procedures,SOPs)、纳入/排除标准及实验室分析等方面存在不规范。
FDA在合规项目指导手册(compliance program guidance manuals CPGM7348.810)中,针对申办方/CRO及监查员明确列出检查内容,包括组织架构和人员、ClinicalTrials.gov平台注册信息、临床研究者选择和监督、监督步骤和活动、质量控制、安全数据、不良事件报告、药品管理等具体核查内容。近10年来,FDA对临床试验申办者的现场核查比例逐年上升并始终维持一定比例,持续增高的检查强度取得明显结果,即申办方/CRO因违规而接受官方行动处理的比例明显下降[6]。
从2018财年GCP检查报告中被处以OAI的比例可以看出,FDA对申办方及CRO的检查结果中OAI比例高于对研究者的检查结果。生物等效性试验检查结果显示,OAI比例亦比较高。这些结果提示,将申办者及CRO 置于现场检查范围内非常有必要;同时,从对生物等效性试验检查的数量较多以及检查结果OAI比例较高可以看出,FDA对于生物等效性试验检查的重视,通过对开展评估检查持续改进临床试验质量的行政监管行为是积极的。
2 欧盟GCP检查报告结果
欧盟的药事法规管理机构是EMA,其下设专门机构负责GCP检查及相关工作的协调。对于EMA批准可以在欧盟成员国同步上市的新药,由EMA组织按照集中程序进行GCP检查;欧盟不同成员国批准授权单独在自己国家申请上市的新药,由本国药品监管部门进行GCP 检查。
EMA实施GCP检查的目标主要有:核实被检查方所开展的临床试验是否遵守欧盟法令要求,审核被检查对象是否按要求完成问题整改,以及核实被检查方提交试验资料中的信息(包括数据)是否可靠和准确[7-8]。
EMA的GCP检查类型分为常规检查和有因检查,GCP检查发现的缺陷按情形归为11个大类50个子类,结果判定分别为严重缺陷、主要缺陷和一般缺陷三个级别。
欧盟人用药品委员会(Committee for Medicinal Products for Human Use ,CHMP)于2018年发布了年度GCP检查报告[7]。根据报告,CHMP2017年共进行检查102次,其中在美国的检查最多(40.2%),其次是在欧盟/欧洲自由贸易联盟/欧洲经济区(39.2%)和中东/亚洲/太平洋地区(8.8%)(表2)。此外,由欧盟各国开展的GCP检查440次,其中在欧盟/欧盟经济区进行的检查376次,北美地区35次,世界其他地区29次。

表2 2017年欧盟GCP检查地区分布及检查种类
CHMP2017年度检查中,55.9%针对临床研究单位,其次是申办方(25.5%)、CRO(11.8%)、生物等效性试验机构(4.0%),其他是对分析实验室等进行的检查。
2017年进行的102次检查共记录缺陷979个,包括严重缺陷72个(7.4%)、主要缺陷514个(52.5%)、一般缺陷393个(40.1%)。
按照类别缺陷数量统计与占比情况看,申办方/CRO严重缺陷比例高于研究者及其他被检查方。整体分布情况见表3和表4。

表3 2017年欧盟GCP检查报告结果统计

表4 2017年欧盟GCP检查部分缺陷示例
比较欧盟2017年检查报告与以往检查报告可知,2017年常规检查占比有所提高;比较检查对象可见,生物等效性/生物利用度(bioavailability/bioequivalence,BE/BA)检查比例略有降低,而针对申办方/CRO的检查比例明显提升。这一检查对象占比的变化表明,EMA对以往检查中显示出的申办方/CRO检查重度缺陷比例较高(10%)给予了重视,希望通过检查敦促他们进行改进。从2017年检查结果看,申办方/CRO检查重度缺陷比例已明显降低(4.3%),但该比例仍然是所有被检查方中最高的,说明对于临床试验的质量管控而言,申办方/CRO的行为极为重要,因而也成为欧盟GCP检查关注的重点。
3 英国GCP检查报告结果
英国药品和保健品管理局(Medicines and Healthcare Products Regulatory Agency,MHRA)负责对在本国批准授权上市的新药临床试验GCP进行检查。2018年5月11日,MHRA签发了2016年4月1日—2017年3月31日统计周期的GCP检查报告[9]。
在该统计期内,MHRA的GCP检查团共进行了GCP检查99次。其中,对商业申办方开展检查16次,由于其中1次是对同一组织的重复访视以完成检查,因此报告总数为15次。在上述检查中,常规检查11次,有因检查5次;对CRO检查9次,其中回访1次,因此报告了检查8次,均为常规检查;对研究中心开展检查24次,其中常规检查21次,有因检查3次;对非商业组织开展检查8次,其中检查对象为大学3次,接受英国国家医疗服务体系(National Health Service,NHS)委托检查4次,以慈善机构为检查对象1次,均为常规检查;对I期临床试验单位开展检查12次,其中MHRA自愿I期认证计划的常规性检查8次,检查对象为申办方/CRO相关临床研究中心2次,有因检查2次;另外还有非英国生物等效性(bioequivalence,BE)和EMA检查15次,均为有因检查(表5)。

表5 英国GCP检查结果统计
各类被检查方存在的主要问题与其在临床试验中的角色定位有关,其中“质量体系”是5类被检查方均存在的主要问题,体现了MHRA对质量体系的重视,也反映出参与临床试验的各方均需要关切并纠正试验质量体系中存在的问题。
检查报告对各类问题列举了非常详细的说明,例如关于“药物警戒”问题,报告提到申办方提交的安全性参考信息(reference safety information,RSI)未经监管部门批准,却使用了未提交的、因此未经批准的同义词/首选术语/列表(synonym/preferred terms/list,SPTL),而SPTL具有所有较低级别术语,从而导致大量预期事件列表,在RSI和SPTL之间存在不一致(主要是SPTL中有许多其他首选术语);在研发安全性更新报告(development safety update report,DSUR)报告期开始时使用SPTL而非RSI进行预期性评估,导致提交给MHRA的报告可能出现错误(包括不正确/误导性数据);由于未使用MHRA批准的RSI,导致部分严重非预期不良反应(suspected unexpected serious adverse reactions,SUSARs)被遗漏,未向监管部门报告等。检查报告之严谨可见一斑。
MHRA在检查报告的最后部分讨论了法定GCP检查实施以来检查结果的变化趋势,时间跨度为2004—2017年度。结果显示,在开展法定GCP检查后,临床试验质量普遍改善,然而近年来商业申办者和CRO存在问题的比例又有所增加,该变化趋势值得警惕。
4 日本GCP检查报告结果
日本GCP检查由医药品和医疗器械管理局(Pharmaceuticals and Medical Devices Agency,PMDA)及其领导的合规性审查办公室和新药审查办公室等下属机构进行。根据需要分别进行现场检查(on-site inspection)和合规性书面调查(document-based conformity inspection)。当厚生劳动大臣认为临床试验可能对受试者健康带来严重损害时,可以要求PMDA进行针对性现场检查,并及时汇报结果。
检查结果分为符合GCP、有条件符合GCP、不符合GCP等3类,最后一类结果意味着发现常规性与系统性发生违反GCP事项,新药申请资料将不被接受。
检查内容为GCP规定的、由申办者和研究者承担的职责的履行情况,对申办者现场检查内容主要涉及试验药物的临床前研究信息与研究者的通报情况、对本项临床试验的研发组织架构及试验方案设计(实施)情况、临床试验的准备工作(例如试验药物的质量保证等)以及对整个临床试验过程的质量监管方案及实施情况。对研究者的现场检查主要关注研究团队的成员组成与管理体制、医疗机构负责人对临床试验的管理制度与落实、各类临床试验资料的记录情况、在多中心试验中研究者对其委托的各试验组的质量检查情况等。合规性书面调查同样覆盖研究者和申办者,特别值得注意的是,PMDA对申办者进行书面检查的内容还包括对试验药物质量的检查,例如试验药物的各种理化检验指标及稳定性试验结果、相关非临床试验部分的结果及指标也是书面检查的重要内容。
仿制药的临床试验一般以文件审查为主,现场检查比例并不高,但PMDA认为有必要时也会对仿制药一致性试验进行现场检查。
根据日本PMDA2017年GCP现场检查情况[10](表6),2017年日本本国GCP现场检查109次,其中企业申办的新药试验107次,医疗机构申办试验2次,共涉及申办方111家,医疗机构222家(医院135家,诊所87家)。此外还开展了对上年通知整改事项落实情况的检查。

表6 2017年日本GCP检查发现的常见问题[10]
检查中对医疗机构发出整改通知69件,其中属于系统性问题12件,个别问题57件。对因系统问题发出整改通知12件中,其中违反伦理审查5件,合作医疗机构未按规定签订协议5件,给药剂量错误1件,未得到医疗机构负责人批准参加助理研究工作1件。属于个别问题发出整改通知57件,其中试验方案偏差29件,主要问题有未遵守给药规定给予试验药物或合并使用的非试验药物、未按照试验方案进行相关检查、对受试者进行不必要的检查,及未按规定要求进行医疗监护等;知情同意问题15件,其中包括知情同意书修改后没有再履行受试者同意,对于可能影响受试者继续参加试验的信息给予说明时未作记录等;病例不符合规定5件,主要问题是与临床试验有关的评估项目原始文件和病例报告前后矛盾;受试者招募问题4件,主要是不符合标准的受试者入组;记录保存不合格4件,主要是病历保存不当及影像资料不能确认等。
对申办方现场检查107次,发出整改通知26件,其中不良反应信息的传达问题15件,主要是未在规定的时间将试验药物不良反应告知研究者;监控相关问题9件,包括原资料与病历不符5件、受试者招募2件、试验方案偏差2件;其他2件分别是业务流程与试验药物的问题。
5 讨论
总结2017—2018年美国、欧盟、英国和日本等发达国家(地区)已经公示的GCP检查报告,发现以下特点:一是均引入风险管理理念,各国虽然对临床试验各参与方的检查内容和程序不尽相同,但都体现了对风险防范和质量体系建设的关注与重视;二是优化检查程序,实行常规检查与有因检查相结合的方式,提高与改善监管资源的合理配置;三是定期发布检查结果,使临床试验各参与方能够及时掌握监管机构的关注重点,有助于同向发力共同提高临床试验质量。
对于在检查中发现的问题,尽管各国报告的描述方式及统计口径不尽相同,但是在检查中发现的问题(缺陷)有相似性,主要集中分布在以下方面:①未按照或未完全遵守研究方案进行试验;②研究方案设计不充分;③未严格执行受试者知情同意,其中包括知情同意书修改后没有再履行受试者同意;④试验药物使用或管理不当;⑤申办方/CRO没有及时告知监管机构和IRB重要信息或新的不良反应;⑥申办方/CRO未能实施有效的质量管理体系,现场监查活动不足,监查不遵循监控计划;⑦遵循和使用标准操作流程不到位,或未按要求更新流程;⑧研究人员资质缺陷,对研究人员培训不足等。
进入21世纪以来,全球临床试验领域发生了巨大变化,主要体现在试验方案的设计方法不断推陈出新,试验场点(单位)日益多样化(例如跨地区直至跨国的多中心试验增加、更多的基层医疗机构包括诊所加入试验等)[11]。传统的药物临床试验监管方式消耗大量监管资源,却难以满足提高试验质量的需求。如何有效利用有限资源最大程度保证药物临床试验的质量和受试者的安全权益,成为各国药品监管部门共同面临的挑战。学习借鉴发达国家(地区)的监管模式,梳理总结检查中发现的问题(缺陷),有助于更好理解与实施我国新版GCP,进一步提升我国临床试验质量。

