褪黑素与内源生物钟介导的哺乳动物季节性繁殖机理研究进展
赵淑琴,韩亚轩,鲁巨贵,杨 榛
(1.甘肃农业大学基础实验教学中心,甘肃兰州 730070;2.甘肃农业大学动物科学技术学院,甘肃兰州 730070;3.甘肃省兰州市红古区农业农村局,甘肃兰州 730070)
在以往的生产生活中,特定物种的繁殖季节按照长期规律来看都是恒定不变的,雄性动物精子最大活跃期和雌性动物的排卵期都是在每年相对固定的时间开始和结束的,这种年度节律是通过复杂的调控机制进行调控[1]。季节性繁殖除受下丘脑-垂体-性腺轴(Hypothalamic-Pituitary-Gonadal Axis,HPGA)的调控,还受内源生物钟调控。哺乳动物通过视网膜感知光周期的稳定变化,将信号传递给下丘脑,此时一条途径是位于下丘脑的视交叉上核(Suprachiasmatic Nucleus,SCN)对光信号作出整合,引起SCN 上生物钟基因的表达发生变化,然后SCN 将此信号传递给外周生物钟,引起繁殖相关的基因节律性表达,最终使动物生殖激素发生变化,调控动物的季节性繁殖;另一条途径则是光周期信号作用于松果体,导致松果体节律性分泌褪黑素(Melatonin,Mel),褪黑素又参与HPGA 的调控,使生殖激素的分泌发生节律性变化,最终共同调控动物的季节性繁殖[2]。本文通过综述褪黑素、褪黑素信号通路以及生物钟基因在季节性繁殖动物调控中的作用机制,以及褪黑素-褪黑素受体信号通路与生物钟基因之间的直接交互作用和间接交互作用,一方面有助于在分子水平上将信号通路与昼夜节律生物钟联系起来,另一方面可以为完善哺乳动物体内生物钟网络的调控机制,为研究季节性繁殖动物的调控机制提供基础。
1 褪黑素对季节性繁殖动物的作用机制
1.1 褪黑素通过HPGA 对生殖的调控 褪黑素是一种吲哚类激素,它是由哺乳动物和人体内的松果体分泌,化学名称为N-乙酰-5-甲氧基色胺(N-acetyl-5-methoxytrypto mine)[3]。褪黑素的合成和分泌受光的抑制,在夜间激活,呈现夜增昼低的趋势。褪黑素通过与膜相关的G 蛋白偶联受体结合发挥作用,在人类和哺乳动物中褪黑素受体有MT1 和MT2 受体[3-4]。
松果体是褪黑素合成的主要场所,是所有哺乳动物感应季节性变化的关键。褪黑素的合成途径是:当光信号通过刺激视网膜,将神经冲动传递给SCN,再通过肾上腺素能神经作用于松果体肾上腺素能受体,激活细胞内第二信使。其中,第二信使cAMP 和Ca2+诱导激活褪黑素合成的限速酶5-羟基-N-乙酰转移酶(AANAT),使5-羟色胺转变为N-乙酰-5-羟色胺,最后生成褪黑素[5](图1)。如果将松果体切除,会导致季节性繁殖行为不能随着季节变化而同步变化[6]。其调控机理是当切除松果体后,对光信号不能做出应答,导致褪黑素无法合成,就失去了褪黑素对 HPGA 和生殖的调控,最终使季节性繁殖行为不能随着季节变化而同步变化。

图1 光照信号通过视网膜-松果体途径对褪黑素的调控
褪黑素通过HPGA 对生殖的调控有直接和间接2种方式(图2)。直接调节是指褪黑素直接作用于性腺,调控生殖激素的分泌,影响动物繁殖[7]。研究发现,褪黑素可以改变睾丸生精细胞、黄体细胞和卵泡颗粒细胞的形态,保护正在黄体化的颗粒细胞免受卵泡中活性氧的影响,在排卵期间促进黄体生成以产生黄体酮[8-9]。有文献报道在马精液冷冻稀释液中加入1mmol/L 褪黑素可保护精子,提高冻精的受孕率[10]。在褪黑素的存在下,睾丸支持细胞可以显著增强睾丸间质细胞雄激素的合成,褪黑素可以调节间质和支持细胞的分泌功能[11]。间接方式是指褪黑素通过作用于HPGA,影响促性腺激素释放激素(GnRH)和促性腺激素(GTH)的分泌来调控动物生殖[12]。GTH 根据功能分为促黄体素(LH)和促卵泡激素(FSH),FSH 的主要功能是参与固醇类的合成及精子和卵子的产生,研究发现褪黑素作用于性腺轴使血浆中FSH、LH 水平降低,间接抑制了靶性腺激素的分泌[13]。LH 主要是影响排卵和排精,有文献报道褪黑激素显著降低了LH 和雌二醇(17β-estradiol,E2)的血浆水平,在排卵过程中部分抑制下丘脑-垂体-卵巢轴,并诱导卵巢、输卵管和子宫内雌激素受体、孕激素受体、雄激素受体的差异调节[14]。E2和睾酮(Testosterone,T)是生殖过程中最主要的类固醇激素,FSH 和LH 通过血液循环作用于性腺,与相应的受体结合后促进配子发生和类固醇激素合成[12]。有文献报道,当褪黑素分泌量浓度较高时,会形成视网膜-SCN-松果体的神经内分泌反馈调节系统,反过来抑制视交叉上核对松果体的刺激作用,直接影响生物钟机制[13]。
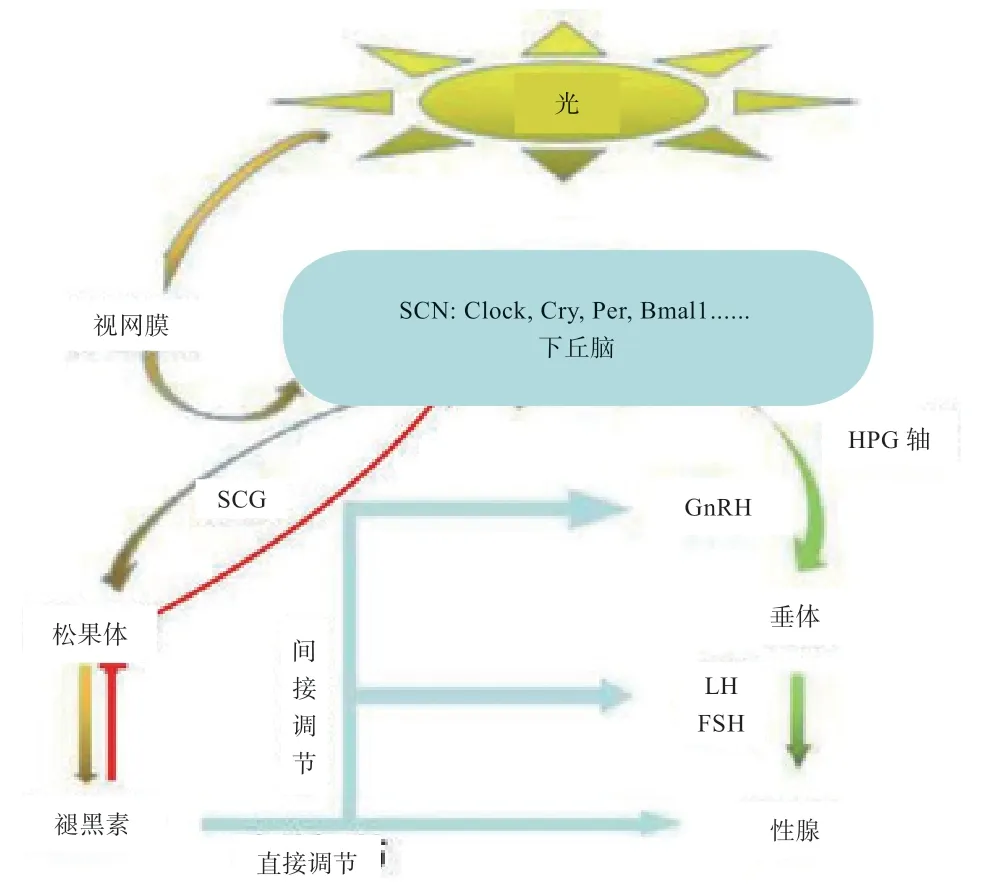
图2 褪黑素对HPG 轴的调节
除此以外,褪黑素、促甲状腺激素(TSH)参与SCN 与下丘脑垂体轴之间的联系。垂体结节部(PT)存在大量的褪黑素受体,是调控繁殖的首要作用点,褪黑素在此调节TSH 的分泌[15]。因此,当大脑深处的光感受器感知并将光信息传递到PT,产生TSH。这种PTTSH 通过诱导下丘脑脱碘酶的产生使甲状腺激素(T3)生物活性水平升高,而升高的T3 反过来抑制促性腺激素释放激素分泌,以此介导HPGA 的季节性变化[16]。
褪黑素作为调节繁殖季节的重要激素,这一点己经在对马、仓鼠等长日照动物和绵羊等短日照动物的研究中获得了证明。根据动物种类、年龄、性别等不同,褪黑素对生殖系统的影响会表现出促进、抑制、无作用等结果。如褪黑素对牛、鼠类、禽类等动物起抑制生殖的作用,对绵羊和鹿等起促进作用,对光不敏感动物则表现为无作用[7,17-18]。褪黑素的分泌与接受的光照成反比,在光照强度比较低的黄昏和拂晓时褪黑素的释放被完全抑制[19]。对于长日照动物而言,褪黑素分泌量增加导致GnRH 分泌减少,影响性腺功能;对于短日照动物,褪黑素信号会使得性腺功能活跃。补充外源性褪黑素使马的睾酮浓度降低、小鼠睾丸退化[12,20]。另一方面,外源性褪黑素可以促进公羊体内LH 和FSH 分泌,能够引起血清睾酮水平的较大日波动[21]。有文献报道给切除松果体的公羊埋植褪黑素来模拟长日照褪黑素信号,实验发现70 d 后公羊体内重建了LH 节律分泌模型。而短日照的褪黑素信号却不能诱导LH 季节性节律分泌模式,可以得出羊的LH 的分泌是由长日照褪黑素信号调节的[22]。因此光照的信息支配着长日照和短日照动物的分类,同样支配着褪黑素的节律性分泌,其相互之间也许是独立的[18]。
1.2 褪黑素作用于性腺类固醇激素对生殖的调控 早期报道褪黑素可抑制雌激素等性腺类固醇合成,这是褪黑素和雌激素信号通路之间相互干扰的第一个迹象。随后的研究表明褪黑素通过3 个关键机制影响雌激素的作用:①通过抑制性腺合成激素(包括雌激素)来降低其循环水平;②通过与ERα作为选择性雌激素受体调节剂(SERM)的相互作用来改变雌激素结合、DNA 结合和转录活性;③通过抑制从胆固醇或其他类固醇中合成雌激素的关键酶如芳香化酶、硫酸盐酶和醛酮还原酶(AKRs)的活性[17]。褪黑素对哺乳动物生殖生理的影响还不完全清楚,但褪黑素确实对卵巢颗粒细胞中的类固醇生成发挥了一些调节作用。研究证明褪黑素激活Gαi2 蛋白降低cAMP/PKA 水平,以及PKA 敏感部位ERα丝氨酸236(s236)的磷酸化,介导了褪黑素对ERα转录活性的抑制[23]。
Ahmad 等[24]在毛竹鼠睾丸内注射褪黑素,体外培养毛竹鼠睾丸间质细胞,发现细胞中类固醇激素的生成下降,睾酮水平降低,雄激素受体(AR)、雄激素结合蛋白(ABP)、3β-羟基固醇脱氢酶(3β-HSD)活性都有所降低。Valenti 等[25]报道了成年大鼠的睾丸间质细胞中存在褪黑素受体。Wu 等[26]研究小鼠睾丸间质肿瘤细胞时发现:单独用人绒毛膜促性腺激素/环磷酸腺苷(hCG/cAMP)类似物处理细胞,睾酮水平升高、类固醇急性调节蛋白(StAR)表达升高;用hCG/cAMP类似物处理细胞并加入褪黑素发现,褪黑素在3 h内抑制细胞中睾酮产生、StAR 表达降低,StAR 蛋白的表达和类固醇的产生因褪黑激素浓度从1 nmol/L 到10 nmol/L 而降低,说明褪黑素通过阻断StAR 蛋白表达、特异性结合位点抑制小鼠睾丸间质细胞类固醇生成。
2 生物钟
2.1 生物钟的组成 昼夜更替是地球自转而产生,生物体为适应这种环境,在生物体内产生的呈周期性、稳定可持续的内源性生物现象为昼夜节律。昼夜节律使得生物体的各项生理活动呈现一定的时间周期变化,包括激素的分泌、睡眠与觉醒、新陈代谢与细胞分裂、血压体温等的周期性变化[27]。在生物体内,月节律、年节律、周节律都属于节律系统。
生物钟作为昼夜节律振荡器的重要组成元件,几乎在所有组织中都存在。主时钟位于哺乳动物大脑区域的下丘脑视交叉上核(SCN),其他器官的生物钟被称为外周生物钟。中枢时钟系统由时钟基因Period(Per1/2/3)、Crytochrome(Cry1/2)、Clock、Bmal1、CKIε、Rev-Erbα等和其编码的蛋白,以及一些代谢相关基因组成。通过神经递质、内分泌和体液等的传导作用于外周时钟系统,和外周时钟系统共同组成生物钟[28]。哺乳动物内源性的昼夜节律与环境保持同步,主要依赖于中枢时钟系统与外周时钟系统相互协调作用,昼夜节律也协调哺乳动物的生命活动和生理状态的平衡有序。
生物节律形成的核心分子机制就是生物钟构成的转录-翻译反馈环路。时钟蛋白Clock 和Bmal1 形成异二聚体,它们识别并结合到E-box(CACGTG)上,E-box是下游钟控基因的启动子。于是靶基因的转录被激活,翻译出新的蛋白质,调控机体的节律。白天Bmal1-Clock 异二聚体作为反馈环中的核心调节因子,使细胞核内Per、Cry或其他基因的转录活性增加,导致细胞质中Cry 和Per 的蛋白水平的升高。夜间这些蛋白通过核孔进入细胞核,并形成Cry-Per 复合物,识别并结合到Bmal1-Clock 异二聚体上,抑制了Bmal1-Clock 异二聚体的功能,导致Per、Cry基因的转录活性关闭,随后Cry-Per 复合物被泛素化后降解。于是随着Cry-Per复合物被蛋白酶体降解,解除了对Bmal1-Clock 异二聚体的抑制,这样新一轮的转录又将开始[29]。如此就形成了一个转录-翻译负反馈环(图3)。
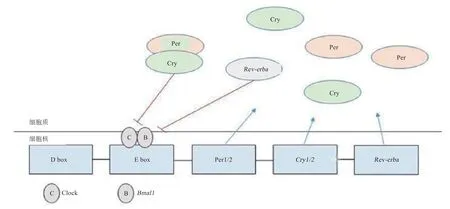
图3 主时钟转录-翻译反馈环的的调节模式[30]
与外周生物钟不同,SCN 主钟对于生物体生物钟节律至关重要,一旦SCN 主钟遭到损坏,整个生物个体生物钟节律可能直接丧失。Ralph[31]以松鼠猴为实验对象得出以下结论,当松鼠猴的SCN 被破坏后,它的节律性行为及内分泌消失,当重新移植SCN 后,松鼠猴的节律性行为又得以恢复。SCN 主钟的生物钟节律表现非常稳定,尤其是与外周生物钟相比较而言。
2.2 生物钟对季节性繁殖动物的作用机制 SCN 核团作为中央生物钟,是通过一种偶联同步化机制来确保有机体的各项机能维持稳定,血管活性肠肽(Vasoactive Intestinal Peptide,VIP)神经肽就是一个起到重要作用的神经递质。SCN 通过产生VIP 和精氨酸加压素(AVP)2 种神经肽,将生物钟信号传至卵巢、睾丸等外周组织。VIP 也可直接刺激下丘脑的GnRH 神经元活动,影响GnRH 的分泌,并且能间接作用于RF 酰胺相关肽(抑制GTH 的释放)神经元活动,抑制其对GnRH 神经元的作用,从而参与HPGA 的调控[32]。Hughes 等[33]研究发现,将小鼠VIP基因或是VIP 受体基因(Vasoactive Intestinal Peptide Receptor 2,VIPR2)敲除后,小鼠的日常行为及生理水平的生物钟节律都受到了很大的破坏和影响,尽管基因敲除小鼠的生物钟负反馈环路在细胞水平上的是完整的,同时其生物钟在细胞水平上的运行也是正常的,但是对于小鼠机体生物钟的破坏是存在的。
受节律生物钟的调控,雌激素、睾酮、褪黑素、糖皮质激素等的分泌通常呈现一种周期性规律。在卵巢癌、乳腺癌、前列腺癌等生殖系统恶性肿瘤中发现,性激素分泌的昼夜节律发生变化,昼夜节律紊乱导致乳腺癌发病率增高[19]。很多研究数据显示,生物钟与雌二醇-雌二醇受体(E2-ERa)信号通路间存在关联,并且E2-ERa 信号通路参与了生物钟基因的转录过程[34]。Rossetti 等[35]研究发现,E2 使生物钟基因Bmal1表达上调,其相互作用在乳腺导管的发育过程中产生重要作用,在人乳腺细胞系中敲低ERa,并加入E2 发现,Per2和Bmal1的转录下调,雌二醇受体以雌二醇依赖的方式调控Per2-Bmal1 时钟机制。在E2-ERa 信号通路的下游存在生物钟基因Per2,Per2的启动子上存在雌激素反应元件(ERE),ERa 结合在ERE 上促使Per2的转录,使细胞质内Per2 蛋白含量升高;升高的Per2 蛋白反过来抑制ERa 与ERE 结合,使乳腺肿瘤细胞增殖受到抑制,研究发现,具有家族原发性乳腺癌患者的乳腺组织,生物钟基因Per1和Per2的表达显著低于正常人群的乳腺组织[36]。另有文献报道,体外培养大鼠的子宫上皮细胞加入E2 后Per1基因高表达[37]。这进一步表明了E2 与生物钟存在关联。
3 褪黑素信号通路与生物钟交互作用
3.1 褪黑素与生物钟基因在中枢途径中的交互作用 褪黑素对于大多数生物体来说,其最主要的功能就是为生物体提供时间信息。松果体和视网膜产生的褪黑素昼夜变化规律从鱼类到哺乳动物都是非常恒定的,褪黑素波峰都出现在夜晚。褪黑素合成酶(AANAT)是褪黑素合成的限速酶,该酶活性和褪黑素的水平具有同步性。生物钟可以调节AANAT 活性,AANAT 活性在也受到光照条件的抑制[38]。研究发现,Bmal1-Clock 异二聚体能够作用于AANAT基因启动子的E-box 元件上,增强了AANAT基因的转录,促进了褪黑素的合成,这样使得AANAT的表达和褪黑素的浓度也表现为昼夜节律性,即夜间表达较高;而在白天,由于Bmal1-Clock 异二聚体受到Cry 蛋白的抑制,AANAT基因的转录也受到抑制,使AANAT表达较低,褪黑素的合成也随之减少,在白天出现表达较低的现象[39]。
Yamanaka 等[40]研究发现,给与小鼠5d 的全黑暗条件,垂体细胞中Clock基因表达升高,Per1/2及Bmal1基因表达降低;用褪黑素注射处理后,Clock基因表达水平降低,Per1/2的表达水平升高,Bmal1没变化,推测褪黑素、褪黑素合成酶及生物钟基因之间存在反馈作用环路。还有实验表明,生物钟Cry基因是感光基因,且是AANAT 转录的阻遏物,在Cry1和Cry2双缺陷小鼠(Cry1-/-/ Cry2-/-)中褪黑素含量很低,将Cry1-/-/ Cry2-/-小鼠持续一段黑暗时间的处理后,其生物钟节律丢失,AANAT和时钟基因Per1的表达水平很高[41]。还有研究表明,较长光照时间的刺激,能够引发Per2基因的高表达,而Per2基因的高表达会抑制AANAT表达,因而推测Per2基因的表达与褪黑素的合成具有相反的模式[42]。当敲除小鼠松果体细胞中的褪黑素受体MT1时,小鼠垂体细胞中Per1、Cry1、Clock和Bmal1基因的表达显著降低,说明生物钟基因节律性表达与褪黑素受体的存在有着密切关系[43]。
本实验室团队在前期以季节性繁殖动物双峰驼卵巢颗粒细胞为模型,研究其生殖调控过程中发现,通过免疫定位实验显示MT1 和MT2 受体蛋白主要存在于细胞膜和细胞质中,Cry1 和Cry2 蛋白主要存在于细胞核和细胞质中;当过表达基因MT1/2后,Cry1/2基因的表达显著增加,可通过cAMP/PKA/CREB 通路解释清楚;但是当过表达Cry1/2后,MT1/2基因的表达也显著增加,推测Cry基因对MT1/2的调控发生在转录水平,暗示MT1/2的启动子中含有Cry基因的结合元件[44]。
3.2 褪黑素与生物钟基因在外周途径中的交互作用 褪黑素作为中枢生物钟的输出和外周振荡器的输入,在调节中起着重要作用。关于褪黑素的生物作用已经被报道过很多,但最好的描述是它作为一种神经激素和光/暗周期的牵引剂,以及SCN 外周时钟的同步器的生物钟作用[9]。夜间血液中褪黑素水平升高,会通知身体细胞和器官现在是夜间,并帮助组织目标器官和器官系统进入适当的体内平衡代谢节奏,白昼长度或光照时间/相位的改变都会使SCN 活动及伴随的松果体产生褪黑素的活动不同步[18]。
LH 作为调控生殖的重要激素,在哺乳动物的排卵、性激素的分泌过程中发挥重要作用。有文献报道,褪黑素对LH 有直接调节作用,其关键作用是影响前列腺素合成酶(又称环氧合酶,Cyclooxygenase2,COX2),COX2 也是影响排卵的重要因素,COX2启动子中存在E-box 序列,Bmal1-Clock 异二聚体可与E-box 序列结合调控COX2的表达,当敲除卵巢颗粒细胞中的Bmal1基因,COX2表达和前列腺素合成显著降低[45]。这表明前列腺素使卵泡破裂的调控机制依赖于卵巢上的生物钟的调控。
Ding 等[46]研究还发现,褪黑素可以间接影响睾酮水平,睾丸内睾酮的合成需要一系列睾丸合成酶(P450scc、P450c17、3β-HSD、17β-HSD) 的作用形成,睾丸内存在Bmal1基因,该基因可诱导睾丸合成酶合成。Chung 等[47]研究发现,类固醇急性调节基因(StAR)的转录可以直接被Bmal1基因激活;当敲除小鼠Bmal1基因时,StAR基因表达显著降低,睾酮水平也随之降低,可以看出,Bmal1基因在调控哺乳动物分泌睾酮时起到关键作用。另外,当切除小鼠的松果体后,睾酮和Bmal1、StAR、Rev-erbα的表达均发生显著变化,当注射褪黑素后各项参数得到恢复[48]。因此可以得出,褪黑素可通过调控钟基因Bmal1的表达来影响睾酮生成。在叙利亚仓鼠中,给与正常的光照节律,其Bmal1基因的表达无明显节律,而Per1基因存在节律性,其在夜间的表达水平最高;将仓鼠长时间置于黑暗环境时,其褪黑素分泌的节律性消失,仓鼠性腺衰退,而此时Bmal1基因的表达则表现出明显的节律性,Per1基因的节律性消失[49],说明褪黑素和生物钟基因都受光暗条件的限制,相互依存、相互影响。
AANAT、HIOMT、MT1、MT2基因是褪黑素合成和发挥作用的关键。文献报道,在大鼠的卵丘-卵母细胞复合体(COC)中存在上述基因,同时,还存在Clock、Bmal1、Cry1/2、Per1/2等生物钟基因,在排卵后输卵管壶腹部获得的成熟COC 上的Bmal1基因表达水平较高,其他基因在卵巢组织中分离的未成熟COC上的表达水平较高;切除松果体后,COC 中AANAT、HIOMT、MT1、MT2等基因的表达水平发生变化;注射褪黑素后,上述基因的表达恢复生物钟节律[50]。上述实验结果表明,褪黑素通过影响COC 进而影响生物钟基因的表达,对卵巢功能具有调控作用。
Steven 等[19]研究表明,MT1 蛋白和MT2 蛋白形成的异二聚体抑制cAMP 的积累,与cAMP 相关的信号通路受到调控,使生物钟基因表达发生改变。本实验室前期研究发现,Cry 蛋白主要存在于卵巢颗粒细胞的细胞核中,卵巢颗粒细胞上存在褪黑素受体基因(MT1、MT2)和节律基因(Clock、Cry1、Cry2、Per1、Per2、Per3)的表达;过表达MT1/2基因后,cAMP 产生受到抑制,除Cry1/2表达极显著升高外,其他基因(GNB2、PKA、CREB、Per1/2/3、Clock)均极显著降低[44]。过表达Cry1/2后,cAMP 的产生受到抑制,除MT1/2的表达极显著升高外,其他基因均显著降低[44]。MT与Cry通过cAMP/ PKA/ CREB 通路构成一个环路(图4)。此结果解释为,当过表达MT1/2基因,cAMP 产生受到抑制,使有活性的PKA 生成降低,进一步影响CREB 的磷酸化,使得Per的转录受到抑制,负反馈调节因子Cry 激活,其表达含量升高。该结果与核心节律的生物钟调控机制完全一致。为进一步验证基因的相关性,当过表达基因Cry后检测相关信号通路基因的变化,结果显示与过表达MT的结果完全一致。有2 种分析途径,一是过表达的Cry抑制了cAMP,进而影响cAMP/PKA/ CREB 信号通路,使结果与过表达MT完全一致,二是暗示了MT和Cry之间存在的联系发生在转录水平。
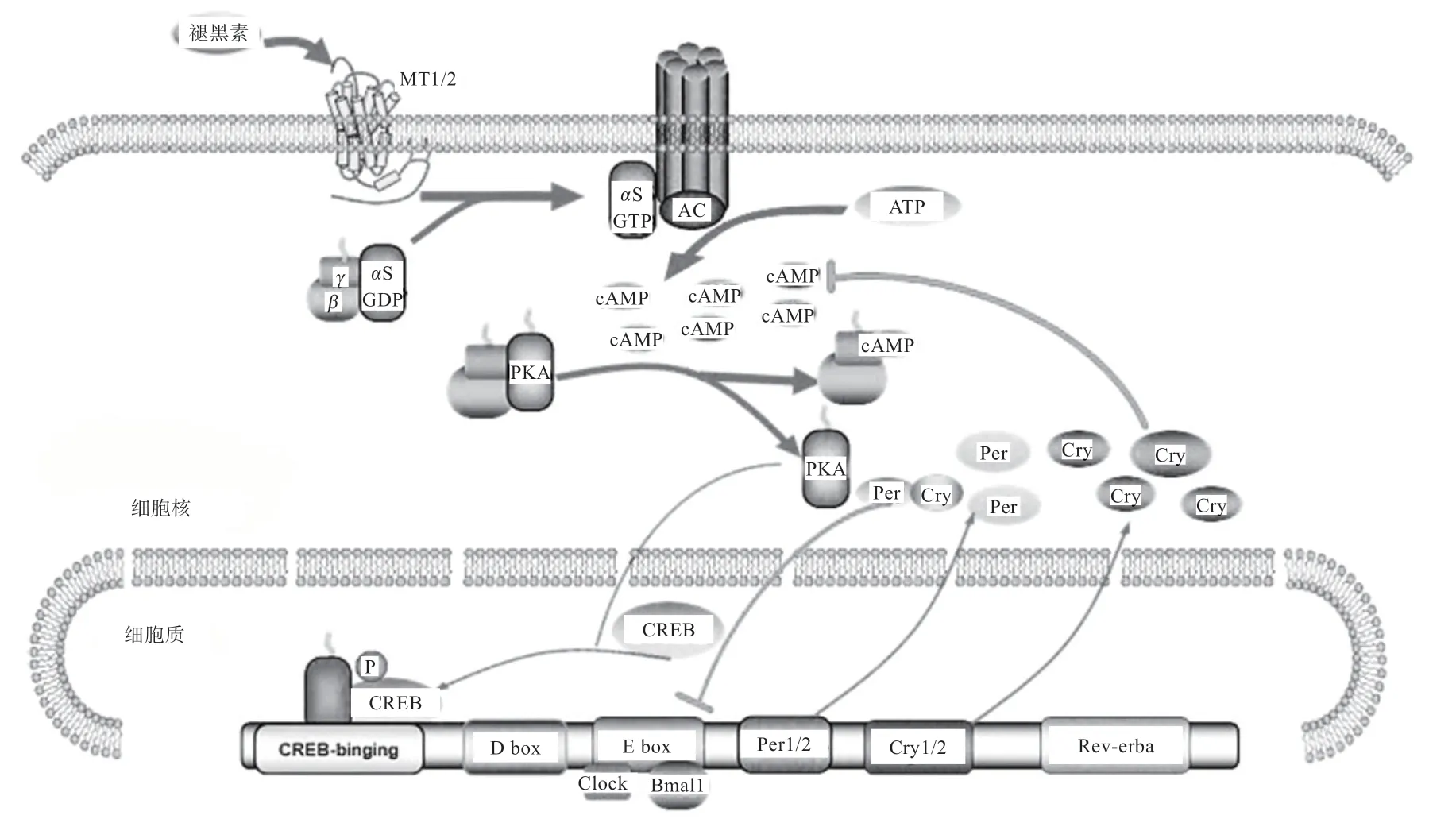
图4 cAMP/PKA/CREB 信号通路介导的褪黑素对生物钟基因的作用机制[44]
4 总结与展望
生物钟基因受光照控制,其分子机制根据转录-翻译负反馈环路进行振荡,控制生物体的各项节律性生理活动和行为。本文总结了有节律的褪黑素合成不但通过HPGA 通路调控哺乳动物的季节性繁殖,还通过下丘脑甲状腺激素-GnRH 调控动物的繁殖。位于SCN 的主生物钟通过感光基因表达的变化引起生物钟基因的节律性振荡,之后将这种振荡传递给外周生物钟,使性激素合成相关基因的表达发生变化,进而调控生殖。本文分别从生物钟基因对生殖的调控,及褪黑素介导的生物钟基因对生殖的调控,从中枢途径和外周途径两方面入手阐述其相互作用关系,为完善褪黑素、生物钟作用的季节性繁殖规律提供更具体的思路,是控制动物季节性繁殖行为的重要内容。
动物利用光周期的变化来适应即将到来的繁殖季节,这对于深入理解动物季节性繁殖的机制有帮助。虽然人类不是季节性的,但人类有很多生物节律,如睡眠-觉醒节律、青春期发育等。生物节律的紊乱导致体内激素水平异常,与乳腺癌、甲状腺疾病有很大的联系,因此了解动物季节性繁殖的分子机制有助于更好地理解人类的生物节律。尽管人们已经非常了解褪黑素的合成途径,但是,褪黑素驱动节律本身的机制,以及与生物钟分子机制中存在的千丝万缕关系还是未知的,褪黑素受体基因启动子中是否含有诱使或者结合生物钟基因转录的核心位点还需要进一步验证,这也是本实验室的下一步计划。

