口腔专业临床试验机构备案现状的分析
为扩大临床试验资源,解决试验机构不足,落实“放管服”改革要求,医疗器械临床试验机构、药物临床试验机构分别从2018年、2019年开始施行“备案制”[1,2]。自此,结束了药物临床试验机构的“认证制”历史,同时首次明确要求医疗器械临床试验机构与药物临床试验机构分别独立管理。
医疗器械临床试验机构备案制的实施,给口腔医学专业带来了的全新的发展机遇。经过3年的实行,越来越多的口腔专科医院、综合医院口腔科进行了医疗器械和药物临床试验专业备案。但目前,尚未有口腔专业临床试验机构备案情况的研究报道,本文通过比较“认证制”和“备案制”口腔专业临床试验机构的基本情况,分析备案制前后的变化特点,进而提出未来的改进方向。
1 资料和方法
数据库选择: 国家药品监督管理局网站“药物临床试验机构名单”;药物和医疗器械临床试验机构备案管理信息系统平台(简称“备案系统”)。时间自2004年1月1日至2022年5月23日。
对全国经认证、备案的口腔专业药物临床试验机构和医疗器械临床试验机构的数量、地域分布、医院等级、备案主要研究者情况等进行分析。
2 临床试验机构备案现状
2.1 机构数量
自2004年至2019年期间,经认证并获口腔专业药物临床试验资质的医院全国共65家,其中口腔专科医院10家,占15.38%;认证时间最早2005年,最晚2019年。实行备案制后,截至2022年5月23日,备案口腔专业的药物临床试验机构共83家医院,其中口腔专科医院13家,占15.66%。备案口腔专业的医疗器械临床试验机构共351家医院,其中口腔专科医院25家,占7.12%。备案的药物临床试验机构中80家是原认证机构,器械临床试验机构中278家医院是原认证机构。
2.2 区域分布
原认证的65家口腔药物临床试验机构分布在全国20个省份,其中以北京(12家)、江苏(9家)、湖北(6家)三地最多。现备案的83家口腔药物临床试验机构分布在23个省份,与认证前类似,也是北京(12家)、江苏(9家)、湖北(7家)最多。351家备案口腔专业的医疗器械临床试验机构分布在29个省份,其中以广东(35家)、北京(29家)、江苏(28家)最多,详见图1 ~ 3。

图1 经认证具有口腔专业的药物临床试验机构分布
2.3 医院等级
原认证的65家机构所在医院均为三级甲等医院,现备案的83家口腔药物临床试验机构除1家为三级医院(未定等级)外,其余均是三级甲等医院,351家口腔医疗器械临床试验机构中则有三级乙等、二级甲等医院,具体分布如表1所示。

图2 备案有口腔专业的药物临床试验机构分布

图3 备案有口腔专业的医疗器械临床试验机构分布
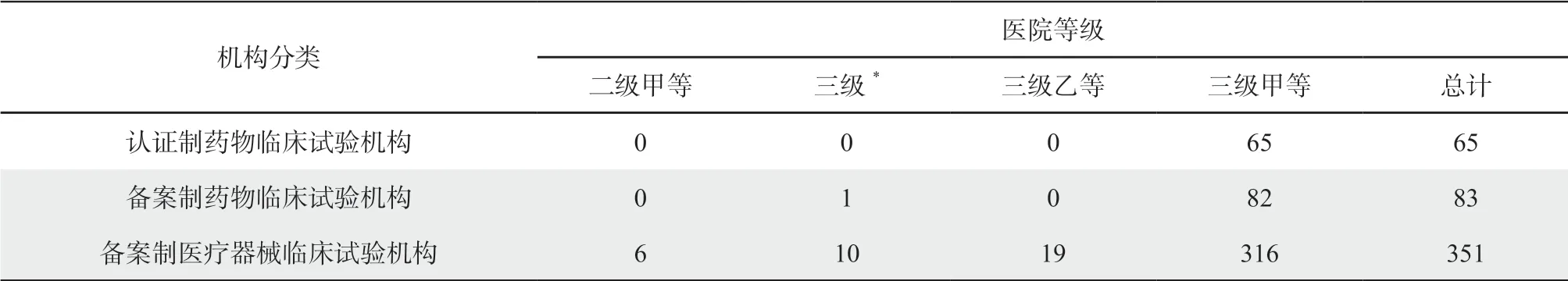
表1 口腔专业临床试验机构医院等级分布(家)
2.4 备案的二级亚专业
原认证的药物临床试验机构中,仅7家医院认证专业细化到口腔二级亚专业,其余均为口腔一级专业。而备案要求细化到二级专业,经统计:口腔药物、医疗器械临床试验二级专业备案情况如图4、图5所示,药物临床试验备案的亚专业前三的是口腔其他43家、口腔颌面外科31家、口腔黏膜病27家;备案医疗器械临床试验亚专业前三的分别是口腔颌面外科204家、牙体牙髓病183家、口腔修复174家。其中“口腔其他”专业是指通过综合口腔进行备案,未进行二级亚专业细分。

图4 口腔药物临床试验备案二级专业

图5 口腔医疗器械临床试验备案二级专业
2.5 主要研究者的备案
既往实行“认证制”时,仅认证专业,并未对主要研究者进行认证。而在目前“备案制”下,对专业进行备案时,要求同时录入符合条件的主要研究者进行备案。统计口腔药物与医疗器械临床试验备案的主要研究者数量(见表2),其中药物临床试验共备案298人,正高级职称204人,副高级职称94人;医疗器械共备案1775人,正高级职称865人,副高级职称733人。

表2 口腔专业临床试验备案研究者职称分布(人)
从各二级专业看,药物临床试验备案主要研究者最多的专业是口腔其他(102人)、口腔颌面外科(91人)和口腔黏膜病(44人);医疗器械临床试验备案主要研究者最多的专业是口腔颌面外科(461人)、牙体牙髓病(344人)和口腔修复(336人)。各专业统计如图6、图7所示。

图6 口腔药物临床试验中各亚专业备案人数
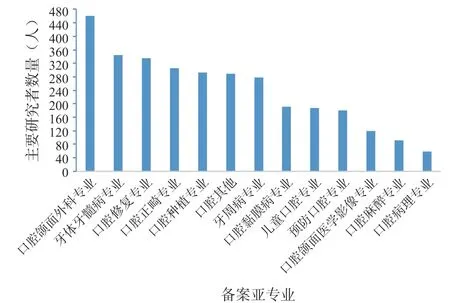
图7 口腔医疗器械临床试验中各专业备案人数
3 不足与改进措施
从数量上看,备案制实施后无论是药物临床试验机构还是医疗器械临床试验机构,均呈显著上升趋势,尤其是医疗器械临床试验机构增长近5倍,表明备案制的实施确实有利于医疗资源的释放,同时药物、医疗器械机构数量上的差异也符合口腔专业“大器械、小药物”的特点。
3.1 存在的不足
全国83家备案的药物临床试验机构中,有80家为原认证的机构,故药物临床试验机构在区域分布上,数量前三的省份在备案制实施前后保持一致。口腔医疗器械临床试验机构备案数量以广东、北京、江苏最多,这与各省份口腔医疗器械的注册情况基本保持一致。查询国家药监局医疗器械注册情况,2018 ~ 2020年口腔第二类医疗器械首次注册数量排名前三的省份是广东、河南、上海,口腔第三类医疗器械注册数量排名前三的省份为江苏、山东、北京。但是无论是认证制还是备案制,各省份间机构数量差异较大,区域分布不均衡,更多集中在经济较发达的城市[3],尚有部分省份无口腔专业临床试验机构备案。
从医院等级分布可见,三甲医院仍然是临床试验实施和执行的主战场,备案的药物临床试验机构数量是1196家,含有口腔专业的机构仅占6.9%;医疗器械临床试验机构备案有1139家,含有口腔专业的占比为30.8%;与心血管内科、肿瘤等占比50%以上的专业相比,口腔专业仍显得热度不足。查询还发现,除头颈肿瘤临床试验62项外,口腔相关临床试验仅32项,占所有临床试验项目数量的2.2%,反映出企业对于口腔用相关药物研发积极性的不足。在口腔类医疗器械的注册数量上,从2017年起连续5年位于进口注册数量前5位,但均未进入境内注册数量前5位[4];对口腔用材料、器械的研发热情及成果数量,国外企业明显高于国内企业。
在备案研究者的数量上,医疗器械领域远高于药物,除口腔专业的特色之外,还基于相关法律法规要求的标准不同:药物临床试验的主要研究者需具有3个以上药物临床试验的经验[2,5],因此大部分备案机构是原来经认证的。且10%的医疗器械研究者不符合备案要求,由于备案均要求主要研究者为高级职称,大部分备案有初级、中级职称研究者的机构为新机构,可能对临床试验管理政策的理解还不够透彻。
备案制的实施,引导更多的医疗机构参与到临床试验中来;但从口腔专业备案的医院比例看,愿意开展口腔临床试验的医疗机构占比有待提高,尤其是药物临床试验。口腔专业作为一级学科,临床覆盖面广,患者人群基数大,涉及的药品、医疗器械、耗材种类多,如药品包括局麻药品、黏膜用药、牙周用药、头颈肿瘤用药等,医疗器械、材料包括种植体、矫治器、填充树脂、骨粉骨膜等;但是目前国内对口腔药品、医疗器械的研发投入与病患基数、临床需求等并不成正比。
3.2 改进措施
与热门的临床专业相比,口腔专业尚需形成特有的专属竞争力;临床试验作为产品研发的末端环节,口腔专业可通过提升试验环节的质量与效率,或相关政策和激励机制引导,以提高临床研究的积极性,不断创造正效应,吸引更多的企业投入口腔产品的研发。建议未来可依托中华口腔医学会率先形成专业内临床试验联盟,通过联盟指导临床试验机构备案,增进临床试验规范化培训与管理,统一口腔类临床试验的申请要求,规范试验流程,提高试验进度,增进伦理互认,减少企业重复工作量等等,进而加快口腔类新药、新器械、新材料等产品的上市。

