基于UPLC指纹图谱和多指标成分定量的不同产地白茅根标准汤剂质量评价研究
李振雨,周湘媛,马懿飞,何民友, 刘晓霞,陈向东,孙冬梅,3,4,罗文汇,3,4
1广东一方制药有限公司;2广东省中药配方颗粒企业重点实验室,佛山 528244; 3江西一方天江药业有限公司,南昌 330000;4湖南一方天江药业有限公司,常德 415000
中药标准汤剂是以中药饮片为原料,参考传统中药汤剂煎煮习惯,以水为溶剂,采用标准化的煎药模式制备得到的单味中药饮片水煎液。中药标准汤剂作为一种标准物质或标准体系,常用于标化中药临床用药,规范中药配方颗粒等新型中药饮片在临床上的使用,从而保障中药临床用药的准确性[1]。因此,通过建立中药标准汤剂的质量标准,能够为相应的中药配方颗粒及经典名方等现代中药制剂质量标准的建立提供重要参考。
白茅根为禾本科植物白茅ImperatacylindricaBeauv.var.major(Nees) C.E.Hubb.的干燥根茎,具有凉血止血,清热利尿的作用[2]。现代研究表明,白茅根含有三萜、黄酮、有机酸、苯丙素、内酯、甾醇等多种化学成分[3],具有止血、利尿、镇痛、抑菌、抗炎、抗氧化、降血压、保肝、调节机体免疫等多种药理活性[4,5]。2020年版《中国药典》白茅根药材项下质量标准缺乏含量指标,现行的质量标准难以较全面反映白茅根的内在质量。已有的研究报道,多采用指纹/特征图谱结合绿原酸含量测定对白茅根进行质量控制[6-8],尚未见到指纹图谱结合多指标成分的定量研究。研究表明,中药中的酚酸类成分具有抗炎、抑菌、抗氧化、抗肿瘤等作用,是极具研究价值和应用潜力的天然活性产物[9]。白茅根中含有较多的酚酸类成分[10],其抗炎、抑菌、抗氧化等药理活性与白茅根功能主治密切相关[11],因此,本次研究通过建立白茅根标准汤剂UPLC指纹图谱并首次实现对标准汤剂中绿原酸、新绿原酸、隐绿原酸和对羟基肉桂酸含量的同时测定,结合化学计量学分析方法,为不同产区的白茅根标准汤剂质量评价提供依据。
1 仪器、试剂与试药
1.1 仪器
Waters高效液相色谱仪(H-Class,沃特世公司);Waters CORTECS T3 C18(2.1 mm×150 mm,1.6 μm)色谱柱;百分之一电子分析天平(JJ600,常熟市双杰测试仪器厂);万分之一电子分析天平(ME204E,梅特勒-托利多公司);百万分之一电子分析天平(XP26,梅特勒-托利多公司);数控超声波清洗器(KQ500DE,昆山市超声仪器有限公司);超纯水系统(Milli-Q Direct默克股份有限公司)。
1.2 试剂与试药
试剂:乙醇(广东光华科技股份有限公司,分析纯);甲醇(广东光华科技股份有限公司,分析纯);磷酸(天津市科密欧化学试剂有限公司,色谱纯);甲醇(默克股份有限公司,色谱纯);水为超纯水。
试药:绿原酸(中国食品药品检定研究院,批号:110753-201716,含量:99.3%);新绿原酸(四川省维克奇生物科技有限公司,批号:wkq21083002,含量:96.7%);隐绿原酸(成都乐天美医药科技有限公司,批号:DST210427-035,含量:99.1%);对羟基肉桂酸(成都普菲德生物技术有限公司,批号:21001401,含量:99.8%)。
1.3 样品
实验所用18批白茅根药材由广东一方制药有限公司采购管理部于产地购买和收集,产地信息见表1所示,经广东一方制药有限公司孙冬梅主任中药师鉴定为禾本科植物白茅ImperatacylindricaBeauv.var.major(Nees) C.E.Hubb.的干燥根茎,并经广东一方制药有限公司质量中心检定合格,均符合2020年版《中国药典》(一部)白茅根药材项下的各项规定,并按照2020年版《中国药典》(一部)白茅根饮片项下炮制规定制成白茅根饮片,具体炮制方法为:取白茅根药材,挑去非药用部位、杂质,洗净,稍润,切10~15 mm的段,干燥,筛去碎屑。
2 方法与结果
2.1 白茅根标准汤剂的制备
根据《中药配方颗粒质量控制与标准制定技术要求》和《医疗机构中药煎药室管理规范》,确定白茅根标准汤剂的制备工艺为:取白茅根饮片100 g,加水煎煮两次,第一次加9倍量水,浸泡30 min,煎煮30 min,趁热过滤,滤液迅速冷却;第二次加7倍量水,煎煮25min,趁热过滤,滤液迅速冷却,合并两次滤液,减压浓缩至100 mL的浓缩液,冷冻干燥,得白茅根标准汤剂冻干粉。
2.2 指纹图谱的建立
2.2.1 色谱条件
选择Waters CORTECS T3 C18(2.1 mm×150 mm,1.6 μm)色谱柱;以甲醇为流动相A,以0.1%磷酸溶液为流动相B;梯度洗脱(0~4 min,4%A;4~12 min,4%→7%A;12~15 min,7%→13%A;15~25 min,13%→16%A;25~27 min,16%→20%A;27~35 min,20%A);流速为0.30 mL/min;柱温为40 ℃;检测波长为325 nm;进样量为2 μL。
2.2.2 对照品溶液的制备
取绿原酸、新绿原酸、隐绿原酸和对羟基肉桂酸对照品适量,精密称定,加50%甲醇制成每1 mL含绿原酸9.27 μg、新绿原酸4.06 μg、隐绿原酸4.12 μg、对羟基肉桂酸5.10 μg的混合溶液,即得。
2.2.3 供试品溶液的制备
取白茅根标准汤剂冻干粉适量,研细,取约0.1 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇15 mL,称定重量,超声处理(功率300 W,频率40 kHz)30 min,放冷,再称定重量,用50%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
2.2.4 方法学验证
2.2.4.1 精密度考察
取白茅根标准汤剂冻干粉(编号:S1)适量,研细,取约0.1 g,精密称定,按“2.2.3”项下方法制备供试品溶液,精密吸取上述供试品溶液,按“2.2.1”项下色谱条件重复进样6次,以绿原酸色谱峰为参照峰S,计算各共有指纹峰与S峰的相对保留时间RSD值在0.05%~0.13%范围内,相对峰面积RSD值在0.32%~2.61%范围内,均小于3.0%,表明仪器精密度良好。
2.2.4.2 重复性考察
取同一批白茅根标准汤剂冻干粉(编号:S1)适量,研细,取约0.1g,精密称定,平行6份,按“2.2.3”项下方法制备6份供试品溶液,按“2.2.1”项下色谱条件进样分析,以绿原酸色谱峰为参照峰S,计算各共有指纹峰与S峰的相对保留时间RSD值在0.03%~0.17%范围内,相对峰面积RSD值在0.36%~2.76%范围内,均小于3.0%,说明该方法重复性良好。
2.2.4.3 稳定性考察
取白茅根标准汤剂冻干粉(编号:S1)适量,研细,取约0.1 g,精密称定,按“2.2.3”项下方法制备供试品溶液,按“2.2.1”项下色谱条件,分别在0、3、6、9、12、18、24 h进样分析,以绿原酸色谱峰为参照峰S,计算各共有指纹峰与S峰的相对保留时间RSD值在0.03%~0.21%范围内,相对峰面积RSD值在0.37%~2.34%范围内,表明供试品溶液在24h内稳定性良好。
2.2.5 指纹图谱的建立及共有峰的标定
分别取18批白茅根标准汤剂冻干粉适量,研细取约0.1 g,精密称定,按“2.2.3”项下方法制备18份供试品溶液,分别按“2.2.1”项下色谱条件进样测定,记录各批次白茅根标准汤剂样品指纹图谱,并导出指纹图谱CDF格式,将18批白茅根标准汤剂样品指纹图谱CDF格式导入《中药色谱指纹图谱相似度评价系统(2012版)》软件中,以编号为S1的样品指纹图谱为参照图谱,进行保留时间校正和全峰匹配,18批白茅根标准汤剂指纹图谱共标识出9个共有指纹峰(见图1),以中位数法生成白茅根标准汤剂对照指纹图谱(见图2)。

图1 18批白茅根标准汤剂指纹图谱叠加图Fig.1 Superimposed fingerprints of 18 batches of Imperatae Rhizoma standard decoction
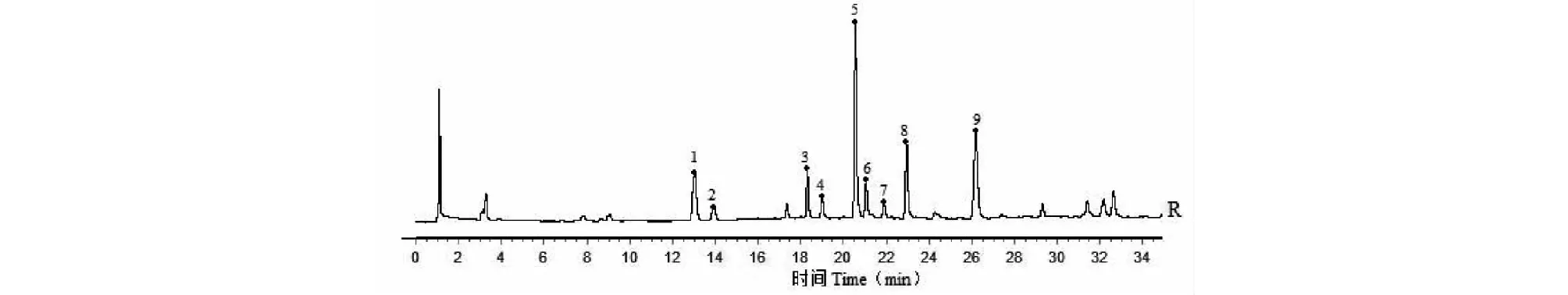
图2 白茅根标准汤剂指纹图谱共有模式Fig.2 Common pattern of the fingerprint of Imperatae Rhizoma standard decoction
2.2.6 相似度计算
采用《中药色谱指纹图谱相似度评价系统(2012.130723版本)》软件计算18批白茅根标准汤剂样品指纹图谱与白茅根标准汤剂对照指纹图谱的相似度值,结果见表2所示。结果显示,18批白茅根标准汤剂指纹图谱与对照指纹图谱的相似度在0.920~0.997,其中河北产区的6批相似度值在0.972~0.986,安徽产区的4批相似度值在0.991~0.997,江苏产区的5批相似度值在0.954~0.992,河南3批相似度值在0.920~0.945。从相似度计算结果可知,河北、安徽和河南的样品存在一定的差异,而江苏产区的样品不同批次间指纹峰的峰面积比例波动较大,与河北和安徽的样品并不能明显地区分和鉴别。这种差异可能与不同产地的白茅根药材的生长环境、产地加工和采收时间的不同有关,此外,白茅根中含量较高的酚酸类成分,遇热不稳定,药材的储藏方式、放置时间均可能对药材的质量造成一定的影响。

表2 相似度评价结果Table 2 Evaluation results of the similarity
2.2.7 共有峰的指认
取白茅根标准汤剂冻干粉(编号:S1)适量,研细,取约0.1 g,精密称定,按“2.2.3”项下方法制备供试品溶液,取“2.2.2”项下混合对照品溶液和白茅根标准汤剂供试品溶液,按 “2.2.1”项下色谱条件进样分析,结果如图3所示。经与对照品保留时间和紫外-可见光3D光谱比对分析,确定峰1为新绿原酸,峰5为绿原酸,峰8为隐绿原酸,峰9为对羟基肉桂酸。

图3 共有指纹峰的指认Fig.3 Identification of common peaks 注:A:对羟基肉桂酸对照品;B:隐绿原酸对照品;C:绿原酸对照品;D:新绿原酸对照品;E:供试品。1:新绿原酸;5:绿原酸;8:隐绿原酸;9:对羟基肉桂酸。Note:A:P-hydroxycinnamic acid reference; B:Cryptochlorogenic acid reference; C:Chlorogenic acid reference; D:Neochlorogenic acid reference; E:Sample.1:Neochlorogenic acid; 5:Chlorogenic acid;8:Cryptochlorogenic acid; 9:p-Hydroxycinnamic acid.
2.3 化学计量学分析
化学计量学中的模式识别技术,分为有监督和无监督两种方式,无监督模式识别技术用于中药研究领域,用的最多诸如聚类分析(HCA)和主成分分析(PCA),常用于观察样本之间的分类趋势;而有监督模式识别技术常用的方法为偏最小二乘法-判别式分析以及正交偏最小二乘法-判别式分析,用于显示样品间的差异主要由哪些变量引起,化学计量学分析方法已广泛用于中药的真伪鉴别、基原研究、炮制工艺研究及质量分析[12,13]。
2.3.1 聚类分析(HCA)
采用IBM SPSS Statistics 20.0软件,以18批白茅根标准汤剂指纹图谱的9个共有指纹峰的峰面积积分值为变量,并采用Z得分法对峰面积积分值进行标准化处理,样本间距以平方Euclidean距离表征,采用组间联接法对18批白茅根标准汤剂指纹图谱进行系统聚类分析,结果见图4所示。结果显示,当组间距离为10时,18批白茅根标准汤剂样品被分为三类,其中编号S7~S12的样品归为一类,编号S1~S6的样品归为第二类,编号S13~S18的样品归为第三类。通过产地分析可知,河北产区的白茅根标准汤剂自成一类,而江苏产区的白茅根标准汤剂部分批次分别与安徽和河南产区的样品聚为一类,聚类分析结果基本与相似度评价结果相类似。

图4 聚类分析图Fig.4 Cluster analysis diagram
2.3.2 主成分分析(PCA)
以白茅根标准汤剂指纹图谱9个共有峰的峰面积积分值为变量,导入SIMCA14.1软件,进行PCA分析,共生成3个主成分,R2X为0.963,Q2为0.741,均大于0.5,证明模型有效。其中主成分1累积贡献率为77.3%,主成分2累积贡献率为13.2%,前两个主成分累积贡献率在90%以上,以前两个主成分的得分值为X、Y轴,自动生成18批白茅根标准汤剂指纹图谱PCA得分图,结果见图5所示。结果显示,除江苏外,其余3个产区的样品相互比较,同一产区样品在PCA得分图上分布较集中,说明其指纹图谱共有峰的差异性较小,不同产区样品在PCA得分图上的位置相距较远,说明其共有峰的差异较大。与河北、安徽、河南3个产区相比,江苏产区的5批白茅根标准汤剂在PCA得分图上分布较为分散,其中编号为S11和S12的样品在PCA得分图上与安徽产区的样品距离接近,编号为S13~S15的样品在PCA得分图上与河南产区的样品距离接近,说明江苏产区不同批次的白茅根标准汤剂化学成分也存在较大差异,PCA分析结果基本与HCA结果基本一致。
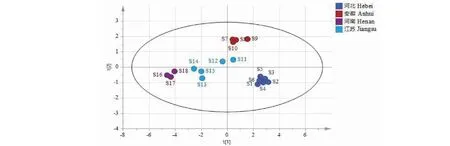
图5 PCA得分图Fig.5 PCA scores plot
2.3.3 正交偏最小二乘法-判别式分析(OPLS-DA)
以9个共有指纹峰的峰面积积分值为变量导入SIMCA14.1软件,进行OPLS-DA分析,运用统计推断方法分析该模型,将模型随机排列200次做置换检验,结果见图6。由图6可知,R2和Q2截距值分别为0.083和-0.449,置换检验图左边的R2和Q2值均小于最右边的值,说明建立的OPLS-DA模型没有出现过拟合现象。通过SIMCA14.1软件,建立4个产区白茅根标准汤剂样品的OPLS-DA模型,生成OPLS-DA得分图,见图7所示,OPLS-DA模型中累积解释能力参数R2X(cum)为0.954,累积解释能力参数R2Y为0.716,预测能力参数Q2为0.608,均大于0.5,表明模型的拟合准确性好,具有较强的解释和预测能力,利用SIMCA14.1软件生成变量VIP图,对变量的显著性进行预测,结果见图8所示。结果显示,4个产区白茅根标准汤剂样品OPLS-DA得分图与PCA得分图类似,表明以9个共有指纹峰的峰面积为变量,不同产区的标准汤剂样品存在明显差异,而同一产区,除江苏外,共有峰的差异较小。以VIP>1.0筛选具有显著差异的色谱峰,并以VIP值进行排序,结果显示,峰9(对羟基肉桂酸)>峰6>峰5(绿原酸)>峰2>峰8(隐绿原酸)>峰1(新绿原酸)>峰3>峰7>峰4,其中VIP值大于1.0的色谱峰分别为峰9(对羟基肉桂酸)、峰6和峰5(绿原酸),说明不同产区白茅根标准汤剂羟基肉桂酸和绿原酸的含量有着较明显的差异,可能与药材的采收时间和产区加工方式的不同有关。
2.4 含量测定
2.4.1 精密度考察
精密吸取白茅根标准汤剂(编号:S1)供试品溶液,按照“2.2.1”项下色谱条件重复进样6次,记录绿原酸、新绿原酸、隐绿原酸和对羟基肉桂酸色谱峰面积,并计算峰面积RSD值分别为0.25%、0.12%、0.20%及0.51%,表明该方法精密度良好。

图6 OPLS-DA模型置换检验图Fig.6 OPLS-DA model permutation test diagram

图7 OPLS-DA得分图Fig.7 OPLS-DA scores diagram

图8 OPLS-DA模型VIP图Fig.8 VIP diagram of OPLS-DA
2.4.2 线性关系考察
精密称定绿原酸对照品3.734 mg、新绿原酸对照品1.679 mg、隐绿原酸对照品1.663 mg、对羟基肉桂酸对照品2.036 mg,置20 mL量瓶中,加50%甲醇溶解,并稀释至刻度,即得绿原酸、新绿原酸、隐绿原酸和对羟基肉桂酸混合对照品储备液。精密量取上述混合对照品储备液0.2、0.4、1、2、4 mL,分别置20 mL量瓶中,加50%甲醇稀释,并定容至刻度,摇匀,制成每1 mL含绿原酸1.86、3.71、9.27、18.54、37.08 μg,含新绿原酸0.81、1.62、4.06、8.12、16.24μg,含隐绿原酸0.82、1.65、4.12、8.24、16.48 μg,含对羟基肉桂酸1.02、2.03、5.08、10.16、20.32 μg的混合对照品应用液,分别精密吸取上述对照品储备液和应用液,按“2.2.1”项下色谱条件依次进样2μL,记录色谱峰面积。以峰面积为纵坐标(Y),对照品浓度为横坐标(X)绘制标准曲线,结果显示,绿原酸的线性回归方程为:Y=24 218.07X+21 285.41,相关系数r=0.999 9,表明在浓度1.86 μg/mL~185.39 μg/mL的范围内绿原酸浓度与峰面积线性关系良好,新绿原酸的线性回归方程为:Y=25 449.74X-893.08,相关系数r=1.000 0,表明在浓度为0.81 μg/mL~81.20 μg/mL的范围内新原酸浓度与峰面积线性关系良好,隐绿原酸的线性回归方程为:Y=27 804.92X-6 109.84,相关系数r=0.999 8,表明在浓度为0.82 μg/mL~82.40 μg/mL的范围内隐绿原酸浓度与峰面积线性关系良好,对羟基肉桂酸的线性回归方程为:Y=26 415.77X-7 481.78,相关系数r=0.999 9,表明在浓度为1.02 μg/mL~102.00 μg/mL的范围内对羟基肉桂酸浓度与峰面积线性关系良好。
2.4.3 重复性考察
取同一批白茅根标准汤剂冻干粉(编号:S1),平行称定6份,按“2.2.3”项下确定的供试品溶液制备方法,制备供试品溶液6份。按“2.2.1”项下色谱条件进行测定,分别计算绿原酸、新绿原酸、隐绿原酸和对羟基肉桂酸的含量和RSD值,结果显示,绿原酸的平均含量为1.91 mg/g,RSD值为0.91%,新绿原酸的平均含量为0.84 mg/g,RSD值为1.02%,隐绿原酸的平均含量为0.85 mg/g,RSD值为1.27%,对羟基肉桂酸的平均含量为1.06 mg/g,RSD值为1.56%,表明该方法重复性良好。
2.4.4 加样回收率考察
取已知含量的白茅根标准汤剂冻干粉(编号:S1)适量,研细,取约0.05g,精密称定,平行6份,按样品与对照品含量比为1∶1的比例加入绿原酸、新绿原酸、隐绿原酸和对羟基肉桂酸对照品,按“2.2.3”项下方法制备6份供试品溶液,按“2.2.1”项下色谱条件进样测定,计算加样回收率,结果见表3。结果显示,绿原酸的加样回收率均值为99.93%,回收率范围为99.02%~100.78%,RSD值为0.71%,新绿原酸的加样回收率均值为101.78%,回收率范围为100.47%~102.61%,RSD值为0.83%;隐绿原酸的加样回收率均值为99.59%,回收率范围为98.27%~102.51%,RSD值为1.72%,对羟基肉桂酸的加样回收率均值为98.79%,回收率范围为97.15%~101.22%,RSD值为1.85%,均符合2020年版《中国药典》通则9101的规定,表明该方法的准确度良好。

表3 加样回收率测定结果Table 3 Results of the sample recovery rate
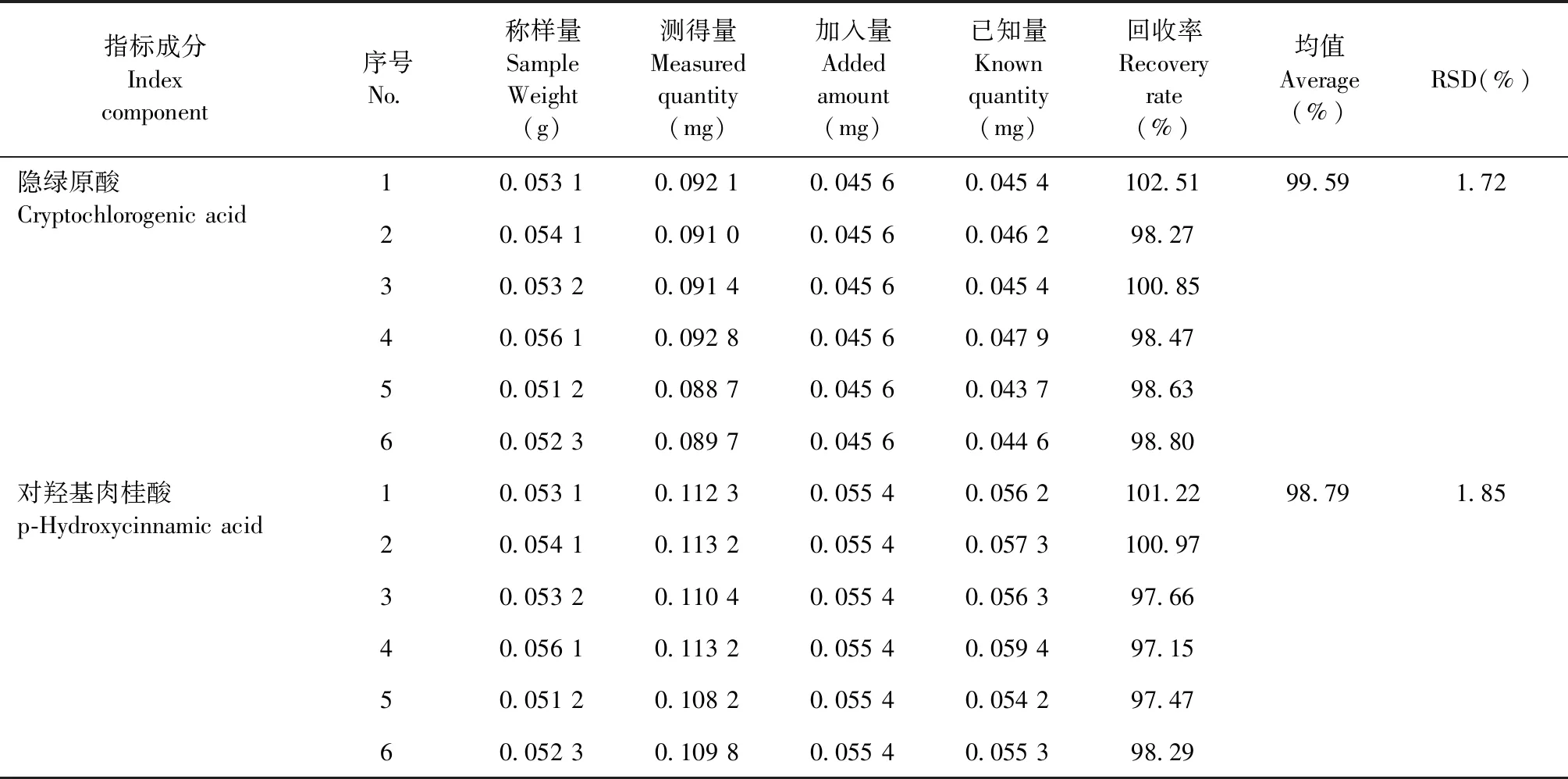
续表3(Continued Tab.3)
2.4.5 稳定性考察
精密吸取白茅根标准汤剂(编号:S1)供试品溶液,按“2.2.1”项下色谱条件,分别在0、3、6、8、12、18、24 h进样分析,计算峰面积RSD值,结果显示,绿原酸、新绿原酸、隐绿原酸和对羟基肉桂酸的峰面积RSD值分别为0.19%、0.56%、0.96%和1.02%,均小于3.0%,说明供试品溶液在24h内稳定性良好。
2.4.6 样品测定
取18批白茅根标准汤剂冻干粉,按“2.2.3”项下方法制备供试品溶液,按“2.2.1”项下色谱条件进样分析,分别记录供试品溶液中绿原酸、新绿原酸、隐绿原酸和对羟基肉桂酸的色谱峰面积,并采用外标法计算含量,结果如表4所示。结果显示,白茅根标准汤剂4种酚酸的总含量:河北>安徽>江苏>河南,不同产区的样品4种酚酸类成分的含量差异较大,主要由白茅根药材的含量差异所致,根据对药材的测定结果来看,河北产区的白茅根药材4种酚酸的总含量最高,河南产区的3批样品含量较低,这种差异可能与不同产区的白茅根药材的生长环境、产地加工和采收时间的不同有关。此外,河南产区白茅根标准汤剂绿原酸、新绿原酸和隐绿原酸的含量均低于其他产区,安徽产区的白茅根标准汤剂对羟基肉桂酸的平均含量最高且比较稳定,但绿原酸、新绿原酸和隐绿原酸的含量并不高;江苏产区不同批次白茅根标准汤剂对羟基肉桂酸和4种酚酸的总含量波动比较大,绿原酸、新绿原酸和隐绿原酸的含量也不高。根据上述研究结果,企业将白茅根药材的固定产地规定为河北省邢台市具有一定的现实意义。

表4 18批白茅根标准汤剂含量测定结果 Table 4 Content determination of 18 batches of Imperatae Rhizoma standard decoction

续表4(Continued Tab.4)
3 讨论与结论
3.1 含量指标的选择
目前对白茅根含量测定指标的研究较少,多集中在对酚酸和糖类的测定上[14,15],也有报道测定白茅根中白茅素、芦竹素的含量,但白茅素和芦竹素在药材中的含量很低[16],白茅根标准汤剂以水为溶剂,有效成分以水溶性成分为主,白茅素、芦竹素不仅含量低,且为脂溶性成分,因此,不适宜作为指标成分,糖类成分专属性差,也不宜作为指标性成分。从指纹图谱的研究中也发现,白茅根虽然化学成分多,但有效成分含量均较低。从指纹图谱中指认出4个峰型较高的色谱峰,均为酚酸类成分,且均与白茅根标准汤剂的药理活性密切相关,因此,在含量指标的选择上,首选酚酸类成分的测定。研究表明,绿原酸、新绿原酸和隐绿原酸在酸性pH条件下较为稳定,而在中性和碱性条件下不稳定,相互之间存在一定的转化[17,18]。我们在对白茅根药材和标准汤剂指纹图谱研究过程中发现,相对于白茅根药材,白茅根标准汤剂指纹图谱,峰1(新绿原酸)、峰8(隐绿原酸)与峰5的峰面积比例明显增加,由此推测,白茅根在煎煮过程中,绿原酸、新绿原酸和隐绿原酸存在较大的转化几率。绿原酸、新绿原酸和隐绿原酸结构类似,具有相同或相近的药理活性[9],因此,我们认为,白茅根标准汤剂在选择含量指标时,应以测定绿原酸、新绿原酸和隐绿原酸的总量为佳,而不仅仅是测定单一的绿原酸类成分。研究结果显示,不同产区的白茅根标准汤剂4种酚酸类成分的总量存在明显差异,反映了不同产区白茅根药材质量的优劣,可能与不同产区药材的采收时间和产地加工方式的不同有关。
3.2 分析方法的建立
目前采用指纹图谱结合多成分定量对白茅根进行质量控制的研究尚未见到,白茅根标准汤剂冻干粉含有较多的糖类,且酚酸类成分结构相似,对色谱分离要求较高。因此,在方法的建立中,充分考察不同的流动相比例、不同的色谱柱、柱温、流速对各指纹峰,尤其是含量测定色谱峰的分离效果,优选最佳的色谱条件和色谱柱;选择280、300、325、350 nm作为检测波长,并进行全波扫描,记录样品在200~400 nm范围内的吸收光谱,结果显示,不同波长下,各色谱图色谱峰数目和峰型无明显区别,采用325 nm为检测波长,色谱峰的吸收值最大,因此,选择325 nm作为该特征图谱的检测波长。采用单因素分析方法,对提取溶剂(甲醇、10%甲醇、50%甲醇、70%甲醇、70%乙醇、50%乙醇、10%乙醇)、提取方式(超声和加热回流),溶剂用量(15、25、50 mL)和提取时间(15、30、45 min)进行考察,最终确定合理的供试品溶液的制备方法。
3.3 相似度评价和化学计量学分析
指纹图谱相似度计算结果显示,河南产区3批白茅根标准汤剂的相似度值明显低于其他产区,说明河南的白茅根在化学成分的组成比例上与其他产地存在明显差异。HCA和PCA结果均能很好区分河北、安徽、河南产区的样品,但对江苏产区的样品区分不明显。绿原酸等酚酸类成分易溶于水,遇热不稳定,因此,产地加工、储藏、运输等均会影响药材的质量,从而导致不同产区白茅根标准汤剂质量的差异。采用OPLS-DA寻找到3个差异性标志物,根据VIP值排序,分别为峰9>峰6>峰5,说明不同产区的白茅根标准汤剂峰9、峰6和峰5的差异具有显著性,已经证实峰9为对羟基肉桂酸,峰5为绿原酸、峰6有待进一步研究。目前多省出台地方政策,鼓励药材产地鲜切,减少有效成分的损失[19],有报道研究显示,草珊瑚药材趁鲜清洗、切段制成的饮片中绿原酸、新绿原酸和隐绿原酸等成分的含量明显高于传统加工方式制成的饮片,趁鲜加工的草珊瑚饮片抗炎、镇痛的效果明显优于传统饮片,表明草珊瑚炮制与产地加工一体化的可行性[20]。白茅根富含酚酸类成分,尤其适用于产地鲜加工,从而提高药材的含量。
本研究建立了白茅根标准汤剂UPLC指纹图谱方法并同时对4种酚酸类成分进行测定,该方法操作简便,稳定可靠,重复性好,为白茅根标准汤剂、药材、饮片及其相关制剂的质量评价提供重要参考。

