法螺G型溶菌酶重组蛋白的原核表达及抑菌活性探究
贾慧霞, 张 华, 张成龙, 何毛贤, 刘文广
法螺G型溶菌酶重组蛋白的原核表达及抑菌活性探究
贾慧霞1, 2, 张 华1, 3, 张成龙4, 何毛贤1, 3, 刘文广1, 3
(1. 中国科学院热带海洋生物资源与生态重点实验室, 广东省应用海洋生物学重点实验室, 中国科学院南海海洋研究所, 广东 广州 510301; 2. 中国科学院大学, 北京 100049; 3. 南方海洋科学与工程广东省实验室(广州), 广东 广州 511458; 4. 三沙市海洋和渔业局, 海南 三沙 573199)
G型溶菌酶(G-type lysozyme,)是一种富含半胱氨酸的天然免疫因子, 在无脊椎动物的免疫防御过程中起重要作用。本研究旨在通过揭示法螺() G型溶菌酶()重组蛋白的抑菌功能, 为进一步认识法螺的分子免疫机理及病害防治提供新思路。首先对序列进行了分析, 利用实时荧光定量PCR检测的组织分布, 然后以pGEX-4T-1为表达载体, 构建重组质粒pGEX-4T-1-, 进行重组蛋白表达, 并检测了重组蛋白的抑菌活性。结果显示: 1)cDNA的5′非翻译区(UTR)为66 bp, 3′UTR为186 bp, 开放阅读框为789 bp, 编码262个氨基酸, 有1个可溶性转糖苷酶(SLT)结构域(72~255 aa), 包含6个半胱氨酸残基和3个酶活性催化位点(Glu72、Asp85、Asp96); 2) 多序列比对及系统发育分析表明,与亲缘关系较近的福寿螺G型溶菌酶氨基酸的同源性最高; 3)在所有被检测组织中均表达, 其中在肝脏、外套膜表达量较高; 4) 16 ℃, 0.5 mmol/L IPTG诱导表达10 h后, 重组蛋白在上清液和包涵体均表达分子量约为51.91 kDa, 纯化后得到浓度为1.2 mg/mL的重组蛋白; 5) 抑菌实验表明, 重组蛋白pGEX-4T-1-具有抗金黄色葡萄球菌、藤黄微球菌、施罗氏弧菌的活性, 对革兰氏阳性细菌的抑菌作用大于革兰氏阴性细菌。研究结果为进一步解析法螺免疫防御的分子机理提供了参考数据和科学依据。
法螺; G型溶菌酶; 原核表达; 抑菌活性
溶菌酶是生物体内重要的非特异性免疫因子, 与抵御细菌感染的免疫功能密切相关[1]。在水产动物抵抗外来病原细菌、真菌或病毒入侵时, 溶菌酶能增强其他免疫因子的抗菌活性, 并协同抵制病原菌的入侵[2-3]。溶菌酶是一种天然的碱性抗菌蛋白, 通过水解肽聚糖β-1, 4糖苷键发挥溶菌功能[4-5]。根据来源、免疫特性、结构及催化特征的不同, 动物体内的溶菌酶主要分为G型、C型和I型, 广泛存在于免疫器官和细胞中[6]。C型溶菌酶主要存在于脊椎动物中; I型溶菌酶主要分布在无脊椎动物中; G型溶菌酶最早因从鹅蛋清(goose egg-white)中分离、鉴定而得名, 主要存在于鸟类、鱼类及无脊椎的双壳软体动物中[7]。近年来, 关于水生动物G型溶菌酶的报道日渐增多, 如长牡蛎[8]()、栉孔扇贝[9]()、紫贻贝[10]()和膨腹海马[7]()等中发现G型溶菌酶在不同组织中发挥一定的免疫防御作用。然而, 其在腹足纲软体动物法螺()中的作用还未见有报道。
法螺()隶属于嵌线螺科(Ranellidae)、法螺属[11](Charonia)。法螺的壳有美丽的花纹, 具有重要的经济价值[12-13]。法螺是珊瑚礁敌害生物——长棘海星的天然捕食者, 是珊瑚礁的卫士, 在维持珊瑚礁生态系统平衡中具有重要作用。近年来, 法螺自然资源由于环境污染和过度捕捞被严重破坏[14-15], 在中国南海海域面临灭绝的危险, 被列为国家二级保护动物[16], 因此亟需开展相关研究。在前期工作中, 团队在陆上水泥池对中法螺进行了养殖实验, 在2020年6—7月, 法螺发生病害, 死亡严重。在感染初期, 我们对法螺足、外套膜、腮等组织进行了细菌检测, 结果鉴定出的病原菌主要包括弧菌和葡萄球菌。由此, 我们推测法螺在饲养过程中出现的病害可能是细菌感染引起的。因此, 本研究通过分析法螺溶菌酶基因的结构, 鉴定其为G型溶菌酶。同时, 应用实时荧光定量PCR分析在法螺不同组织中的表达情况, 并通过构建原核表达载体诱导表达法螺G型溶菌酶重组蛋白、分析重组蛋白的抑菌功能, 为认识法螺的免疫机理和病害防控提供资料。
1 材料与方法
1.1 实验材料
法螺组织: 法螺收集于南海海域, 暂养在广东省雷州市养殖基地。取3只大小一致、生长状况良好个体, 剖取其外套膜、足、触手、长鼻、唾液腺、肠及肝脏组织立即于液氮速冻, 然后保存于–80 ℃超低温冰箱。
菌株, 质粒和试剂: 大肠杆菌DH5α和pGEX-4T-1载体由本实验室保存; 大肠杆菌(BL21)购自北京全式金生物技术有限公司; 藤黄微球菌、肠炎沙门氏菌、溶藻弧菌、施罗氏弧菌由中国科学院南海海洋研究所宋永相老师惠赠; 金黄色葡萄球菌由中国科学院南海海洋研究所向志明老师惠赠。总RNA提取试剂盒购自Magen公司; 反转录试剂盒购自Toyobo公司; T4 DNA连接酶、DNA限制性内切酶EcoRI和NotI均购自TaKaRa公司; genefist三色预染蛋白marker 10-180KD(protein marker)购自广州捷承科技有限公司。
1.2 生物信息学分析及所用软件
使用ORF Finder (https://www.ncbi.nlm.nih.gov/ orffinder/)查找开放阅读框(ORF); 利用ClustalX及CLC Main Workbench 6.0软件进行多序列比对; 氨基酸结构域分析使用SMART(http:// smart.embl-heidelberg.de/)。通过ProtParam(https:// web.expasy.org/protparam/)分析氨基酸序列各项理化性质; 通过SignalP5.0(http://www.cbs.dtu.dk/services/ SignalP/)预测是否含有信号肽; 利用TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测跨膜结构域; 通过MEGA 6.0软件, 用循环邻接法Neighbor joining构系统发育树, 置信度检验1 000次。
1.3 RNA提取、cDNA合成及实时荧光定量PCR
采用通用型RNA提取试剂盒(Magen)提取组织RNA, 用紫外可见光谱仪测定其浓度, 琼脂糖凝胶检测RNA条带完整性。然后, 使用去除gDNA的逆转录试剂盒(Toyobo)进行cDNA第一链合成。用384孔板配置反应, 每孔总反应体系为10 μL, 包括: 5 μL qPCR反应酶(Toyobo)、0.3 μL正向引物和0.3 μL反向引物(序列见表1)、3.4 μL双蒸水及用双蒸水稀释的1 μL模板cDNA。反应程序设置为94 ℃预变性3 min, 98 ℃变性10 s, 退火温度根据引物TM值设置为59 ℃、25 s, 预变性循环1次, 变性退火延伸循环45次; 18S为内参基因, 重复3次。根据2−ΔΔCt法计算的表达量, 用Prism 8.0的T检验进行统计分析,0.05具有统计学意义。
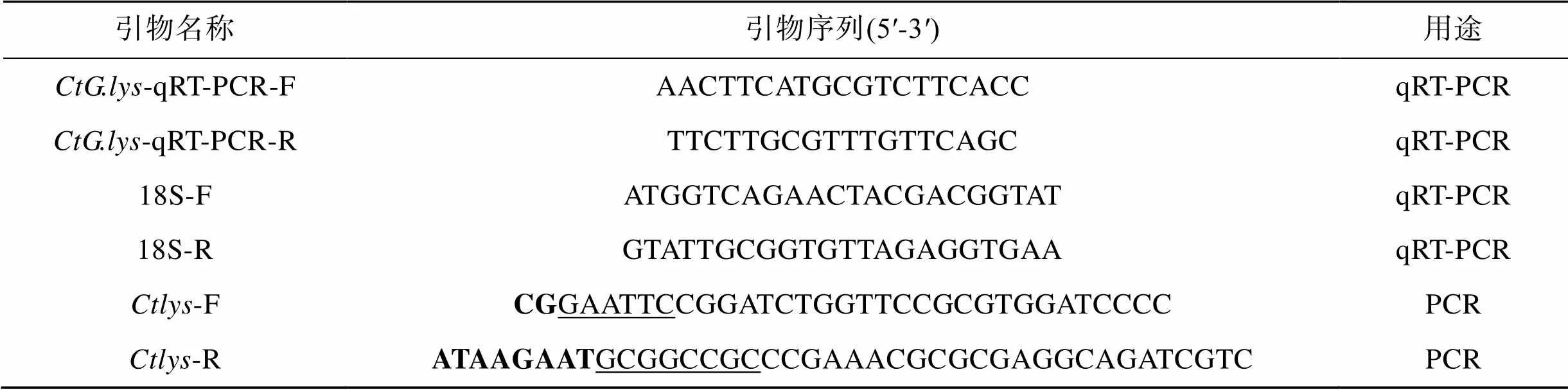
表1 本研究中所用引物
1.4 重组表达菌株的诱导表达与可溶性检测
1.4.1 重组质粒pGEX-4T-1-的构建及诱导表达
PCR反应扩增(引物序列见表1, 下划线碱基为EcoRI, NotI酶切位点, 粗体碱基为保护基团), 扩增体系25 μL: 引物0.5 μL, 模板cDNA 1 μL, Ex Taq 保真酶12.5 μL, ddH2O 10.5 μL。循环参数: 95 ℃预变性5 min; 95 ℃、15 s, 58 ℃ 15 s, 72 ℃、1 min, 32个循环, 72 ℃终延伸1 min。将目的基因PCR产物和表达载体pGEX-4T-1经限制性内切酶EcoRI, NotI(TaKaRa 1611, 1623)进行双酶切反应, 后用T4 DNA酶(TaKaRa 2011A)低温连接, 按1∶20比例将构建好的重组质粒转化至大肠杆菌DH5α感受态细胞。次日挑取单菌落至LB(含氨苄)液体培养基, 经菌落PCR测定后送华大基因测序鉴定, 重组质粒命名为pGEX-4T-1-。将测序正确的pGEX-4T-1-转化到表达宿主菌BL21感受态细胞中。取50 μL已转化的重组质粒菌株接种于含100 mg/mL氨苄青霉素的LB固体培养基中, 次日挑取单菌落至5 mL LB(含氨苄)液体培养基37 ℃, 200 r/min振荡培养至OD600值为0.5~0.6; 加入IPTG至终物质的量浓度1.0 mmol/L, 37 ℃, 200 r/min诱导表达4 h后收菌。以未经诱导的重组质粒作为对照, SDS-PAGE法检测全菌中目的蛋白表达情况。
1.4.2 重组蛋白的可溶性检测
取3管20 mL OD600=0.4~0.6的pGEX-4T-1-菌液分别加入0.5 mmol/L IPTG(以未诱导菌液为对照)。分别在20 ℃、16 ℃诱导10 h后各收集5 mL菌液, 用PBS缓冲液重悬菌液并超声破碎, 4 ℃, 6 000 g离心10 min, 分别收集上清和沉淀, 分别取100 μL上清液和沉淀高温变性。SDS-PAGE电泳检测破碎上清液(可溶性)和沉淀(包涵体)中重组蛋白表达情况。
1.5 重组蛋白的纯化
收集400 mL诱导后的菌液, 用PBS洗涤菌体, 按1∶20比例重悬菌体, 冰浴超声波破碎, 离心收集上清液。利用GST标签蛋白纯化试剂盒(碧云天生物技术公司P2262), 按产品说明书纯化重组蛋白。收集的洗脱液即为纯化的蛋白样品, SDS-PAGE电泳检测纯化后的重组蛋白。取纯化后的蛋白样品, 按5倍比例稀释后用BCA法(BCA蛋白定量试剂盒上海雅酶生物科技有限公司ZJ101)测定纯化后的蛋白浓度。样品设置5个重复, 以牛血清白蛋白BSA, 用PBS稀释至终质量浓度为2 mg/mL作为标准品绘制标准曲线, 用酶标仪(Tecan infinite 200Pro)测定562 nm处标准品和纯化重组蛋白的吸光度值, 绘制标准曲线, 计算样品中的蛋白浓度。
1.6 重组蛋白的抑菌活性鉴定
选取革兰氏阳性细菌金黄色葡萄球菌、藤黄微球菌和革兰氏阴性细菌肠炎沙门氏菌、溶藻弧菌及施罗氏弧菌划线活化, 挑取活化后的单菌落过夜培养, 次日按10%的接种量加到LB液体(弧菌另加2.5%海盐)培养基中发酵至OD600为0.5备用。采用平板涂布法[17-19], 以1∶100(V∶V)与纯化后的重组蛋白混合, 按各菌株的培养条件, 培养2 h后取100 μL涂布于LB(或含2.5%海盐)平板, 以不加重组蛋白、用纯化时收集的pGEX-4T-1-流穿液涂布作为对照。
采用液体生长抑制法[20], 用无菌的PBS溶液将纯化后的法螺溶菌酶重组蛋白稀释至终浓度为120、140、204、220 μg/mL, 各取100 μL培养至OD600为0.5的金黄色葡萄球菌、藤黄微球菌、肠炎沙门氏菌、溶藻弧菌及施罗氏弧菌菌液备用, 与各取100 μL稀释至所需浓度的重组蛋白混合均匀, 加入至96孔板中, 重复3次, 以不加重组蛋白用PBS代替的孔作为对照, 37 ℃、28 ℃过夜培养, 用酶标仪测定OD600, 根据实验孔与对照孔中各菌株的生长情况判断, 当菌液吸光值没有明显增加且肉眼观察无明显细菌增长时[21], 该孔对应的蛋白浓度即为最低抑菌浓度。
2 结果分析
2.1 法螺溶菌酶基因CtG.lys序列特征
全长cDNA编码1 041 bp cDNA, 855 bp CDS序列, 其中5′UTR为66 bp, 3′UTR为186 bp, ORF为789 bp, 编码262个氨基酸。ProtParam预测其蛋白质分子式C1098H1703N333O354S21, 相对分子质量25.91 kDa, 理论等电点(PI)是7.95; 氨基酸含量较高的有: Gly(14.3%)、Ser(9.4%)、Ala(9.0%)、Asn(6.9%)、Leu(5.3%); 含16个带负电氨基酸(Asp + Glu)、含18个带正电氨基酸(Arg + Lys); 脂肪系数60.20, 总平均亲水性为–0.372, 属于亲水性蛋白。
SignaIP 5.0分析结果表明该蛋白有信号肽存在, 且位于17与18位氨基酸之间, 该蛋白为分泌蛋白。SMART分析表明该成熟肽有1个转糖苷酶(SLT)结构域, 位于72~255 aa; TMHMM预测结果显示该蛋白不存在跨膜结构。利用SWISS-MODEL对氨基酸序列进行三维结构预测, 用同源建模法进行模型创建, 非洲鸵鸟()(GenBank No.: 3wyh_A)为模板。建模的结果如图1所示: 预测的三维结构符合G型溶菌酶蛋白结构, 包含7个α螺旋,的催化位点氨基酸残基(Glu72、Asp85、Asp96)与模板蛋白(Glu73、Asp86、Asp97)的空间位置几乎一致, 含有6个半胱氨酸残基。
2.2 法螺溶菌酶CtG.lys系统进化
NCBI氨基酸一致性分析显示法螺氨基酸序列与海蜗牛(登录号: XP_012944836.1)、福寿螺(登录号: XP_025083688.1)氨基酸一致性较高, 分别为45.11%和45.95%。与斑马鱼(登录号: NP_001076289.1)和原鸡(登录号: XP_040517238.1)的一致性较低, 分别为39.67%和32.43%; 多序列比对显示,与海蜗牛同源性较为一致(图2)。不同物种系统发育分析结果显示, 福寿螺和海蜗牛首先聚为一支, 其次与法螺聚为一支, 表明法螺与福寿螺和海蜗牛亲缘关系最近(图3)。

图1 法螺CtG.lys(红色)与非洲鸵鸟的溶菌酶G.lys (绿色)三维结构

图2 法螺CtG.lys与多物种同源蛋白序列比对
注: 黑色背景碱基保守性≥50%, 灰色代表碱基相似

图3 法螺CtG.lys与其他物种溶菌酶G.lys的邻接法(N-J)系统进化分析(置信度检验1 000次)
2.3 法螺CtG.lys基因在不同组织表达分析
qRT-PCR检测在法螺不同组织中的表达模式。结果显示表达具有明显的组织差异性, 在肝脏表达量最高, 外套膜、唾液腺、肠次之, 与其他组织相比差异显著(图4)。

图4 法螺CtG.lys在不同组织的表达
注: 各组间含有不同字母表示差异显著(0.05), 含相同字母表示无差异
2.4 重组蛋白pGEX-4T-1-CtG.lys原核表达及可溶性检测
重组工程菌大肠杆菌BL21-pGEX-4T-1-经IPTG诱导后表达出相对分子质量约为51.91 kDa的融合蛋白, 以蛋白分子量10~180 kDa Maker(Genefist GF6616)为参考, 而对照组未诱导的DE3-pGEX- 4T-1-(图5泳道1)则无此特异性条带。由于法螺溶菌酶的蛋白分子量约为25.91 kDa, 且pGEX-4T-1包含的GST标签蛋白分子量约为26 kDa, 故全菌中重组蛋白大小约为51.91 kDa(图5泳道2~9), 说明增加的蛋白条带就是重组菌株被诱导表达的融合蛋白产物。

图5 pGEX-4T-1-CtG.lys重组质粒在大肠杆菌BL21中的IPTG诱导表达
注: 1: 未经IPTG诱导的BL21(pGEX-4T-1-)全菌蛋白; 2~9: IPTG诱导的BL21(pGEX-4T-1-)全菌蛋白; M: 蛋白质分子质量标准Marker; 箭头指示条带为重组蛋白
重组工程菌大肠杆菌BL21-pGEX-4T-1-经20 ℃、16 ℃, 0.5 mmol/L IPTG浓度诱导培养10 h后, 收集菌体, PBS洗涤重悬。经超声波破碎后, 离心收集上清液和包涵体沉淀。将蛋白分子量10~180 kDa Maker(Genefist GF6616)、破碎上清液和沉淀进行SDS-PAGE电泳, 检测pGEX-4T-1-重组蛋白的可溶性。结果显示, 20 ℃, 0.5 mmol/L诱导10 h重组蛋白只以包涵体的形式存在(图6a泳道6), 而16 ℃, 0.5 mmol/L诱导10 h时重组蛋白同时在上清(图6b泳道5~8)和包涵体中表达(图6b泳道1~4)。
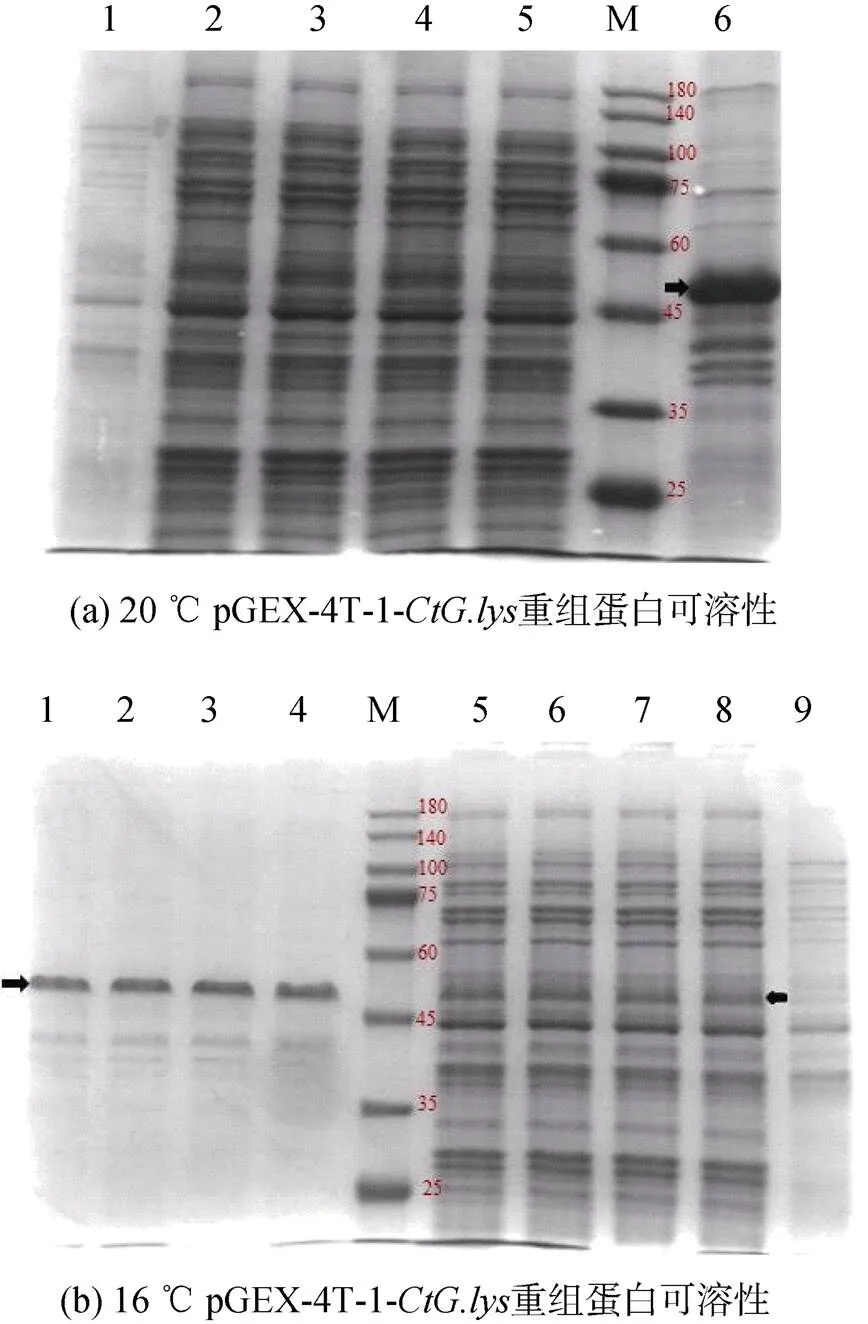
图6 pGEX-4T-1-CtG.lys重组蛋白可溶性SDS-PAGE分析
注: a: 1. 未经IPTG诱导的BL21(pGEX-4T-1-)全菌蛋白; 2~5. IPTG诱导的BL21(pGEX-4T-1-)上清液; 6. IPTG诱导的BL21(pGEX-4T-1-)包涵体; M. 蛋白质分子质量标准Marker; 箭头指示条带为重组蛋白; b: 1~4. IPTG诱导的BL21(pGEX-4T-1-)包涵体; 5~8. IPTG诱导的BL21 (pGEX-4T-1-)上清液; 9. 未经IPTG诱导的BL21 (pGEX-4T-1-)全菌蛋白; M. 蛋白质分子质量标准Marker; 箭头指示条带为重组蛋白
2.5 重组蛋白pGEX-4T-1-CtG.lys的纯化
通过亲和层析柱去除未结合的蛋白, 收集此时的流穿液。用裂解液洗脱亲和层析柱, 收集洗脱液; 再用含GST的洗脱缓冲液, 将GST融合蛋白从树脂上洗脱下来, 即得到纯化的融合蛋白。将蛋白分子量10~180 kDa Maker(Genefist GF6616)、流穿液(图7a泳道1)、洗脱液(图7a泳道2~3)、纯化的融合蛋白变性后进行SDS-PAGE鉴定, 均可见到明显的目的蛋白, 表示纯化成功结果见(图7a 泳道4~10)。测定纯化重组蛋白浓度绘制BSA标准曲线如图7b。

图7 pGEX-4T-1-CtG.lys重组蛋白SDS-PAGE纯化分析及BSA标准曲线
注: M: 蛋白分子量标准; 1. 上样流穿液; 2~3. 洗涤液; 4~10. 洗脱纯化后的蛋白; 箭头指示条带为纯化后的重组蛋白
2.6 重组蛋白pGEX-4T-1-CtG.lys的抑菌活性
平板涂布法的抑菌活性测定结果显示, 纯化后的重组蛋白(图8实验组)与革兰氏阳性细菌金黄色葡萄球菌、藤黄微球菌; 革兰氏阴性细菌肠炎沙门氏菌、溶藻弧菌及施罗氏弧菌作用后, 菌落数明显少于对照组(图8对照组)。其中法螺溶菌酶重组蛋白作用后金黄色葡萄球菌、藤黄微球菌、施罗氏弧菌与对照组相比菌落数明显减少; 肠炎沙门氏菌、溶藻弧菌的菌落数与对照组相比数量较少不明显(图8)。这表明法螺溶菌酶重组蛋白对革兰氏阳性细菌的抑菌作用大于革兰氏阴性细菌。采用液体生长抑制法测定重组蛋白对金黄色葡萄球菌、藤黄微球菌、施罗氏弧菌的最小抑菌浓度, 结果表明, 重组蛋白对金黄色葡萄球菌的最小抑菌质量浓度为70 μg/mL; 对藤黄微球菌的最小抑菌质量浓度为104 μg/mL; 对施罗氏弧菌的最小抑菌质量浓度为110 μg/mL。
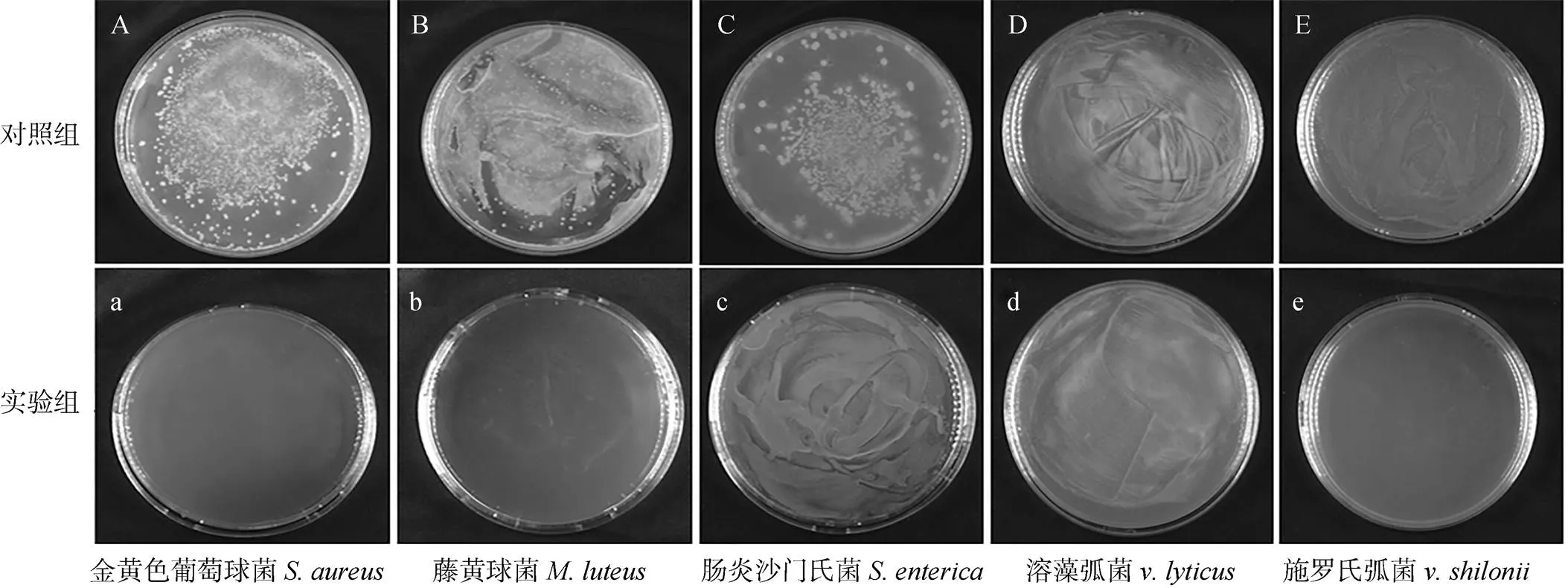
图8 法螺G型溶菌酶重组蛋白的抑菌效果
3 讨论
溶菌酶能诱导非特异性免疫应答, 具有抗菌、抗炎症特性[22], 是一种天然的内源性抗生素[23]。水生动物溶菌酶较陆生动物溶菌酶具有更广的抗菌谱, 能溶解革兰氏阳性菌和革兰氏阴性菌[24], 使其在病害防治中有很好的应用前景。本研究利用同源建模法构建的蛋白三维结构表明, 法螺的SLT结构域含有3个酶活性催化位点, 即: Glu72、Asp85、Asp96。这与G型溶菌酶的典型代表-鹅蛋清溶菌酶[25](goose egg-white lysozyme)中的催化位点略有差异。据报道, 斑马鱼[26]、大黄鱼和金鱼[27]等G型溶菌酶的酶活性催化位点与鹅蛋清溶菌酶相比也存在位置差异情况[28]。在鱼类G型溶菌酶中, 第1位Glu和第3位Asp残基是其发挥抗菌作用的关键位点[29]。由此推测, 法螺G型溶菌酶发挥抑菌活性的关键可能是Glu和Asp残基与细菌细胞壁肽聚糖底物结合[30], 从而破坏N-乙酰葡糖胺和乙酰胞壁酸之间的糖苷键。
半胱氨酸是形成二硫键的前提, 二硫键的存在可使溶菌酶蛋白结构更稳定, 从而有助于增强水生动物对环境变化的适应性及在高渗透条件下的稳定性[31]。但是, G型溶菌酶的二硫键数目因物种不同存在较大的变化[32]。大西洋鲑鱼G型溶菌酶中存在3个半胱氨酸残基[6], 鲤鱼和条石鲷中不存在半胱氨酸残基[33-34]。本研究中, 法螺G型溶菌酶蛋白含有6个半胱氨酸残基, 能形成三对二硫键使其空间结构更紧密, 推测其可能在抵御细菌感染时能更稳定与细菌细胞壁肽聚糖底物相结合。溶菌酶的组织分布与其功能密切相关, 如鱼类中发挥免疫功能的G型溶菌酶基因, 在免疫组织脾脏中的表达量较高[3, 35]。本研究中, 法螺基因被检测到在肝脏和外套膜中高表达。外套膜能分泌具有抑菌和杀菌作用的黏液, 是软体动物免疫防御的第一道防线[1, 36]; 肝脏作为主要的解毒器官也参与免疫反应[37]。由此推断, 法螺基因在其免疫防御中发挥了一定的作用。
原核重组表达菌株经低温诱导能有效地增加可溶性蛋白的比例, 提高可溶性蛋白的表达量。叶星等[35]采用原核表达系统成功表达出草鱼G型溶菌酶; 杨梅等[4]利用原核表达系统经低温诱导获得小菜娥溶菌酶重组蛋白, 且表达产物对革兰氏阳性细菌的抑菌活性强于革兰氏阴性细菌; 王秀霞及徐永平等[38-39]在大肠杆菌中对刺参溶菌酶进行了表达, 表达产物对多种海洋致病菌均具有抑菌活性是表达谱很广的免疫效应分子。本研究中, 纯化后的法螺G型重组蛋白对革兰氏阳性细菌有较强的抑菌活性, 对革兰氏阴性细菌的抑菌作用较弱, 这可能与不同细菌的细胞壁组成成分有关[19, 40]。革兰氏阳性菌细胞壁组分主要是肽聚糖, 对溶菌酶敏感度高易被水解; 革兰氏阴性菌细胞壁的肽聚糖含量较低, 且位于内层对溶菌酶的敏感度低不易被水解[41-42]。
4 结论
本研究中法螺溶菌酶基因与其他腹足纲双壳软体动物的G型溶菌酶序列同源性最高、结构特征最为相似, 据此判定法螺中溶菌酶基因类型为G型。另外, 成功诱导表达出法螺G型溶菌酶重组蛋白, 纯化后的重组蛋白具有广谱的抑菌活性, 能明显抑制革兰氏阳性细菌和革兰氏阴性细菌的活性。这将为深入研究由细菌感染引起的法螺病害防治及免疫防御机制提供参考依据。
[1] 张洁, 王国栋. 杂色鲍C型溶菌酶基因的克隆及表达分析[J]. 集美大学学报(自然科学版), 2020, 25(5): 328-335.
ZHANG Jie, WANG Guodong. Molecular cloning and expression analysis of c-type lysozyme gene in[J]. Journal of Jimei University (Natural Science), 2020, 25(5): 328-335.
[2] 郑清梅, 吴锐全, 叶星. 水生动物溶菌酶的研究进展[J].上海水产大学学报, 2006(4): 483-487.
ZHENG Qingmei, WU Ruiquan, YE Xing. The research advance of lysozyme in aquatic animals[J]. Journal of Shanghai Fisheries University, 2006(4): 483-487.
[3] 魏世娜, 秦启伟. 鱼类溶菌酶和组织蛋白酶研究进展[J].广西科学, 2018, 25(1): 32-35.
WEI Shina, QIN Qiwei. Adcance on lysozyme and cathepsin of fish[J]. Guangxi Sciences, 2018, 25(1): 32-35.
[4] 宁燕夏, 苏月华, 杨梅. 小菜蛾溶菌酶的基因克隆及其重组蛋白的抗菌活性分析[J]. 昆虫学报, 2021, 64(7): 781-789.
NING Yanxia, SU Yuehua, YANG Mei. cDNA cloning of lysozymeof(:)and the analysis of antibacterial activity of its recombinant protein[J]. Acta entomologica sinica, 2021, 64(7): 781-789.
[5] 颜倩倩, 陶妍, 李雯, 等. 鲤鱼C型溶菌酶在毕赤酵母中的重组表达及其抑菌活性[J]. 农业生物技术学报, 2019, 27(11): 1912-1922.
YAN Qianqian, TAO Yan, LI Wen, et al. Recombinant expression of common carp()c-type lysozyme in pichia pastoris and its antibacterial activity[J]. Journal of Agricultural Biotechnology, 2019, 27(11): 1912-1922.
[6] 邱本丹. 大黄鱼溶菌酶对鳗弧菌胁迫的响应研究[D]. 舟山: 浙江海洋大学, 2016.
QIU Bendan. 2016. The response of c-type and g-type lysozyme in large yellow croaker() to[D]. Zhoushan: Zhejiang Ocean University.
[7] 岳志远, 张仪, 郭云海, 等. 福寿螺感染广州管圆线虫后G型溶菌酶基因差异表达分析[J]. 中国寄生虫学与寄生虫病杂志, 2019, 37(3): 326-331.
YUE Zhiyuan, ZHANG Yi, GUO Yunhai, et al. Effect of angiostrongylus cantonensis infection on the expression of g-type lysozyme in[J]. Chinese Journal Parasitol Parasit Diseases, 2019, 37(3): 326-331.
[8] LABREUCHE Y, LAMBERT C, SOUDANT P, et al. Cellular and molecular hemocyte responses of the Pacific oyster,, following bacterial infection withs strain 01/32[J]. Microbes and Infection, 2006, 8(12/13): 2715-2724.
[9] ZHAO J M, SONG L S, LI C H, et al. Molecular cloning of an invertebrate goose-type lysozyme gene from, and lytic activity of the recombinant protein[J]. Molecular Immunology, 2007, 44(6): 1198- 1208.
[10] 赵建民, 吴惠丰, 王清, 等. 一种紫贻贝G型溶菌酶基因及其重组蛋白和应用: CN201110420479.0[P]. 2013- 06-19.
ZHAO Jianmin, WU Huifeng, WANG Qing, et al. A kind ofg-type lysozyme gene and its recombinant protein and application: CN201110420479.0[P]. 2013-06-19.
[11] HALL M R, KOCOT K M, BAUGHMAN K W, et al. Thegenome as a guide for biocontrol of thispest[J]. Nature, 2017, 544(7649): 231-234.
[12] ZHANG L P, XIA J J, PENG P F, et al. Characterization of embryogenesis and early larval development in the Pacific triton,()[J]. Invertebrate Reproduction & Development, 2013, 57(3): 237-246.
[13] ZHANG G G, XU M, ZHANG C L, et al. Comparative transcriptomic and expression profiles between the foot muscle and mantletissues in the giant triton snail[J]. Frontiers in Physiology, 2021, 12: 632518.
[14] ANTONELLI P L, KAZARINOFF N D. Starfish predation of a growing coral reef community[J]. Journal of Theoretical Biology, 1984, 107(4): 667-684.
[15] BELLWOOD D R, HUGHES T P, FOLKE C. Confronting the coral reef criss[J]. Nature, 2004, 429(6994): 827-833.
[16] 蔡岩, 周永灿, 冯永勤, 等. 法螺()染色体核型分析[J]. 海洋与湖沼, 2014, 45(6): 1324- 1329.
CAI Yan, ZHOU Yongcan, FENG Yongqin, et al. Chromosome karyotype of[J]. Oceanologia et Limnologia Sinica, 2014, 45(6): 1324-1329.
[17] 冯付霭, 赵震, 陶妍, 等. 青蛤I 型溶菌酶在毕赤酵母中的重组DNA表达[J]. 水产科学, 2022, 41(5): 836-843.
FENG Fuai, ZHAO Zhen, TAO Yan, et al. Recombinant DNA Expression of I-type Lysozyme of Clamin Yeast[J]. Fisheries Science, 2022, 41(5): 836-843.
[18] 刘益丽, 邓霄禹, 江明锋. 溶菌酶抑菌活性及检测方法研究进展[J]. 中国畜牧兽医, 2013, 40(8): 189-194.
LIU Yili, DENG Xiaoyu, JIANG Mingfeng. Research progress on function of non-structural proteins of classical swine fever virus[J]. China Animal Husbandry and Veterinary Medicine, 2013, 40(8): 189-194.
[19] 张炜, 杭柏林, 司素锦, 等. 抗菌肽BSN-37的抑菌活性及其稳定性分析[J]. 中国畜牧兽医, 2019, 46(1): 287-295.
ZHANG Wei, HANG Bailin, SI Sujin, et al. Bacteriostatic activity and stability analysis of antimicrobial peptide BSN-37[J]. China Animal Husbandry and Veterinary Medicine, 2019, 46(1): 287-295.
[20] 李勇. 小莱娥抗菌肽moricins基因克的隆及功能鉴定[D].福州: 福建农林大学, 2016.
LI Yong. Cloning and functional identification of moricins from the Diamondback Moth,[D]. Fuzhou: Fujian Agriculture and Forestry University, 2016.
[21] 金虹, 李海帅, 帖金凤, 等. 应用微量稀释法测定消毒剂最小抑菌浓度方法的建立[J]. 中国消毒学杂志, 2018, 35(11): 801-804.
JIN Hong, LI Haishuai, TIE Jinfeng, et al. Establishment of a broth micro dilution MIC testing method for disinfectants[J]. Chinese Journal of Disinfection, 2018, 35(11): 801-804.
[22] 赵荣文, 谭丽萍, 刘同军. 溶菌酶及其应用研究进展[J]. 齐鲁工业大学学报, 2021, 35(1): 12-18.
ZHAO Rongwen, TAN Liping, LIU Tongjun. Research progress of lysozyme and its application[J]. Journal of Qilu University of Technology, 2021, 35(1): 12-18.
[23] SHAKOORI M, HOSEINIFAR S H, PAKNEJAD H, et al. Enrichment of rainbow trout () fingerlings diet with microbial lysozyme: Effects on growth performance, serum and skin mucus immune parameters[J]. Fish & Shellfish Immunology, 2019, 86: 480-485.
[24] 朱站英. 草鱼免疫细胞和免疫相关基因研究: 自然杀伤细胞杀伤活性和溶菌酶mRNA的表达[D]. 上海: 上海海洋大学, 2012.
ZHU Zhanying. Research on immune cells and immune genes of grass carp: Natural killer cell activities and the mRNA expression of lysozyme genes[D]. Shanghai: Shanghai Ocean University, 2012.
[25] 杨勇, 黄贝, 黄文树, 等. 日本鳗鲡的C型和G型溶菌酶研究[J]. 水生生物学报, 2017, 41(4): 807-818.
YANG Yong, HUANG Bei, HUANG Wenshu, et al. Chicken and goose-type lysozyme genes in the japanese eel[J]. Acta Hydrobiologica Sinica, 2017, 41(4): 807-818.
[26] 陈华, 林晨韬, 陈曦, 等. 斑马鱼G型溶菌酶基因序列分析及其原核表达[J]. 南方农业学报, 2022, 53(1): 229-237.
CHEN Hua, LIN Chentao, CHEN Xi, et al. Sequence analysis and prokaryotic expression ofg-type lysozyme gene[J]. Journal of Southern Agriculture, 2022, 53(1): 229-237.
[27] 王美娟, 刘丹丹, 乔丹, 等. 鱼类G型和C型溶菌酶及其在渔业生产上的应用[J]. 水产科学, 2014, 33(3): 195-200.
WANG Meijuan, LIU Dandan, QIAO Dan, et al. The g-type and c-type lysozymes in fish and application in fisheries[J]. Fisheries Science, 2014, 33(3): 195-200.
[28] 章琼, 孙盛明, 李冰, 等. 团头鲂G型溶菌酶基因全长cDNA的克隆与表达分析[J]. 南方水产科学, 2015, 11(2): 41-49.
ZHANG Qiong, SUN Shengming, LI Bing, et al. Molecular cloning and expression analysis of g-type lysozyme gene from blout snout bream()[J]. South China Fisheries Science, 2015, 11(2): 41-49.
[29] HELLAND R, LARSEN R L, FINSTAD S, et al. Crystal structures of g-type lysozyme fromshed new light on substrate binding and the catalytic mechanism[J]. Cellular and Molecular Life Sciences, 2009, 66(15): 2585-2598.
[30] YU L P, SUN B G, LI J, et al. Characterization of a c-type lysozyme of: expression, activity, and antibacterial effect[J]. Fish & Shellfish Immunology, 2013, 34(1): 46-54.
[31] 赵建民. 扇贝大防御素和G型溶菌酶的基因克隆与重组表达[D]. 青岛: 中国科学院研究生院(海洋研究所), 2006.
ZHAO Jianmin. Molecular expression of big defensin and g-type lysozyme genes from, and antimi crobial activity of the recombinant proteins[D]. Qingdao: Graduate University of Chinese Academy of Sciences (Institute of Oceanology), 2006.
[32] ZHANG S C, XU N. Advance in study of animal lysozymes[J]. Periodical of Ocean University of China, 2014, 44(6): 46-51.
[33] SAVAN R, AMAN A, SAKAI M. Molecular cloning of g type lysozyme cdna in common carp ()[J]. Fish & Shellfish Immunology, 2003, 15(3): 263-268.
[34] WHANG I, LEE Y, LEE S, et al. Characterization and expression analysis of a goose-type lysozyme from the rock bream, and antimicrobial activity of its recombinant protein[J]. Fish & Shellfish Immunology, 2011, 30(2): 532-542.
[35] YE X, ZHANG L L, TIAN Y Y, et al. Identification and expression analysis of the g-type and c-type lysozymes in grass carp[J]. Developmental and Comparative Immunology, 2010, 34(5): 501-509.
[36] NILSEN I W, MYRNES B. The gene of, a marine invertebrate-type lysozyme, is organized similar to vertebrate but different from invertebrate chicken- type lysozyme genes[J]. Gene, 2001, 269(1/2): 27-32.
[37] ZHANG H, YI X J, GUAN Y Y, et al. The role of the chondroitin sulfate synthase-1 gene in the immune response of the pearl oyster[J]. Fisheries Science, 2020, 86(3): 487-494.
[38] 王秀霞, 丛丽娜, 王丹, 等. 海刺参I型溶菌酶基因的重组表达及抑菌谱分析[J]. 生物工程学报, 2009, 25(2): 189-194.
WANG Xiuxia, CONG Lina, WANG Dan, et al. Recombinant expression and antibacterial activity of i-type lysozyme from sea cucumber[J]. Chinese Journal of Bioengineering, 2009, 25(2): 189-194.
[39] 徐永平, 汪婷婷, 孙永欣, 等. 水产动物溶菌酶研究的最新进展[J]. 水产科学, 2011, 30(5): 307-310.
XU Yongping, WANG Tingting, SUN Yongxin, et al. Current research on function and application of aquatic animal lysozyme[J]. Fisheries Science, 2011, 30(5): 307-310.
[40] 邓霄禹, 胡明军, 江明锋. 反刍动物胃溶菌酶的研究进展[J]. 中国畜牧兽医, 2012, 39(9): 143-147.
DENG Xiaoyu, HU Mingjun, JIANG Mingfeng. research progress of gastric lysozyme in ruminants[J]. China Animal Husbandry and Veterinary Medicine, 2012, 39(9): 143-147.
[41] CALLEWAERT L, MICHIELS C W. Lysozymes in the animal kingdom[J]. Journal of Biosciences, 2010, 35(1): 127-160.
[42] VOCADLO D J, DAVIES G J, LAINE R, et al. Catalysis by hen egg-white lysozyme proceeds via a covalent intermediate[J]. Nature, 2001, 412(6849): 835-838.
G-type lysozyme prokaryotic expression and antibacterial activity of therecombinant protein
JIA Hui-xia1, 2, ZHANG Hua1, 3, ZHANG Cheng-long4, HE Mao-xian1, 3, LIU Wen-guang1, 3
(1. Key Laboratory of Tropical Marine Biological Resources and Ecology, Chinese Academy of Sciences, Guangdong Key Laboratory of Applied Marine Biology, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou), Guangzhou 511458, China; 4. Sansha Marine and Fisheries Bureau, Sansha 573199, China)
G-type lysozyme (is a natural immune factor with rich cysteine content, which plays an important role in invertebrate immune defense. This study aimed to further understand the molecular immune mechanism ofand to provide new ideas for preventing disease inby studying the antibacterial function of recombinant protein G-type lysozyme in()The sequence characteristics ofwere analyzed, and real-time fluorescent quantitative polymerase chain reaction analysis was used to detect thetissue distribution. Next, the pGEX-4T-1-CtG.lys recombinant plasmid was constructed using the pGEX-4T-1 expression vector to express the recombinant protein and detect its antibacterial activity. The results showed: 1) The 5′ untranslated region (UTR) was 66 bp, the 3′ UTR was 186 bp ofthecDNA; the open reading frame was 789 bp and encoded 262 amino acids;contained one soluble transglycosidase (SLT) domain (72–255 aa), six cysteine residues, and three enzyme active catalytic sites (Glu72, Asp85, and Asp96); 2) multiple sequence alignment and phylogenetic analyses showed that theamino acids had the highest homology with a closely related G-type lysozyme; 3)was expressed in all tissues tested and was highly expressed in the liver and mantle; 4) after 10 hours of induced expression with 0.5 mM IPTG at 16℃, the average molecular weight of the recombinant protein expressed in the supernatant and inclusion bodies was 51.91 kDa. A1.2 mg/mL recombinant protein concentration was obtained after purification; 5) the antibacterial activity test showed that the pGEX-4T-1-CtG.lys recombinant protein hadantibacterial activities against,, and, and the bacteriostatic effect on the Gram-positive bacteria was greater than that of Gram-negative bacteria. The results of the study will provide a reference and a scientific basis for further analysis of the molecular mechanism of immune defense in.
; G-type lysozyme; prokaryotic expression; antibacterial activity
Sep. 26, 2021
S968
A
1000-3096(2022)10-0032-11
10.11759/hykx20210926001
2021-09-26;
2021-11-22
国家自然科学基金项目(42176129); 中国科学院战略性先导研究项目(XDA13020206); 南方海洋科学与工程广东省实验室(广州)人才团队引进重大专项(GML2019ZD0402)
[National Natural Science Foundation of China, No. 42176129; Strategic Priority Research Program of the Chinese Academy of Sciences, No. XDA13020206; Key Special Project for Introduced Talents Team of Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou), No. GML2019ZD0402]
贾慧霞(1994—), 女, 河南省开封市人, 硕士研究生, 主要从事贝类遗传与育种, E-mail: jiahuixia19@mails.ucas.ac.cn; 刘文广(1978—),通信作者, 副研究员, 硕士生导师, 研究方向为贝类遗传与育种, 电话: 020-89023144, E-mail: lwg@scsio.ac.cn
(本文编辑: 杨 悦)

