腺苷预处理对大鼠脑组织缺血再灌注损伤的干预作用及其机制
栗延伟,曹武璟,季禾,谭军
1新乡医学院第三附属医院神经内科,河南新乡 453003;2河南师范大学生命科学学院
脑缺血再灌注(I/R)是指脑血管被阻塞后,脑组织处于持续缺血状态,当血流重新灌注后,会对缺血半暗带区域的神经元细胞造成进一步损伤,引发多种病理过程,最终发生细胞凋亡[1]。腺苷能够减轻脑缺血再灌注损伤(CIRI)[2-4],从而发挥脑保护作用,但具体机制仍未明确[5-6]。根据文献资料,我们考虑腺苷可能通过调控相关miRNA抑制神经元细胞凋亡[7-9]。已有研究表明,脑组织中miRNA-125b表达量较高,与多种疾病过程中的细胞凋亡有关[10-11]。2021年1月—2022年5月,我们观察了腺苷对大鼠CIRI的干预作用,并通过miRNA-125b及其下游因子B细胞淋巴瘤2(Bcl-2)、磷酸化蛋白激酶B(p-AKT)、抑癌基因p53蛋白等探讨相关机制,现报告如下。
1 材料与方法
1.1 实验动物与主要材料从新乡医学院动物中心随机选取180只体质量250~280 g的健康成年雄性SD级大鼠,动物合格证号为SCXK(鲁)20190003。大脑中动脉栓塞模型尼龙栓线购自北京CINONTECH有限公司,miRNA-125b、U6引物购自美国Invitrogen公司,腺苷、TTC试剂购自美国Sigma公司,Bcl-2、p-AKT、AKT、p53单克隆抗体购自北京Abcam公司。RNAiso for Small RNA、cDNA逆转录试剂盒、Mir-X miRNA First-Strand Synthesis逆转录试剂盒、TB Green qRT-PCR试剂盒购自TaKaRa公司,qRTPCR仪、电泳仪和转膜仪购自美国Bio-Rad公司。
1.2 动物分组及处理方法180只大鼠随机分为假手术组、模型组、实验组,每组60只。实验组大鼠造模前3 d腹腔注射腺苷注射液,每次2 mL、每天1次;假手术组和模型组大鼠于同时点腹腔注射生理盐水2 mL。模型组和实验组采用改良线栓法制备大脑中动脉栓塞模型:以10%水合氯醛溶液3 mL/kg腹腔注射麻醉,切开皮肤及皮下组织,分离左侧颈总动脉、左侧颈外动脉和左侧颈内动脉,从颈总动脉插入栓线,经颈内动脉到大脑前动脉,机械性阻断大脑中动脉发出处的血供;栓线插入后开始计时,2 h后依据5分制神经行为学评分标准进行神经功能缺损症状评分,将评分为1~3分的大鼠纳入后续实验,剔除0分或4分的大鼠;轻轻向外拔栓线约1 cm恢复血供。假手术组仅分离大脑中动脉,不进行阻断血供操作。如有大鼠剔除,按照先前的饲养条件、实验方法进行补充。
1.3 脑梗死体积占比测算术后24 h各组随机选取10只大鼠,麻醉后断头取脑,立即以冰生理盐水冲洗,放入冰箱速冻20 min。从额极开始,将整个大脑切成厚度约2 mm的冠状切片,共5片,放入2%的TTC溶液中37℃孵育30 min,多次翻动。正常脑组织会被TTC染成红色,梗死脑组织因无法与TTC发生反应而呈现白色。用1×PBS溶液洗去浮色,拍照观察并计算各组脑梗死体积占比。
1.4 海马组织病理观察术后24 h各组随机选取10只大鼠,麻醉,撕去心包进行心脏灌流固定,取出脑组织并用细胞固定液固定2 d,石蜡包埋,在海马平面作冠状连续切片,厚度4μm;经脱蜡、下行梯度(100%、95%、85%、75%)乙醇水化后,加入苏木精染色10 min,水洗后再经1%盐酸乙醇浸洗33 s,水洗后加入碳酸锂水溶液10 s,入伊红液染色3 min;水洗,用上行梯度(75%、85%、95%、100%)乙醇脱水、二甲苯透明,以中性树胶封片。显微镜下观察大鼠海马组织病理学变化。
1.5 病灶脑组织中miRNA-125b检测各组分别于术后2、6、24、48 h各取5只大鼠断头取脑,取相同位置病灶脑组织,用广谱型miRNA提取试剂提取病灶脑组织中的总miRNA,将miRNA逆转录成cDNA。采用qRT-PCR法检测miRNA-125b,以U6为内参。miRNA-125b mimics序列为UCCCUGAGACCCUAACUUGUG,U6上游引物序列为5'-GCTTCGGCAGCACATATACTAAAAT-3',下游引物序列为5'-CGCTTCACGAATTTGCGTGTCAT-3'。PCR反应条件:95℃预变性30 s;95℃变性5 s;60℃变性20 s,62℃退火10 s,72℃延伸30 s,共40个循环。扩增完后进行熔解曲线分析,每个样本重复3次。以2-ΔΔCt表示miRNA-125b相对表达量。
1.6 病灶脑组织中Bcl-2、p53、p-AKT蛋白检测各组分别于术后2、6、24、48 h各取5只大鼠断头取脑,取病灶脑组织,充分研磨。加入蛋白裂解液,于冰上反应30 min,采用BCA试剂盒测定蛋白浓度。制备5%分离胶、10%浓缩胶进行电泳,电泳开始时设置电压80 V,进入分离胶后调整为120 V。260 mA下转移蛋白凝胶至PVDF膜上,时间90 min。TBST溶液清洗后,加入5%脱脂牛奶,室温下封闭1 h,TBST溶液清洗PVDF膜。加一抗4℃孵育过夜,GAPDH(1∶5 000)、AKT(1∶1 000)、Bcl-2(1∶1 000)、p-AKT(1∶1 000),加二抗室温孵育2 h,TBST溶液洗膜3次,化学发光试剂曝光。以GAPDH为内参。采用Bio-Rad凝胶成像系统扫描,Image J软件定量分析蛋白条带灰度值。
1.7 统计学方法采用Graph Pad Prism8.0.2统计软件。计量资料用±s表示,多组间比较采用单因素方差分析,两两比较采用Bonferroni's法;重复测量的计量资料比较采用重复测量的方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠脑梗死体积占比比较假手术组、模型组、实验组脑梗死体积占比分别为0、35.1%±4.0%、27.2%±5.0%。模型组、实验组脑梗死体积占比高于假手术组,实验组低于模型组(P均<0.05)。
2.2 各组大鼠海马组织病理变化假手术组海马神经元胞体形态结构正常;模型组大鼠海马神经元细胞排列紊乱,数目明显减少,结构疏松,细胞变小,细胞核溶解,出现空泡,膜完整性破坏,细胞形态呈三角形或梭形,水肿明显;实验组神经元病理改变较模型组明显减轻,大部分细胞存活,细胞膜完整,细胞核及核仁较为完整清晰。见OSID码图1。
2.3 各组大鼠病灶脑组织miRNA-125b表达比较模型组和实验组术后2、6、24、48 h的miRNA-125b表达高于假手术组,实验组术后各时点miRNA-125b表达高于模型组(P均<0.05)。模型组和实验组大鼠术后脑组织miRNA-125b表达逐渐增高,模型组、实验组分别于术后24、6 h达峰值,后逐渐下降(P均<0.05)。见表1。
表1 各组大鼠术后不同时点病灶脑组织miRNA-125b表达比较(±s)
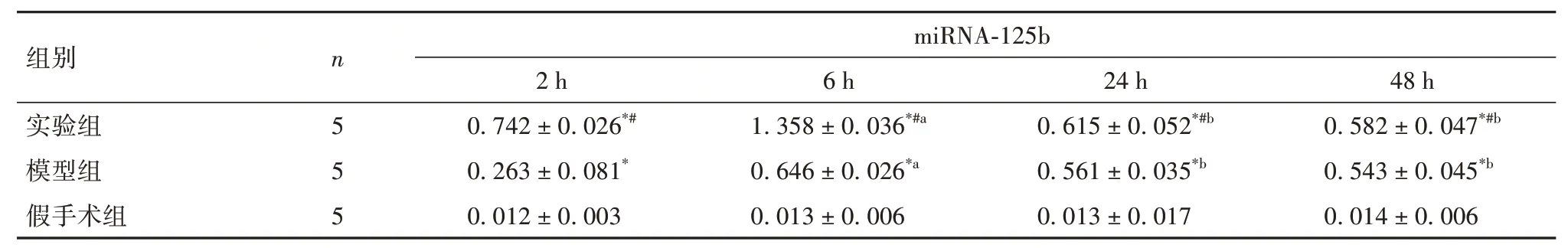
表1 各组大鼠术后不同时点病灶脑组织miRNA-125b表达比较(±s)
注:与假手术组相比,*P<0.05;与模型组相比,#P<0.05;与同组术后2 h相比,aP<0.05;与同组术后6 h相比,bP<0.05。
组别实验组模型组假手术组n 5 5 5 miRNA-125b 2 h 0.742±0.026*#0.263±0.081*0.012±0.003 6 h 1.358±0.036*#a 0.646±0.026*a 0.013±0.006 24 h 0.615±0.052*#b 0.561±0.035*b 0.013±0.017 48 h 0.582±0.047*#b 0.543±0.045*b 0.014±0.006
2.4 各组大鼠病灶脑组织Bcl-2、p53、p-AKT蛋白表达比较详见表2。
表2 各组大鼠术后不同时点病灶脑组织Bcl-2、p53、p-AKT蛋白表达比较(±s)

表2 各组大鼠术后不同时点病灶脑组织Bcl-2、p53、p-AKT蛋白表达比较(±s)
注:与同时点假手术组相比,*P<0.05;与同时点模型组相比,#P<0.05。
组别实验组2 h 6 h 24 h 48 h模型组2 h 6 h 24 h 48 h假手术组2 h 6 h 24 h 48 h n 5 5 5 5 5 5 5 5 5 5 5 5 Bcl-2蛋白0.25±0.05*#0.46±0.08*#0.99±0.03*#0.64±0.07*#0.19±0.04*0.37±0.05*0.64±0.06 0.53±0.03 0.17±0.05 0.16±0.03 0.17±0.05 0.18±0.08 p53蛋白1.40±0.05#1.95±0.03*#2.04±0.05*#1.63±0.03*#0.80±0.03*1.12±0.09 0.94±0.06 0.88±0.06 0.53±0.03 0.61±0.05 0.63±0.04 0.70±0.05 p-AKT蛋白0.74±0.05*#0.96±0.06*#1.70±0.03*#0.99±0.05*#0.63±0.06*0.73±0.05*1.43±0.08*0.80±0.04 0.52±0.05 0.50±0.09 0.63±0.04 0.59±0.09
3 讨论
缺血性脑梗死发病趋于年轻化,再灌注治疗仍然是临床上治疗缺血性脑梗死的主要措施[12],但脑组织血供恢复会引发一系列复杂的病理过程,导致迟发性神经元凋亡,扩大脑梗死面积。在CIRI临床防治工作中,学者们提出脑缺血预处理的治疗理念:经历短暂脑缺血状态,诱导脑组织产生多种内源性保护机制[14],从而提高脑组织对缺血的适应能力[15]。但短暂性缺血预处理在临床实践中是不实际的,也不易被患者接受。本研究采用的腺苷预处理已被证实能够从降低细胞代谢、扩张脑部血管[16]、抑制血小板聚集等途径来减轻CIRI,但其机制复杂,有待进一步探索[17-18]。
本研究结果显示,模型组和实验组大鼠均出现了神经功能缺损症状,行为学评分及脑梗死面积显著高于假手术组,实验组神经功能症状及脑梗死情况较模型组得到改善。脑组织病理检查结果显示,模型组大鼠出现严重的脑神经元破坏,而腺苷预处理后大鼠脑损伤显著减轻,与文献报道一致。
miRNA通过与mRNA的3'-UTR结合,降解或下调靶mRNA表达,由此激活或抑制多种下游靶蛋白,从而调控细胞死亡过程,影响CIRI。研究发现,miRNA参与大脑多种生理和病理过程,在精神疾病和神经系统退行性疾病的发病中发挥重要作用,而通过补充外源性miRNA可以达到治疗疾病的效果[19-20]。研究显示,急性心肌梗死早期患者血浆miRNA-125b相对表达量迅速上升。然而,针对miRNA-125b与CIRI之间的关系研究较少。本研究检测了脑I/R后2、6、24、48 h大鼠海马组织miRNA-125b相对表达量,结果显示,假手术组miRNA-125b相对表达量在术后各时点差异无统计学意义,说明正常脑组织中miRNA-125b表达量较低,并且维持在相对稳定的水平;模型组和实验组术后各时点miRNA-125b表达均高于假手术组,峰值分别在术后24、6 h出现,这表明正常脑细胞发生CIRI时,会迅速引起miRNA-125b表达增加;实验组术后各时点miRNA-125b表达高于模型组,提示腺苷可能促使miRNA-125b表达迅速增高而发挥脑保护作用。
AKT具有CIRI后抗神经细胞凋亡的作用,当细胞受到损伤刺激后被激活,AKT磷酸化形成p-AKT并传递信号。Bcl-2是内源性神经保护因子,其作为AKT信号通路下游的关键物质,与CIRI后神经元的存活有关。p53蛋白具有抗凋亡作用,可促进细胞存活。本研究结果显示,模型组和实验组术后大鼠脑组织抗凋亡蛋白Bcl-2、p53表达增高,并于术后24 h达峰值,实验组术后各时点Bcl-2、p53蛋白表达均高于模型组,与miRNA-125b表达趋势一致;实验组促凋亡蛋白p-AKT表达低于模型组,提示当脑细胞发生CIRI时,细胞内Bcl-2、p53蛋白表达增加,参与抗凋亡过程;而I/R本身会引起促凋亡蛋白p-AKT表达增高。上述研究结果提示,miRNA-125b可能通过降低脑细胞内AKT磷酸化水平,促进Bcl-2、p53蛋白表达,从而发挥CIRI后抗细胞凋亡的作用。
综上所述,腺苷预处理对CIRI具有脑保护作用,可能因为腺苷在CIRI早期能够促进miRNA-125b表达,抑制AKT磷酸化水平,上调抗凋亡蛋白p53和Bcl-2表达,从而抑制细胞凋亡。本研究从基因组学层面上解释了CIRI潜在的发病机制及腺苷的保护作用机制。后续实验中,还可采用基因敲除动物及miRNA-125b激动剂和抑制剂进行更深入的研究。

