肝硬化患者血清胃蛋白酶原及胃泌素-17水平与病情程度的关系
孙雪飞,何 旭,李绍雪,张 超
肝硬化是由慢性肝病发展而来的弥漫性肝损伤,其早期往往无特异性表现[1]。但随着肝硬化病情进展,患者门静脉压力明显上升,使得门静脉血液逆向进入侧支循环,一旦到达食管胃底静脉丛,将诱发食管胃底静脉曲张,最终引起大出血[2]。肝硬化合并上消化道出血可导致胃肠黏膜受损,进而引起胃肠激素失衡[3]。血清胃蛋白酶原Ⅰ(PGⅠ)、胃蛋白酶原Ⅱ(PGⅡ)及胃泌素-17(G-17)水平可一定程度反映胃肠黏膜的功能状态,其水平越高,提示患者胃肠黏膜损伤越严重[4]。李欢等[5]报道表明,肝硬化合并胃溃疡患者血清胃泌素水平及分期与疼痛程度密切相关,胃泌素水平可能用于判断肝硬化合并胃溃疡病情程度的指标。本研究拟以肝硬化80例为研究对象,分析肝硬化患者血清PGⅠ、PGⅡ及G-17水平与病情程度的关系,旨在为临床诊疗提供依据。
1 资料与方法
1.1一般资料 将2017年12月—2021年7月医院收治的80例肝硬化患者设为肝硬化组。纳入标准:符合肝硬化的诊断标准[6];经临床、实验室检查以及影像学检查等确诊;患者知情。排除标准:合并心、肾功能不全者;合并恶性肿瘤者。肝硬化Child-pugh分级:A级为5~6分,B级为7~9分,C级为10~15分。根据Child-pugh分级将患者分为A组(Child-pugh分级A级,n=23)、B组(Child-pugh分级B级,n=33)和C组(Child-pugh分级C级,n=24)。肝硬化组男56例,女24例;年龄40~82(61.49±9.88)岁;乙型肝炎后肝硬化38例,酒精性肝硬化22例,丙型肝炎后肝硬化3例,原发性胆汁性肝硬化7例,不明原因肝硬化10例。将本院同期体检健康者80例设为对照组,男53例,女27例;年龄41~85(62.63±10.25)岁。2组性别、年龄等方面比较差异均无统计学意义(P>0.05),具有可比性。本研究获得医院医学伦理委员会批准。
1.2方法 采集2组研究对象晨起空腹静脉血3 ml,12 000 r/min条件下离心3 min,取血清,备用。采用ELISA检测血清PGⅠ、PGⅡ及G-17水平,检测试剂盒由芬兰必欧瀚生物科技股份有限公司提供,检测仪器为普朗医疗提供的DNM-9606酶标分析仪,各项操作均严格根据说明书执行。另外,采用B超检测肝硬化组门静脉主干内径值,并分为门静脉主干内径≤13 mm组(n=29)和门静脉主干内径>13 mm组(n=51)。
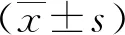
2 结果
2.1肝硬化组和对照组血清PGⅠ、PGⅡ及G-17水平比较 肝硬化组血清PGⅠ、PGⅡ及G-17水平均高于对照组(P<0.01)。见表1。
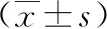
表1 肝硬化组和对照组血清PGⅠ、PGⅡ及G-17水平比较
2.2肝硬化组不同Child-pugh分级患者血清PGⅠ、PGⅡ及G-17水平比较 B组和C组血清PGⅠ、PGⅡ及G-17水平高于A组,且C组高于B组(P<0.01)。见表2。
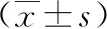
表2 不同Child-pugh分级肝硬化患者血清PGⅠ、PGⅡ及G-17水平比较
2.3肝硬化组不同门静脉主干内径患者血清PGⅠ、PGⅡ及G-17水平比较 门静脉主干内径>13 mm组血清PGⅠ、PGⅡ及G-17水平高于门静脉主干内径≤13 mm组(P<0.01)。见表3。
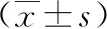
表3 不同门静脉主干内径肝硬化患者血清PGⅠ、PGⅡ及G-17水平比较
2.4血清PGⅠ、PGⅡ及G-17水平与Child-pugh分级、门静脉主干内径的相关性 Spearman相关性分析结果显示,血清PGⅠ、PGⅡ及G-17水平与肝硬化患者Child-pugh分级、门静脉主干内径均呈正相关(P<0.01)。见表4。
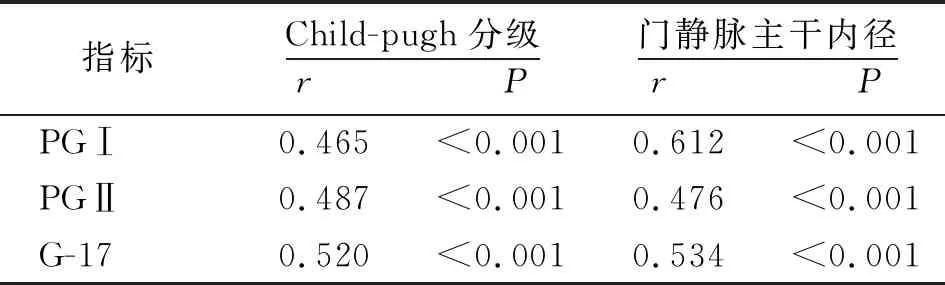
表4 血清PGⅠ、PGⅡ及G-17水平与肝硬化患者Child-pugh分级、门静脉主干内径的相关性
3 讨论
肝硬化患者早期症状并不明显,但进展至晚期可见门静脉高压、肝衰竭等并发症,甚至对患者生命安全造成威胁[7-8]。既往报道表明,门静脉高压是引起肝硬化患者合并上消化道出血的危险因素[9]。肝硬化合并上消化道出血极易造成患者胃肠黏膜损伤,进而影响胃肠黏膜功能,造成胃肠激素代谢紊乱[10]。韩利畴等[11]报道亦表明,肝硬化患者胃肠黏膜发生了明显的病理学变化,且极易发生慢性萎缩性胃炎。因此,评估肝硬化患者胃肠激素水平变化可能有助于判断其病情程度,对于积极防治肝硬化的进展至关重要。
血清PGⅠ、PGⅡ水平能够反映胃肠黏膜功能,临床常用于评估患者胃肠黏膜损伤情况[12-14],且血清学检测具有无创、便捷、高效等优点[15]。PGⅠ主要由胃底腺主细胞及颈黏液细胞分泌,胃酸分泌增多及存在炎症时,PGⅠ水平上升[16]。PGⅡ来源较多,除了由以上两种细胞分泌之外,还可由十二指肠腺以及幽门、贲门等部位细胞分泌,PGⅡ水平升高与胃黏膜病变密切相关[17]。G-17由胃窦G细胞分泌,肝脏与肾脏为主要代谢器官,G-17水平升高可刺激胃酸分泌,导致上腹部不适等[18]。此外,研究认为,G-17水平与慢性肝病患者胃黏膜病变存在关联[19]。本研究结果显示,肝硬化组血清PGⅠ、PGⅡ及G-17水平高于对照组,提示肝硬化患者血清PGⅠ、PGⅡ及G-17水平可能反映其消化系统功能状态,并与患者肝功能受损相关。本研究结果显示,C组血清PGⅠ、PGⅡ及G-17水平高于A组和B组,且B组高于A组,与丁平等[20]研究结果相符。同时,本研究结果还显示,门静脉主干内径>13 mm组血清PGⅠ、PGⅡ及G-17水平高于门静脉主干内径≤13 mm组,提示肝硬化患者血清PGⅠ、PGⅡ及G-17水平与门静脉主干内径相关。进一步行Spearman相关性分析结果显示,血清PGⅠ、PGⅡ及G-17水平与肝硬化患者Child-pugh分级、门静脉主干内径均呈正相关,表明PGⅠ、PGⅡ及G-17可能参与肝硬化患者门静脉高压的形成,导致患者出现肝功能障碍。血清PGⅠ、PGⅡ及G-17水平升高,提示患者胃肠黏膜病变加重,门静脉压力升高,继而反映肝硬化患者病情程度加重[21]。分析原因:①PGⅠ、PGⅡ及G-17主要由肝脏进行代谢,一旦肝脏功能受损,导致其代谢减少,使得血清PGⅠ、PGⅡ及G-17水平上升;②门体分流使得PGⅠ、PGⅡ及G-17不通过肝脏,而是直接进入血液中;③肝硬化患者出现门静脉高压,会使其出现消化道出血,造成胃肠黏膜损伤,进而削弱壁细胞功能,致PGⅠ、PGⅡ降解减少,同时促进G-17释放,使得血清PGⅠ、PGⅡ及G-17水平上升;④肝硬化患者肾血流量减少,肾小球滤过率降低,从而影响肾脏中PGⅠ、PGⅡ及G-17代谢,导致血清PGⅠ、PGⅡ及G-17水平上升。通过检测肝硬化患者血清PGⅠ、PGⅡ及G-17水平,并结合患者症状,提示对出现消化道症状的患者不仅需要保护其肝功能,还需要给予降低门静脉压力、保护胃肠黏膜等综合治疗。但本研究仍存在不足之处,研究中并未对不同病因的肝硬化患者血清PGⅠ、PGⅡ及G-17水平进行分析,此外,病毒感染对血清PGⅠ、PGⅡ及G-17水平的影响亦未纳入分析,后续有待开展深入探究。
综上所述,肝硬化患者血清PGⅠ、PGⅡ及G-17水平明显上升,并与病情程度密切相关,能够为临床治疗提供依据,还可为深入探索肝硬化合并消化系统障碍的发病机制及治疗方案提供指导。

