免疫抑制剂环磷酰胺对小鼠流感相关性脑病的影响*
张香港,赵澄,陈纯静,胡珏,卢芳国
(湖南中医药大学,湖南 长沙 410208)
流感相关性脑炎/脑病(influenza-associated encephalitis/encephalopathy)是急性流感过程中伴随中枢神经系统功能障碍的一种临床综合征。流行病学调查表明,老人、儿童、孕妇以及免疫缺陷人群由于体质特殊,感染流感之后出现的症状也有其特殊性,患中枢神经系统并发症的风险较高[1]。流感相关性脑病模型的建立是其防治研究的基础。环磷酰胺是一种活性烷基化剂,具有免疫抑制作用,可抑制体液免疫和细胞免疫,导致机体整体免疫功能障碍,常用于建立免疫抑制动物模型[2]。有研究表明小鼠经环磷酰胺腹腔注射后,细胞免疫受抑制,中枢神经系统对病毒的易感性增加[3]。基于以上背景,本研究观察免疫抑制剂环磷酰胺对小鼠流感相关性脑病的影响,旨在为流感相关性脑病模型建立提供参考,以期为流感相关性脑病防治研究奠定基础。
材料和方法
1 材料
1.1 动物SPF级BLAB/c小鼠80只,体质量(18±2)g,雌雄各半,购自湖南斯莱克景达实验动物有限公司,动物生产许可证号为SCXK(湘)2019-0004,实验单位使用许可证编号为SYXK(湘)2019-0009。实验过程中对小鼠的处理措施已通过湖南中医药大学实验中心动物伦理委员会审查。
1.2 病毒株A型流感病毒(A/PR/8/34)小鼠肺适应株由湖南师范大学病毒研究室提供,-80℃保存于湖南中医药大学病原微生物实验室。经10 d龄鸡胚尿囊腔培养传代,用于本实验血凝效价为1∶640。
1.3 主要试剂注射用环磷酰胺(百特国际有限公司);白细胞介素6(interleukin 6,IL-6)抗体(R&D);肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)抗体(ABclonal);闭锁小带蛋白1(zonula occluden-1,ZO-1)抗体(Abcam);山羊抗兔Ⅱ抗(Proteintech);IL-6 ELISA试剂盒和TNF-αELISA试剂盒(上海酶联生物公司)。
2 主要方法
2.1 动物模型制备小鼠随机分为正常对照组、环磷酰胺组、病毒组、环磷酰胺+病毒组,每组20只。环磷酰胺组、环磷酰胺+病毒组小鼠按照75 mg/kg的剂量腹腔注射环磷酰胺1次,其余各组小鼠同步注射相同体积0.9%生理盐水;末次注射后24 h,病毒组、环磷酰胺+病毒组小鼠经鼻腔接种稀释度为1∶100的流感病毒液0.05 mL建立流感病毒感染模型,其余各组小鼠同步鼻腔接种0.9%生理盐水0.05 mL。观察并记录小鼠每日体质量。分别在小鼠感染流感病毒后的第3、7天每组随机选取10只小鼠(雌雄各半),采集标本。
2.2 肺、脑指数测量常规称量记录小鼠体质量及肺、脑重量,计算肺、脑指数。肺指数(%)=肺组织质量(g)/体质量(g)×100%,脑指数(%)=脑组织质量(g)/体质量(g)×100%。
2.3 HE染色法观察脑组织病理学改变各组小鼠脑组织以4%多聚甲醛固定1周后,经脱水包埋、切片、脱蜡、染色、透明、封片,于光学显微镜下观察病理学变化。
2.4 各组小鼠肺组织、脑组织流感病毒载量水平检测分别称取小鼠肺、脑组织50 mg按试剂盒说明书提取总RNA,以β-actin为内参照,采用RT-qPCR进行流感病毒核蛋白(nucleoprotein,NP)产物扩增和结果分析。NP上游引物序列为5"-CCTGTGTGTATGGACCTGCC-3",下游引物序列为:5"-CTCTTGGGACCACCTTCGTC-3";β-actin上游引物序列为5"-ACATCCGTAAAGACCTCTATGCC-3",下游引物序列为5"-TACTCCTGCTTGCTGATCCAC-3"。
2.5 ELISA法检测脑组织匀浆中IL-6和TNF-α的含量称取100 mg脑组织,加入900 uL的已加入PMSF(1∶100)的PBS研磨成匀浆,离心后取上清液,按ELISA试剂盒说明书进行检测,测得吸光度值后通过标准曲线计算样本浓度。
2.6 免疫组化法检测脑组织中IL-6、TNF-α和ZO-1的表达脑组织经固定、脱水、包埋、切片、脱蜡后采用PV-9000通用二步法检测其蛋白表达水平,光学显微镜下观察阳性表达。每张样本切片随机选取5个视野,用Image-Pro Plus 5.0软件计算视野的平均光密度值,作为该样本的相对表达量。
3 统计学处理
实验数据使用SPSS 25.0处理分析。数据采用均数±标准差(mean±SD)表示,正态分布资料多组间比较使用单因素方差分析,两两比较使用LSD检验(方差齐)或Games-Howell检验(方差不齐);非正态分布资料采用Kruskal-Wallis秩和检验。以P<0.05为差异有统计学意义。
结 果
1 各组小鼠肺、脑指数及肺、脑组织病毒载量水平比较
感染后第3、7天,与正常对照组比较,病毒组小鼠肺指数显著增加(P<0.05),环磷酰胺+病毒组小鼠肺、脑指数显著增加(P<0.01);与病毒组比较,环磷酰胺+病毒组小鼠肺指数显著增加(P<0.05)。感染后3天,环磷酰胺+病毒组小鼠脑指数较病毒组显著增加(P<0.01),见图1A。
感染后第3、7天,病毒组、环磷酰胺+病毒组小鼠肺组织中H1N1流感病毒NP基因相对表达量较正常对照组小鼠显著增高(P<0.01)。与病毒组比较,感染后7天的环磷酰胺+病毒组小鼠肺组织中H1N1流感病毒NP基因相对表达量较病毒组显著增高(P<0.01)。各组小鼠脑组织中未检出H1N1流感病毒NP基因表达,见图1B。
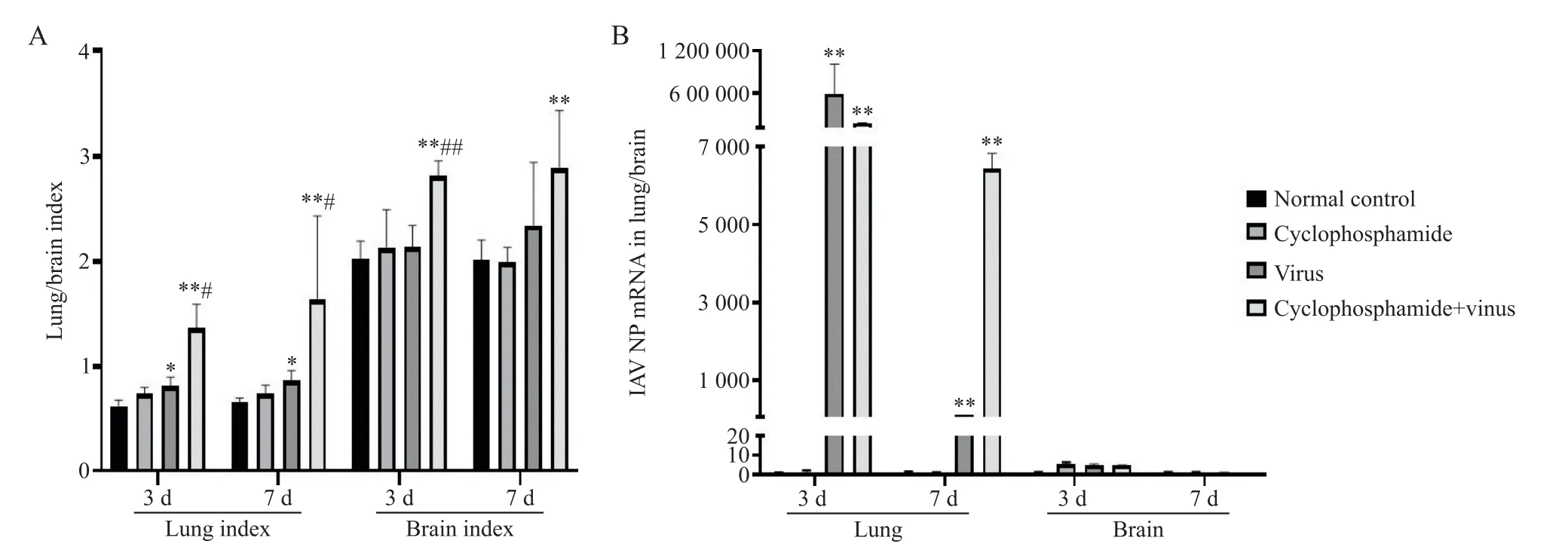
Figure 1.Comparison of lung/brain index and viral load in lung/brain tissues of mice in each group.A:lung/brain index(n=8);B:viral load in lung/brain tissues(n=3).Mean±SD.*P<0.05,**P<0.01 vs normal control group;#P<0.05,##P<0.01 vs virus group.图1 各组小鼠肺、脑指数及肺、脑组织病毒载量比较
2 各组小鼠脑组织病理变化
正常对照组和环磷酰胺组小鼠海马和皮质细胞形态、排列正常;感染病毒后3 d,病毒组小鼠海马细胞形态、排列正常,皮质水肿;环磷酰胺+病毒组海马大量神经细胞固缩坏死,皮质水肿;感染病毒后7 d,病毒组小鼠皮质水肿消失,环磷酰胺+病毒组小鼠仍见海马大量神经细胞固缩坏死,皮质水肿。见图2。
3 各组小鼠脑组织匀浆中IL-6和TNF-α含量水平比较
感染后3 d,病毒组小鼠脑组织匀浆中IL-6含量水平较正常对照组显著升高(P<0.05);环磷酰胺+病毒组小鼠脑组织匀浆中IL-6含量水平较正常对照组显著升高(P<0.05),TNF-α含量水平较正常对照组及病毒组显著升高(P<0.01)。感染后7 d,环磷酰胺+病毒组小鼠脑组织匀浆中IL-6和TNF-α含量水平较正常对照组及病毒组显著升高(P<0.05)。见表1。

表1 各组小鼠脑组织匀浆中IL-6、TNF-α含量水平Table 1.Levels of IL-6 and TNF-αin brain tissue homogenates(ng/g.Mean±SD.n=3)
4 各组小鼠脑组织中IL-6、TNF-α和ZO-1蛋白表达水平的比较
4.1 各组小鼠脑组织中IL-6蛋白表达水平的比较感染后3 d,与正常对照组比较,环磷酰胺+病毒组小鼠海马和皮质中IL-6蛋白表达水平均显著升高(P<0.05);与环磷酰胺组比较,环磷酰胺+病毒组小鼠皮质中IL-6蛋白表达水平显著升高(P<0.01)。感染后7 d,病毒组小鼠海马中IL-6蛋白表达水平较正常对照组及环磷酰胺组显著升高(P<0.01);环磷酰胺+病毒组小鼠海马和皮质中IL-6蛋白表达水平较正常对照组和病毒组均显著升高(P<0.01)。见图3。

Figure 2.Pathological changes of brain tissue of mice in each group(HE staining,×200).The red arrow in the figure indicates necrotic pyknosis nerve cells,and the blue arrow indicates edema.图2 各组小鼠脑组织病理变化
4.2 各组小鼠脑组织中TNF-α蛋白表达水平比较感染后3、7 d,环磷酰胺+病毒组小鼠海马和皮质中TNF-α蛋白表达水平较正常对照组、环磷酰胺组及病毒组显著升高(P<0.05)。见图4。
4.3 各组小鼠脑组织中ZO-1蛋白表达水平比较感染后3、7 d,病毒组、环磷酰胺+病毒组小鼠海马及皮质中ZO-1蛋白表达水平较正常对照组及环磷酰胺组显著降低(P<0.05)。环磷酰胺+病毒组小鼠感染后3 d的海马、感染后7 d的皮质中ZO-1蛋白表达水平较病毒组显著降低(P<0.05)。见图5。

Figure 3.IL-6 protein expression in brain tissue of mice in each group(IHC,×400).Mean±SD.n=3.*P<0.05,**P<0.01 vs normal control group;△△P<0.01 vs cyclophosphamide group;##P<0.01 vs cyclophosphamide+virus group.图3 各组小鼠脑组织中IL-6蛋白表达
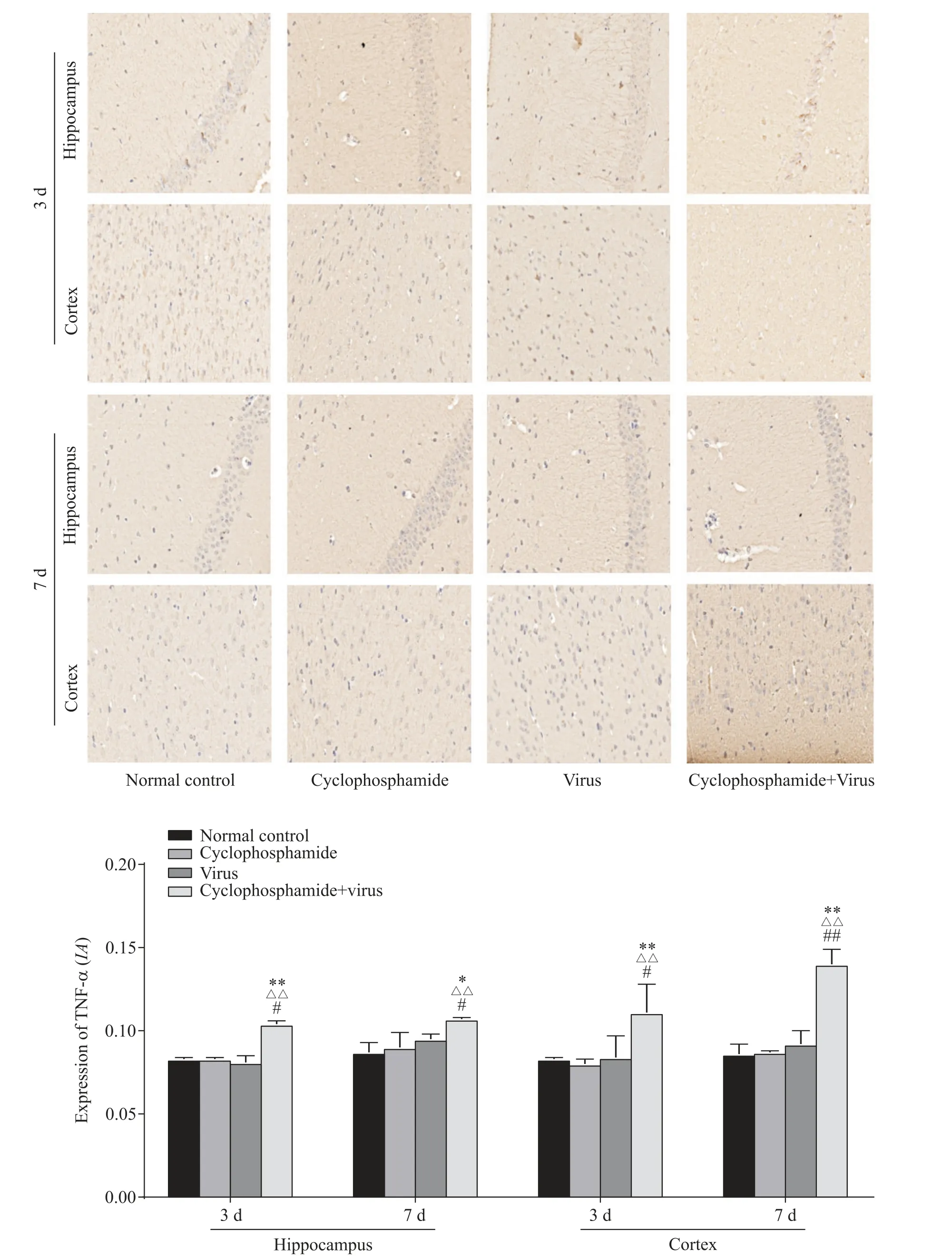
Figure 4.TNF-αprotein expression in brain tissue of mice in each group(IHC,×400).Mean±SD.n=3.*P<0.05,**P<0.01 vs normal control group;△△P<0.01 vs cyclophosphamide group;#P<0.05,##P<0.01 vs cyclophosphamide+virus group.图4 各组小鼠脑组织中TNF-α蛋白表达

Figure 5.ZO-1 protein expression in brain tissue of mice in each group(IHC,×400).Mean±SD.n=3.*P<0.05,**P<0.01 vs normal control group;△P<0.05,△△P<0.01 vs cyclophosphamide group;#P<0.05,##P<0.01 vs cyclophosphamide+virus group.图5 各组小鼠脑组织中ZO-1蛋白表达
讨 论
本研究在腹腔注射环磷酰胺(75 mg/kg,1次)后24 h,经鼻腔接种流感病毒液所建立的流感病毒感染模型小鼠肺指数显著增加,感染后7 d小鼠肺组织中病毒载量水平显著高于病毒组,说明感染流感病毒后,免疫抑制小鼠肺部损伤较正常小鼠严重,病程延长;小鼠脑指数显著增加,脑组织除出现皮质水肿外,海马组织也出现大量神经细胞固缩坏死,且感染后皮质水肿无自愈倾向,表明环磷酰胺的应用有利于小鼠流感相关性脑病的发生。
多项研究[4-9]表明:流感相关性脑病的发病机制与血浆和脑脊液中高水平的细胞因子(IL-6、IL-10和TNF-α)有关,支持急性“细胞因子风暴”的主要假说。即机体感染流感病毒后过度的促炎细胞因子与趋化因子引发中枢神经系统的免疫病理损伤,是发生流感相关性脑病的免疫机制之一[10]。本研究表明:环磷酰胺腹腔注射,再感染A型流感病毒后小鼠脑组织匀浆中IL-6和TNF-α含量水平及海马和皮质中IL-6和TNF-α蛋白表达均显著升高。说明经环磷酰胺处理后的小鼠感染流感病毒后,脑组织中炎症因子IL-6和TNF-α均释放增加,且炎症因子含量水平与脑组织损伤密切相关。本课题组前期研究证实流感病毒感染后,机体肺部产生炎症的同时,肺组织及脑组织中JAK1-STAT1信号通路激活及下游炎症因子表达水平失衡[11],这可能又是流感病毒感染后发生“细胞因子风暴”的分子机制之一。
由于流感相关性脑病常发生于儿童,儿童较成人血脑屏障发育不完善,流感病毒破坏血脑屏障导致中枢神经系统功能失常也被认为是流感相关脑炎的可能发病机制。孙桂莲[12]等通过检测流感病毒相关脑病患者血清中基质金属蛋白酶(matrix metalloproteinases,MMPs)水平发现MMPs可能参与了流感脑病的发病。在炎性因子作用下,MMPs可通过水解蛋白作用破坏血脑屏障基底膜及内皮细胞之间的紧密连接(tight junction,TJ)[13]。血脑屏障(blood-brain barrier,BBB)是一种多细胞血管结构,将中枢神经系统与外周血循环分隔开来,血管内皮细胞及细胞间的TJ是BBB的重要构成部分[14]。BBB的功能基础是内皮细胞间的TJ蛋白,通过TJ蛋白的变化可发挥闸门及栅栏样的调控作用。ZO-1是TJ蛋白之一,它的表达水平能够很好地反应血脑屏障结构的完整性[15]。本研究发现,环磷酰胺联合流感病毒应用于小鼠时,与单用病毒比较,小鼠脑组织中ZO-1蛋白水平显著下降,说明小鼠血脑屏障的完整性遭到一定程度的破环,有利于流感相关性脑病的发生。

