基于多模态MRI与深度学习的乳腺病变良恶性鉴别
杨一风,祁章璇,聂生东
上海理工大学 医学影像工程研究所,上海 200093
引 言
近年来,乳腺癌因高发病率和死亡率而成为危害女性身心健康的首要问题[1].临床上乳腺癌往往是由早期的乳腺病变逐渐恶化发展而来.但因其发病机理的不确定性和早期病情较为隐匿,往往会出现临床漏诊和误诊,从而导致良性病变没有得到及时治疗而逐渐发展为恶性癌变.因此,对早期乳腺病变的良恶性精确诊断及筛查,并对患者进行有针对性的防控和治疗,对降低乳腺癌的死亡率具有重要意义[2].
医学影像检查为乳腺病变诊断提供了有效工具[3].然而,近年来随着乳腺影像检查数量不断攀升,临床医师的阅片压力激增,极易造成误诊、漏诊.乳腺癌计算机辅助诊断(computer aided diagnosis,CAD)技术应运而生.现有的乳腺癌CAD 技术主要包括传统机器学习和深度学习两种方法.基于传统机器学习的方法依赖于精细地靶区人工勾画,以便于提取用于模型训练的特征[4,5].而基于深度学习的方法能够实现高通量、自动化地感兴趣区域(region of interest,ROI)特征提取,并且对ROI精细勾画的依赖性较弱,在乳腺病变分类任务中得到了广泛应用[6-11].例如Samala 团队[8]基于数字乳腺断层成像(digital breast tomosynthesis,DBT)和乳腺钼靶X 射线成像,设计了一种多阶段迁移学习模型进行乳腺良恶性肿块的自动分类.他们利用了非医学图像(ImageNet)数据上训练的卷积神经网络(convolutional neural network,CNN)模型的知识,首先用具有相对大样本量的乳腺X射线数据进行微调,然后再迁移到基于小型DBT 数据的目标任务中,以提高模型在小样本DBT 影像数据上的学习效率和诊断准确率.该模型得到了平均0.93 的受试者工作特征曲线下方面积(area under the curve,AUC)值,证明了当来自目标域的训练样本有限时,使用来自相似辅助域的数据进行额外的迁移学习是有利的.Dalmis 等[9]通过训练DenseNet 网络模型提取基于多参数的超快动态增强磁共振成像(dynamic contrast enhanced magnetic resonance imaging,DCE-MRI)的影像特征,实现了AUC 为0.811 的乳腺良恶性病灶分类准确率,表明超快DCE-MRI 可对乳腺良恶性病变进行有效鉴别诊断.该团队进一步采用随机森林分类器对临床信息(患者信息、乳腺癌易感基因和表观弥散系数)进行特征提取,并将影像特征与临床特征相融合,显著提高了模型的分类性能(AUC 提高至0.852).Saritas 等[10]从钼靶X 射线影像中提取影像特征,包括肿块形状、肿块边缘和肿块密度,并与乳腺影像数据报告和数据系统(breast imaging reporting and data system,BI-RADS)分级和年龄进行特征融合,而后输入人工神经网络(artificial neural network,ANN)进行乳腺病变良恶性的预测,从而辅助临床医生判断病人是否需要进行活检.
CAD 模型效果不仅与模型本身结构有关,还取决于模型的输入[12,13].目前大多数研究是基于钼靶X 射线或乳腺超声图像进行模型搭建,并且取得了较高的精度.相比于低分辨率的,对深位、高位病变低敏感性的钼靶X 射线扫描,DCE-MRI 具有高分辨率、无创性、对乳腺病灶软组织具有高灵敏度等优点,对提高临床早期乳腺疾病的检出率具有重要价值[14].然而,临床MRI 目前通常作为乳腺诊断的一种补充扫描,因此可用于实验研究的MRI 数据相比钼靶和超声数据较少.受限于有限数据量,基于DCE-MRI 影像构建高精度的乳腺病变良恶性自动检测模型仍具有一定挑战性.
本研究提出了一种联合非对称卷积(asymmetric convolution,AC)和超轻子空间注意模块(ultra-lightweight subspace attention module,Ulsam)的AC_Ulsam_CNN 网络模型进行乳腺病变良恶性的自动鉴别诊断.首先,该模型通过增加网络宽度和深度,并引入子空间注意力机制,从而能够增强网络的特征表达能力,提高模型的检测性能.其后,将DCE-MRI 影像特征与其他临床指标进行特征融合,通过增加特征的多样性,以弥补因样本量少导致的分类精度低的缺陷,进而获得更准确可靠的分类结果.
1 实验部分
1.1 实验数据
本研究中的乳腺数据来自上海交通大学医学院附属新华医院.具体入组标准为:(1)根据BI-RADS[15],放射医师拟诊为患良性或恶性乳腺病变的患者(BI-RADS 评估为0~V 级);(2)病灶最大截面直径≥5 mm;(3)于同一医院检查并进行手术或活检穿刺后取得病理结果;(4)术前影像检查包括DCE-MRI 扫描,包括动态增强T1高分辨率各向同性容积采集序列(dyn-eTHRIVE,Dyn)扫描、动态增强T1高分辨率各向同性体积采集的减影序列(sdyn-eTHRIVE SENSE,Sdyn)扫描和扩散加权成像(diffusion-weighted imaging,DWI)扫描.自2014年1月至2019年12月间,符合数据入组条件的病例累计有277 例女性患者,包括良性乳腺病变119 例、恶性病变158 例(表1).恶性病变中浸润性癌占比最高,良性病变主要表现为纤维腺瘤和乳腺病.本研究设计和实施方案已获得由伦理委员会和合作医院机构审查签署的知情协议.所有参与者均签订书面知情同意书.

表1 乳腺病变良恶性数据分布Table 1 Data distribution of benign and malignant breast lesions
MRI 扫描均采用飞利浦Ingenia 3.0T 超导型磁共振设备.在注射钆喷替酸葡甲胺(Gd-DTPA)对比剂前,进行一次平扫采集;注射对比剂后,再进行数次连续且不间断的重复性MRI 扫描.对比剂经病患手背由高压注射器进行静脉团注,剂量为0.2 mmol/kg、流速为2.0 mL/s,之后使用相同方法注射15 mL 浓度为0.9%的氯化钠水溶液,记录磁共振动态增强曲线(time intensity curve,TIC)类型.
Dyn 扫描设有5 个时序,分别记为S0~S4(如图1所示).Sdyn 扫描设有4 个时序,分别记为S0~S3.扫描层数均为150 层,层厚为1.2 mm,扫描时间均为58 s,影像分辨率为512 mm×512 mm,通道数为3.DWI 扫描设定扩散敏感系数b值为0.80 s/mm2,记录各被试的表现扩散系数(apparent diffusion coefficient,ADC).

图1 设有5 个时序(S0~S4)的Dyn 扫描影像Fig.1 The images acquired using Dyn with 5 time phase scans (S0~S4)
1.2 实验方法
本文提出的基于多模态MRI 数据和深度学习的乳腺病变良恶性鉴别方法流程主要包括:(1)数据预处理;(2)基于DCE-MRI 影像数据,采用迁移学习方法预训练模型,以从不同的时序中筛选出对乳腺病变良恶性鉴别最为有效的扫描时序.(3)基于最优扫描时序,构建针对乳腺病变良恶性鉴别任务的AC_Ulsam_CNN 网络模型.(4)将影像特征与临床BI-RADS 分级指标、ADC 值和TIC类型进行特征融合,重新训练混合AC_Ulsam_CNN 网络,从而进一步提高乳腺病变良恶性鉴别的准确率.
1.2.1 数据预处理
本文使用的数据模态包括DCE-MRI 不同时序的扫描图像和其他衍生指标,如:BI-RADS 分级指标、ADC 值和TIC 类型.
首先,对DCE-MRI 影像数据进行预处理.根据临床医师勾画的金标准定位病灶位置,以病变区域为中心,设置大小为64*64 的像素窗口,分割出包含病灶区域且占比适中的ROI 图像,并保存为灰度图片,记为基于单一信源的ROI 数据.为丰富ROI 信息,分别选取时序相位扫描中的任意三个扫描进行通道融合.将融合后的图像保存为具有三通道的彩色图片,并记为基于多信源的ROI数据(如图2所示).

图2 DCE-MRI 不同时序扫描的多信源组合ROI 影像示意图Fig.2 The multi-source combined ROI images scanned by different time phase scans of DCE-MRI
其次,对衍生指标中的临床BI-RADS 分级和TIC 评估数据分别进行量化处理.其中,根据临床BI-RADS 分级结果,将对应分级(0 级、I 级、II 级、III 级、IVa 级、IVb 级、IVc 级和V 级)量化为0 到7,代表临床对病灶性质的初步筛查评估;将TIC 评估中上升型、平台型和流出型分别量化为数值0、1 和2;定量ADC 值则进行线性归一化处理.
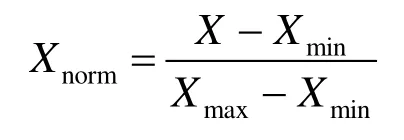
其中,X表示每个病例的ADC 特征值,Xmin表示所有病例ADC 特征值中的最小值,Xmax表示所有病例ADC 特征值中的最大值,Xnorm表示每个病例归一化后的ADC 特征值.
最后,根据DCE-MRI 中不同时序扫描及其随机排列组合,本实验共获得9 组基于单一时序扫描的单信源影像数据和13 组基于不同时序组合的多信源影像数据,如表2所示.其中,每组均包含95 106 张含乳腺病灶的ROI 图像,包括良性病变31 722 张、恶性病变63 384 张.每张影像均有其对应的衍生指标,并且将临床病理检验得到的良恶性诊断结果作为其真实标签.
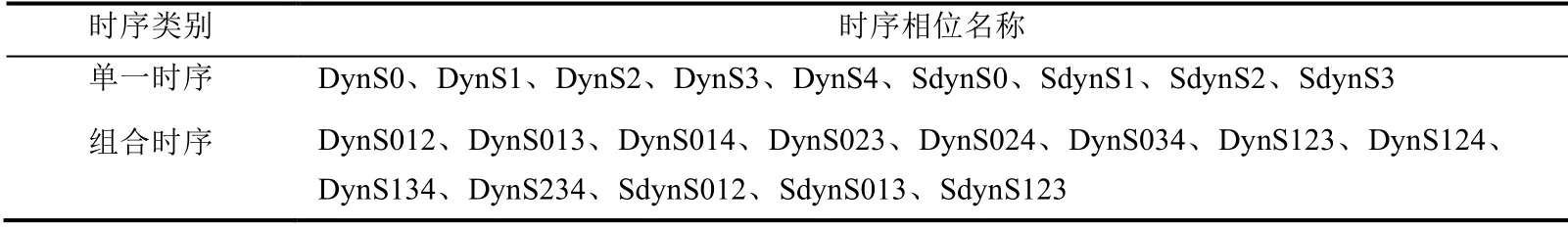
表2 DCE-MRI 中不同时序扫描及其组合Table 2 The different time phase scans and their combinations
1.2.2 基于不同时序的DCE-MRI 对乳腺病变良恶性的分类
DCE-MRI 扫描中包含多个不同时序的扫描序列,而不同时序扫描的影像对良恶性病灶的组织对比度强度具有不同的敏感性.因此,为筛选出对病灶良恶性鉴别最为有效的扫描序列,本文首先进行了初步的预实验.然而,考虑到本实验中样本量不足,若直接从头训练模型,容易造成模型欠拟合或过拟合问题,难以进行最优时序的筛选.迁移学习为解决小样本量医学影像数据提供了有效方法[16].其中,InceptionV3 模型因具有较强的特征表达能力被广泛应用于各项分类任务[17],并且已在乳房肿块检测研究[18-20]中取得了优异的成果.与其他CNN 相比,InceptionV3 计算成本和内存需求低,对有限数据集进行迁移学习的可行性高,因此本研究中采用经典的InceptionV3 作为预训练模型.通过去除顶层分类器,并添加两个输出尺寸分别为128 和16 的Dense 层进行模型微调,最后采用Sigmoid 层作为模型的输出层,以评估基于不同时序的DCE-MRI 对乳腺病变良恶性的分类性能.
1.2.3 基于AC_Ulsam_CNN 网络的乳腺病变良恶性鉴别模型
基于迁移学习的方法往往依赖于目标数据与原始数据之间的相似性,而针对高维复杂的MRI数据,该方法在模型精度提升方面仍具有一定局限性.因此,为进一步提高DCE-MRI 影像数据对乳腺病变良恶性鉴别性能,基于筛选出的最优时序作为输入图像,本文构建了基于AC_Ulsam_CNN网络的模型.如图3所示,AC_Ulsam_CNN 网络主要由两个非对称卷积模块(AC Block)、两个超轻子空间注意模块(Ulsam Block)、两个最大池化层(MaxPooling)和四个残差式学习跳跃连接结构(分别为:(2)→(5)→(6),(8)→(11)→(12),(12)→(17)→(20),(14)→(18)→(19))组成,而后经过全局平均池化层(global average polling,GAP)、密集全连接层(Dense)和分类器层(Sigmoid)得到输出结果.网络结构参数设置如表3所示.

表3 AC_Ulsam_CNN 网络结构参数设置Table 3 The parameter setting of the proposed AC_Ulsam_CNN structure

图3 AC_Ulsam_CNN 的网络结构示意图Fig.3 The network structure diagram of AC_Ulsam_CNN
此外,为解决随网络结构的加深、梯度优化速度减缓、模型收敛慢等问题,模型中引入了批归一化层(batch normalization,BN)和LeakyReLU 激活函数,并采用Sigmoid 函数进行激活输出,以加快网络优化速度,并提高模型的鲁棒性.
非对称卷积模块(AC Block)是一种采用多个非对称卷积核组合形式替换标准卷积核的特殊卷积结构,通过增加模型不同尺度方向的特征提取通路,从而提升模型的鲁棒性[21].非对称卷积参数训练后,与标准卷积参数的有效融合,也使得模型在训练阶段能够更专注于特征提取的强化,得到高表征能力、强相关的特征.虽然训练时间成本有提升,但卷积核参数的等效融合不会出现多余的计算量.因此,模型的性能提升无需多余的计算开支,该机制对解决因小样本量数据而导致的模型过拟合问题具有充分的应用价值.本文设计的非对称卷积模块结构如图4所示.首先,将上一层得到的特征图分别输入到尺寸为1×3、3×1 和3×3 的卷积核(c@1×3、c@3×1 和c@3×3,其中c 为卷积通道数)中进行训练,并采用逐点求和方式进行融合,以提升局部显著性特征的影响因子.而后采用残差学习方式,将融合后的特征图与原特征图进行按通道拼接,从而避免图像信息丢失,增强网络的特征表达能力.

图4 非对称卷积模块(AC Block)结构示意图Fig.4 The structure diagram of asymmetric convolution module (AC Block)
为提高小容量、低空间复杂网络的学习效率,超轻子空间注意模块(Ulsam Block)[22]引入了子空间注意力机制.通过将输入特征分组为g个特征子空间(本实验中设置g=2),依次采用1×1 depth-wise 卷积学习新特征,经最大池化层降维后,再采用1×1 point-wise 卷积,从而可得到每个特征子空间的个体注意力图.softmax 激活函数保证了g个特征子空间中的注意力图的权重和为1.因此,Ulsam 模块有助于网络提取到多尺度和多频率特征,同时也使模型能够高效地利用跨通道信息.Ulsam Block 结构如图5所示.

图5 超轻子空间注意模块(Ulsam Block)结构示意图Fig.5 The structure diagram of ultra-lightweight subspace attention module (Ulsam Block)
1.2.4 融合多模态数据的乳腺病变良恶性鉴别
DCE-MRI 扫描能够生成TIC,为鉴别病变性质提供了血流动力学参数[23].ADC 作为DWI 成像中的一种衍生指标,能够反应软组织内水分子扩散情况,从而有效降低乳腺MRI 的假阳性,并被证明与乳腺良恶性程度具有强相关性[24].因此,为进一步探索多模态数据融合在乳腺病变良恶性鉴别中的价值,本文设计了一种混合式AC_Ulsam_CNN 卷积神经网络模型,通过将DCE-MRI 影像特征分别与其他衍生指标(临床BI-RADS 分级、ADC 值和TIC 类型)进行特征级别的融合,即在图3网络全连接层部分,引入相应衍生指标特征,继而将融合后的新特征输入到Sigmoid 分类器中进行良恶性分类(图6).在此基础上,我们还将文献[6]和文献[8]中所设计的经典模型应用于本研究数据中,以进行横向对比实验,进一步验证所提模型的有效性.其中,文献[6]所提模型为一种简单线性堆叠卷积神经网络,由三种尺寸大小为11×11、5×5 和3×3 的卷积核和尺寸分别为2 048、1 024的全连接层组成,通道数从初始的64 增加到512.文献[8]在网络层方面相较文献[6]多引入了批量归一化层,设计了一个10 层CNN,包含尺寸大小为3×3 的卷积核和大小分别为4 096、1 000、100个神经元的全连接层,通道数从初始的64 增加到384 又缩小至256.研究表明这两种网络结构在乳腺肿瘤良恶性分类任务中均表现出优异性能.
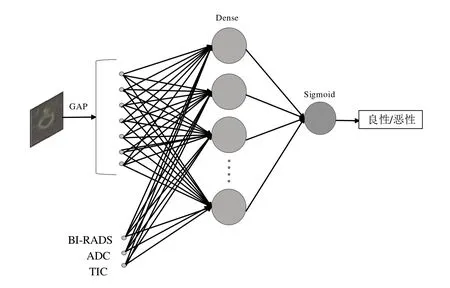
图6 基于多模态数据融合的混合神经网络结构示意图Fig.6 The structure diagram of hybrid neural network based on multimodal data fusion
1.3 模型评估
受数据集样本量大小限制,本实验采用五折交叉验证方法对各模型性能进行综合评估,并对每折中的训练集进行平移、旋转和镜像翻转的数据扩增处理,以减小模型过拟合.此外,考虑到本实验数据中良恶性病变具有类间不平衡问题,在网络损失函数计算部分,我们根据正负样本比例赋予类别权重因子,从而使模型结果不会偏向多数类别.采用准确率(accuracy,ACC)、灵敏度(sensitivity,Sens)、特异性(specificity,Spec),AUC 指标进行模型性能评估.计算公式如下:

其中,TP 表示恶性乳腺病变被正确分类的样本数;FP 表示良性乳腺病变被错误分类的样本数;TN表示良性乳腺病变被正确分类的样本数;FN 表示恶性乳腺病变被错误分类的样本数.
最后,采用IBM SPSS(v25.0)进行统计学分析,对不同模型的AUC 和ACC 进行比较.双尾t检验p< 0.05 表示统计学意义.
1.4 实验设置
在硬件配置为计算机芯片Intel Core(TMi7-8700),其内存为32 GB,NVIDIA 显卡GeForce GTX 1080ti,软件环境为Windows10 系统,Nvidia 显卡驱动CUDA9.0,以及用于深度神经网络的GPU加速库CUDNN7.0 的实验配置下,本文基于Python 和Keras 框架进行网络模型开发.采用Adam 优化器进行超参数优化,设置各卷积层初始化方式为Xavier,网络学习率为0.002,批处理大小为32,总训练次数至少200 个epochs.
2 结果与讨论
2.1 基于不同时序的DCE-MRI 对乳腺病变良恶性分类结果
本研究分别对9 个基于单一时序和13 个基于不同时序扫描的多信源组合构建迁移学习模型,进行乳腺良恶性分类预实验.控制每次实验均是在相同的数据划分下基于相同InceptionV3 网络结构完成训练.基于不同时序的五折交叉验证后的平均分类性能如图7和图8所示.其中,在基于各单一时序扫描中,基于DynS4 时序扫描具有最好的良恶性鉴别能力,AUC 为0.730,准确率ACC为0.725.而在组合序列中,基于DynS024 的组合序列对乳腺良恶性鉴别的AUC 和准确率ACC 可达到0.775 和0.749,高于基于单一时序的分类结果,这可能与单一时序中DynS2 和DynS4 具有较好的分类表现有关.因此,基于DynS4 时序扫描和DynS024 组合扫描序列对解决乳腺病变良恶性鉴别问题可能最具代表性,能够更好地反映恶性病灶与良性病灶的纹理、形态等特征的差异性.

图7 基于单一时序扫描的乳腺病变良恶性分类结果Fig.7 Differentiation results of benign and malignant breast lesions based on single-time phase scans
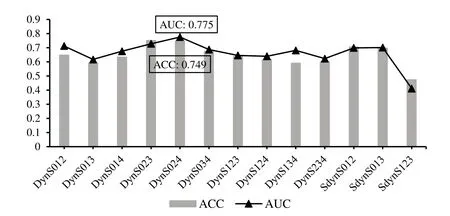
图8 基于不同时序扫描的多信源组合的乳腺病变良恶性分类结果Fig.8 Differentiation results of benign and malignant breast lesions based on multi-source combination of different time phase scans
2.2 基于AC_Ulsam_CNN 网络模型的乳腺病变良恶性分类结果
如表4所示,本实验所设计AC_Ulsam_CNN 网络模型在基于最优DCE-MRI 扫描序列下的乳腺良恶性鉴别性能有了进一步提升.其中,在DynS024 组合序列下,模型的平均AUC 可达0.826,比基于InceptionV3 模型提高了0.051(p= 0.027),准确率提升了0.013(p= 0.047),特异性提升了0.094.虽然在灵敏度指标上,所提模型略低于InceptionV3 模型,但其整体上对良性病变的鉴别能力与对恶性病变的鉴别能力相当,不存在偏倚,表明本文所提模型的有效性及可行性.
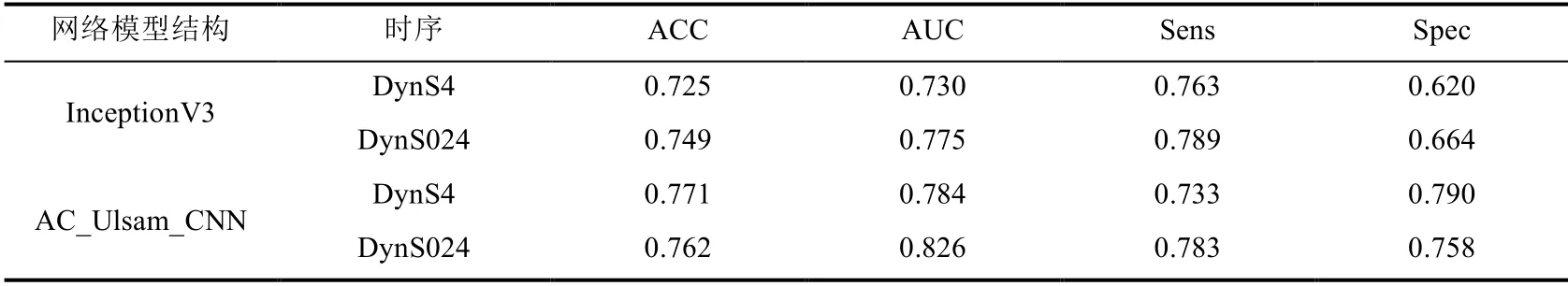
表4 基于InceptionV3 网络与AC_Ulsam_CNN 网络模型的分类结果对比Table 4 Comparison of differentiation results based on InceptionV3 and AC_Ulsam_CNN network models
2.3 基于多模态融合的乳腺病变良恶性分类
多模态数据融合能够为乳腺病变诊断提供多维度、综合性的病理信息,从而进一步提高其鉴别准确性.如表5所示,在基于不同模态特征融合的消融实验中,我们发现各特征融合队列均可获得比单一DCE-MRI 模型具有更高的分类性能.其中,基于四种特征的整体融合模型进行良恶性病灶鉴别的平均ACC 达到了0.826,相比基于单一DynS024 特征的模型分类准确率提升了0.064(p= 0.009),AUC 值提升了0.051(p= 0.021),突出了多模态数据融合的优越性.
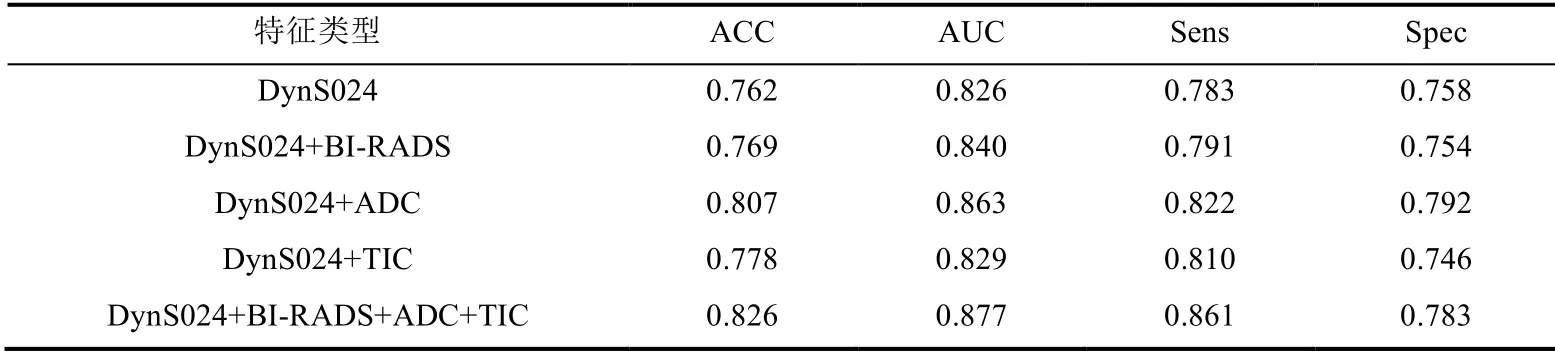
表5 基于多模态特征融合的消融实验结果Table 5 Experimental results of ablation based on multimodal feature fusion
如表6所示,相比于文献[6]和文献[8]中的较为浅层的网络模型,本文所提算法模型具有更好的乳腺病变良恶性鉴别性能,在各判别指标上均有提升.AC_Ulsam_CNN 网络结构中采用非对称卷积模块,能够增加模型的宽度,丰富特征图信息的多样性,而基于残差式学习的跳跃连接结构进一步增加了网络深度,弥补了随网络结构的加深而损失特征信息的不足.此外,超轻子空间注意模块的引入进一步提高了模型对局部强相关性特征的注意力,使得本网络模型能够提取到更丰富的特征信息并得到了更好的良恶性鉴别结果.

表6 本文方法与其他方法的分类结果对比Table 6 Comparison of differentiation results between the methods from the literatures and the proposed method
3 结论
本研究构建了一种针对乳腺病变良恶性鉴别诊断的AC_Ulsam_CNN 网络模型,通过多尺度特征提取并引入子空间注意力机制,增强了网络的特征表达能力及其鲁棒性.实验表明,在基于DynS024 组合的DCE-MRI 影像上,所提模型能够实现乳腺良恶性病变分类准确率为0.762.当模型进一步纳入临床BI-RADS 分级、ADC 值以及TIC 类型等特征指标后,基于多模态特征融合后的模型分类准确率可达0.826,显著高于基于单独的DCE-MRI 影像特征模型.因此,临床BI-RADS 分级、ADC 值和TIC 类型对基于DCE-MRI 进行乳腺诊断的性能提升具有显著贡献,而多模态特征的融合也为CAD 提供了多维度、综合性的信息,从而进一步提高病灶的检测精度,有效辅助临床医生对乳腺病变的诊断.未来研究应进一步扩充乳腺病变数据量及模态的多样性,提高模型泛化能力.
致谢
感谢参与本研究的上海交通大学医学院附属新华医院的所有患者和研究人员.
利益冲突
无

