胃癌DNA甲基化亚型及风险预测模型的建立
卢伟,付涛
武汉大学人民医院胃肠外Ⅱ科,湖北 武汉 430060
胃癌是常见的消化系统恶性肿瘤之一,据统计,2018年全球范围内新发病例超过100万,同时有超过80万病例死亡[1]。由于胃癌早期症状不典型、筛查体系不完善,在中国约70%的胃癌病人在确诊时已经处于进展期[2]。肿瘤微环境(tumor microenvironment,TME),包含恶性细胞、肿瘤相关成纤维细胞、基质细胞和免疫细胞等,与肿瘤发生发展、病人预后以及新的治疗方案相关[3]。
目前越来越多的证据表明表观遗传学的改变包括DNA甲基化,基因组印迹以及其他改变,这些改变可能会导致包括胃癌在内的恶性肿瘤进展[4]。本文旨在探讨DNA甲基化对TME的潜在影响,同时建立基于DNA甲基化预后相关差异位点的胃癌分子亚型以及Cox风险预测模型,为胃癌的诊疗提供一定理论依据[5]。
材料与方法
一、胃癌数据集下载及伦理学申明
癌症基因组图谱(TCGA)数据库中胃腺癌(stomach adenocarcinoma,STAD)病人RNA转录组数据可从基因组数据共享(Genomic Data Commons,GDC,https://portal.gdc.cancer.gov/)中下载。所有TCGA-STAD DNA甲基化数据均直接从加利福尼亚大学圣克鲁斯分校(UCSC,http://xena.ucsc.edu/public/)下载,其中包括Methylation 27k TCGA-STAD数据集和Methylation 450k TCGA-STAD数据集,并不受伦理审核。
二、临床数据和DNA甲基化数据的系统分析
下载的TCGA-STAD临床数据集包括病人的生存时间、生存状态、性别、T分期、N分期、M分期、病理分期等,通过样本ID合并病人生存时间、生存状态及DNA甲基化位点(排除一些标记为“未知”的数据)。对Methylation 450k TCGA-STAD数据集使用“survival” R包进行了Cox回归分析,得到单因素和多因素独立预后甲基化位点。
三、构建胃癌甲基化亚型并得出分型与临床特征的关系
运行一致性聚类对TCGA-STAD数据和多个独立预后的甲基化位点进行分析,然后将TCGA中胃癌样本分为不同的DNA甲基化亚型(使用“ConsensusClusterPlus”R包无监督运行1 000次)。同时可以获得不同的胃癌DNA甲基化亚型病人的预后。通过TCGA-STAD病人样本ID将分型后的DNA甲基化亚型中的胃癌病人与其临床特征结合,探索不同DNA甲基化亚型与临床特征的关系。
四、推算不同DNA甲基化亚型对TME的影响
选择DNA甲基化水平差异最大的2个亚型,将亚型对应的TCGA-STAD样本上传至CIBERSORT(https://cibersort.stanford.edu/)来推断2个亚型的免疫细胞组成(循环计算1 000次),由此可以推算DNA甲基化对TME的影响。
五、建立Cox风险预测模型
选择预后最好同时包含差异位点最多的亚型,取该亚型DNA甲基化差异位点及多因素独立预后DNA甲基化位点的交集位点,计算风险评分(Risk Score),计算公式如下:

其中“1”到“n”为所有DNA甲基化差异位点。将450k甲基化芯片中病人标记为“训练组”(“training group”),将27k甲基化芯片中病人标记为“对照组”(“test group”)。对训练组及对照组中的病人进行风险评分,高于训练组风险评分中位值的病人为高风险组病人,低于训练组风险评分中位值的病人为低风险组病人。
六、系统性分析
首先本研究采用了R studio软件(R 3.6.1 version,https://www.r-project.org/)及Perl进行数据分析及作图。通过TCGA RNA转录组数据对P值进行校正得到伪发现率(FDR),筛选临界值为FDR<0.05和logFC绝对值>2.000。通过训练组病人的受试者工作特征(ROC)曲线判断该模型是否有效[6-8]。
结 果
一、胃癌DNA甲基化亚型的划分
通过TCGA样本ID将Methylation 450k TCGA-STAD数据集与样本对应的生存时间及生存状态合并,使用Cox回归分析,得到148个单因素独立预后相关DNA甲基化位点(P<0.05)和137个多因素独立预后相关DNA甲基化位点(P<0.05)。根据样本生存时间、生存状态和多因素独立预后相关DNA甲基化位点将TCGA-STAD分为7个DNA甲基化亚型,同时可以获得DNA甲基化亚型的Kaplan-Meier曲线(P=0.003,图1A、B)。
二、不同DNA甲基化亚型病人的临床特征
合并TCGA-STAD临床数据和DNA甲基化亚型,分析不同甲基化亚型与病理分期、分级(grade)、性别、年龄、TNM分期的关系[9]。结合图1B及图2A可认为DNA甲基化水平最高的亚型3病人较DNA甲基化水平最低的亚型7病人预后更好(P<0.05)。由图2 B~H可知亚型7中≤65岁、G2、M1期、N2期和Ⅳ期病人数量多于亚型3中病人数量。
三、分析不同DNA甲基化亚型病人的免疫细胞差异
CIBERSORT结果提示生存差异最大的亚型3及亚型7的免疫细胞组成中幼稚B细胞(B cells naive)、记忆B细胞(B cells memory)及激活的T细胞CD4+记忆细胞(T cells CD4 memory activated)存在明显差异(P<0.05,图3)。

图1 确定DNA甲基化亚型 A.按DNA甲基化水平差异将TCGA-STAD划分为7个DNA甲基化亚型;B.不同DNA甲基化亚型的生存率差异(P<0.05)

图2 不同临床特征中不同DNA甲基化亚型病人所占比例 A.DNA甲基化与临床特征关系的热图;B.不同DNA甲基化亚型病人年龄占比;C.不同DNA甲基化亚型病人性别占比;D.不同DNA甲基化亚型病人病理分级占比;E.不同DNA甲基化亚型病人病理分期占比;F.不同DNA甲基化亚型病人T分期占比;G.不同DNA甲基化亚型病人N分期占比;H.不同DNA甲基化亚型病人M分期占比

图3 亚型3病人和亚型7病人免疫细胞浸润差异
四、建立Cox风险预测模型
通过DNA甲基化分型与预后结果可见亚型3预后最好,取该亚型DNA甲基化差异位点及多因素独立预后DNA甲基化位点的交集位点计算风险评分,在本文中风险评分=(-1.242×cg12645220表达量)+(-1.432×cg20727114表达量)+(-1.744×cg26535072表达量),见表1。

表1 DNA甲基化差异位点表达与该位点系数
基于风险评分建立Cox风险预测模型,将TCGA-STAD病人分为高风险组病人和低风险组病人(临床信息见表2)。ROC曲线下面积(AUC)为0.677,可以认为基于风险评分构建的DNA甲基化Cox风险预测模型能够有效预测胃癌病人预后(图4)。训练组病人及对照组病人的Kaplan-Meier曲线均证明高风险组病人较低风险组病人预后更差(P<0.05),见图5A、B。

图4 DNA甲基化风险预测模型绘制的受试者工作特征(ROC)曲线
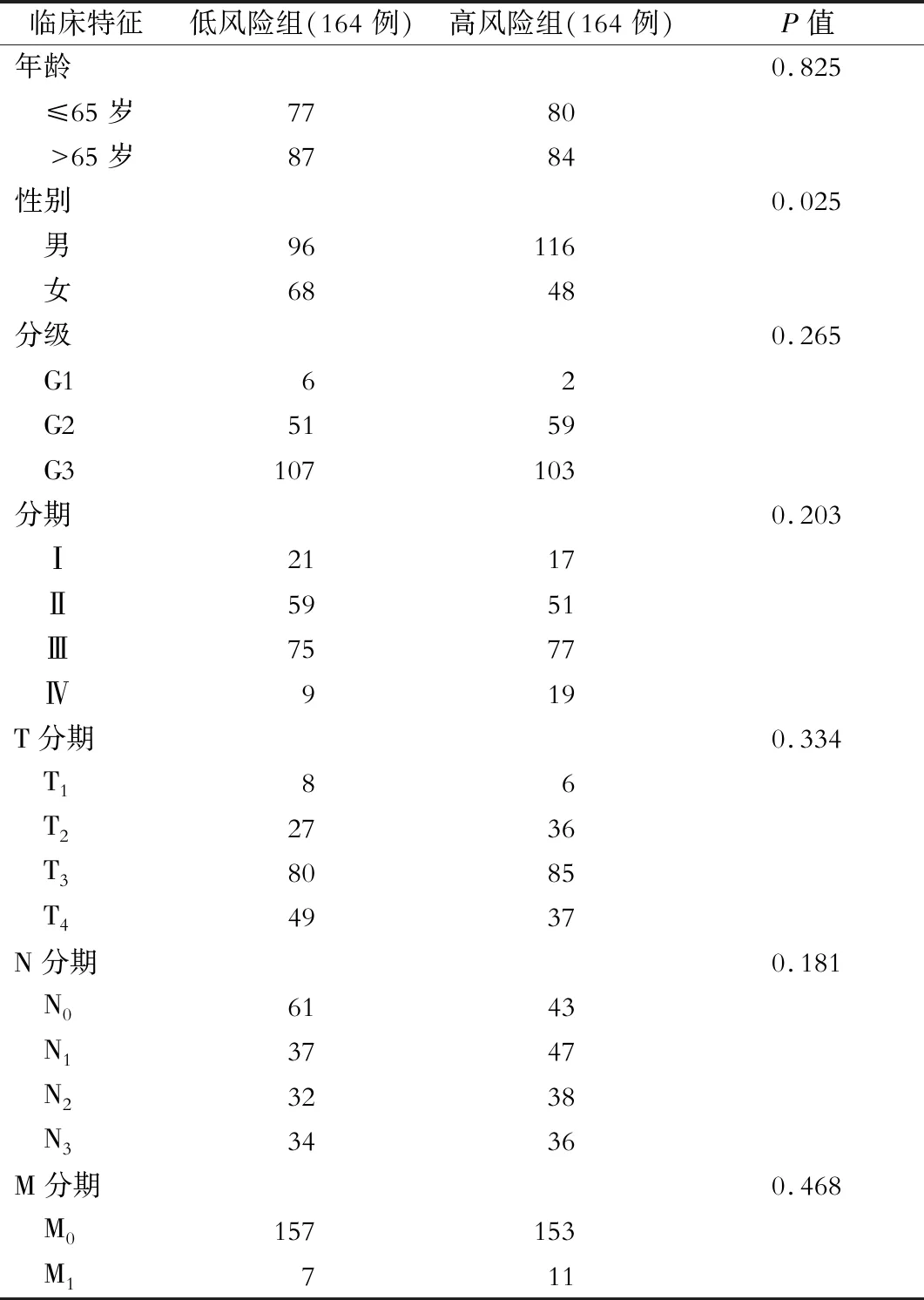
表2 TCGA-STAD病人临床信息(例)

图5 训练组和对照组不同风险组病人的预后 A.在训练组中,高风险组病人较低风险组病人预后更差(P<0.05);B.在对照组中,高风险组病人较低风险组病人预后更差(P<0.05)
讨 论
在以往的研究中,为了预测胃癌病人的预后,通常将胃癌分为4种分子亚型:EB病毒相关型胃癌,微卫星不稳定型胃癌,染色体不稳定型胃癌以及基因组稳定型胃癌[10]。本研究基于DNA甲基化水平差异将TCGA胃癌病人分为7个DNA甲基化亚型。
由于肿瘤生物学行为和免疫反应的异质性和复杂性,应用单一的生物标志物来全面说明和预测肿瘤预后和其对治疗的反应是不可靠的。因此,基于多生物标志物的预测模型可能是一种更有效、更准确的工具。本研究依据DNA甲基化预后相关差异位点cg12645220、cg20727114、cg26535072建立了Cox风险预测模型。cg12645220、cg20727114、cg26535072表达的基因分别是PAK7、APBA1、CPT1C。p21活化激酶7(PAK7)属于PAK族蛋白,参与调节细胞增殖、凋亡、侵袭/迁移和化学抗性,其过度表达或激活可能导致癌症[11-12]。APBA1与 Munc18-1结合,在突触小泡的胞吐作用中发挥推定功能,突触小泡的胞吐作用是突触小泡胞吐机制的重要组成部分[13]。CPT1C具有该基因的重要旁系同源物是CPT1A在脂质代谢过程中类似的作用,能够影响CD8+T记忆细胞的生长[14]。CPTI激活脂肪酸氧化,通过产生ATP和NADPH促进癌症生长,这是癌症代谢的重要组成部分[15]。所以,CPT1C可能成为癌症的新治疗靶点[16]。
遗传基因的表观学改变,尤其是DNA甲基化,已被确定为肿瘤免疫细胞浸润改变的重要因素[17-18]。本研究证明了DNA甲基化水平高的病人预后好,DNA甲基化水平不同的病人间存在包括幼稚B细胞、记忆B细胞及激活的T细胞CD4+记忆细胞等免疫细胞比例的差异。现在针对胃癌免疫治疗,如程序性死亡蛋白-1(PD-1)等,都是针对T细胞的治疗方法[19-20]。B 细胞被认为是体液免疫的主要效应细胞,可以通过分泌免疫球蛋白、促进T细胞反应和直接杀死癌细胞来抑制肿瘤进展[21]。尽管免疫检查点抑制剂的引入使T细胞相关免疫反应成为治疗靶点,但并非所有病人都能从这些治疗中受益[22-24]。细胞毒性免疫依赖于特殊效应T细胞,即细胞毒性T细胞,它们具有特定的溶细胞机制,使它们能够诱导目标死亡,确定靶细胞后,细胞毒性T细胞形成裂解免疫突触,通过将微管组织中心对接在突触膜上,制备致死酶溶解裂解颗粒[25-26]。美国食品药品监督管理局批准了几种检查点抑制剂药物,如抗PD-1派姆单抗等,但并未广泛应用于临床胃癌病人[27-28]。针对DNA甲基化位点的免疫治疗可能会成为未来胃癌治疗方法之一[29-31]。
本研究也具有一定的局限性:首先对TCGA数据库进行了条件筛选,结果可能出现选择偏倚。其次,TCGA数据库中病例为美国公民,因为中美饮食条件、早期筛查体系的不同,所以结果对亚太人群的预测效果可能并不理想。并且由于TCGA数据库中样本量的限制,同样会对研究结果造成影响,在后期仍需要大量独立样本进行验证。
利益冲突所有作者均声明不存在利益冲突

