细针穿刺细胞学未确诊的甲状腺乳头状癌患者BRAF V600E基因突变的关联因素分析
章国智,史绮韵,鲍杨秋,李爱玲,吴 峰,王 成,齐晓伟,张 毅
400038 重庆,陆军军医大学(第三军医大学)第一附属医院:乳腺甲状腺外科1,病理科2
甲状腺结节非常常见,通过超声检查可在68%的健康人群中发现甲状腺结节。尽管大部分的甲状腺结节为良性结节,但也有7%~15%的恶性风险[1-3]。在过去的30年里,世界范围内甲状腺癌的发病率增加了300%,主要是甲状腺乳头状癌(papillary thyroid carcinoma,PTC)的增加[4]。PTC是甲状腺癌最常见的组织学亚型,约占新发病例的80%[5]。目前,甲状腺结节的评估主要包括甲状腺功能检测、包含颈部淋巴结的甲状腺超声检查以及细针穿刺细胞学(fine-needle aspiration cytopathology,FNAC)检查。尽管甲状腺超声联合FNAC是目前临床上评估甲状腺结节最常用及可靠的手段,但其也有局限性,大约30%的甲状腺结节难以通过该方法明确诊断[6]。现国际上广泛使用Bethesda甲状腺细胞学病理报告系统将甲状腺结节分为6类,BethesdaⅠ~Ⅵ类结节的恶性风险分别为5%~10%、0%~3%、6%~18%、10%~40%、45%~60%、94%~96%[7-8]。临床实践中,Bethesda Ⅵ类结节得到了及时的手术干预,但占FNA患者数量绝大部分的BethesdaⅠ~Ⅴ类结节的恶性风险常被低估,这类患者处理方式通常是超声随访、再次FNA或诊断性腺叶切除,增加这部分患者假阴性的风险和医疗负担。研究表明即使诊断为良性,分类为Bethesda Ⅱ类的甲状腺结节,两年内超声随访假阴性率也达到了7.5%[9]。
研究表明,BRAF V600E基因突变对诊断PTC具备高敏感性和特异度[10]。BRAF V600E基因突变出现在超过80%的PTC中[11],BRAF V600E突变还被证明与高危临床病理特征、肿瘤复发、转移和放射性碘治疗敏感性降低相关[12-13]。2015年《美国甲状腺协会(American thyroid association,ATA)指南》建议在甲状腺结节术前穿刺病理不能确诊时,使用分子标记物进行辅助诊断[14]。目前,国内多对FNA样本进行BRAF V600E单基因检测辅助提高甲状腺结节诊断的准确性,但FNA样本量不足导致检测失败、FNA多次采样增加患者创伤及出血风险、医疗花费增高等问题丞待解决。是否能利用患者临床资料评估甲状腺结节的分子表达情况,患者临床特征及相关因素与BRAF V600E基因突变的相关性尚不明确。研究旨在对FNAC分类为BethesdaⅠ~Ⅴ类,术后病理证实为PTC患者的临床特征与BRAF V600E基因的相关性进行分析,探讨BRAF V600E基因突变与此类结节临床特征的相关性以及关联因素的风险预测能力,以期通过常规检查结果对该基因突变进行预测,提高诊断准确率,优化无该基因检测条件患者的诊疗方案,使这部分患者获益。
1 资料与方法
1.1 一般资料
本研究采用回顾性队列研究设计方案。筛选陆军军医大学第一附属医院(西南医院)乳腺甲状腺外科2020年6月至2021年6月期间经术后组织学病理确诊的符合纳入标准的127例PTC患者的临床资料。其中男性患者27例(21.26%),女性患者100例(78.74%),年龄19~77(43.09±11.38)岁。患者术前穿刺样本均采用实时荧光聚合酶链式反应(polymerase chain reaction,PCR)技术进行BRAF V600E基因检测,根据BRAF V600E基因检测结果分为两个队列,即BRAF V600E基因突变阳性组和阴性组,对比两组患者的临床资料差异,分析其与BRAF V600E基因突变的相联。纳入标准:①术后组织学病理诊断为PTC;②FNAC分类为BethesdaⅠ~Ⅴ类;③既往未进行过射频消融术、甲状腺切除术等相关治疗;④诊疗过程记录完善且临床资料齐全。排除标准:①合并其他恶性肿瘤;②相关检查及检验结果存在争议且不能得出明确结果。该研究已获得陆军军医大学第一附属医院伦理委员会批准(KY2020032)。
1.2 诊疗过程
1.2.1 超声检查 采用Siemens S2000型彩色多普勒超声诊断仪(线阵探头 9L4,频率4~9MHz)及Philips IU22型彩色多普勒超声诊断仪(线阵探头 L12-5,频率5~12 MHz),由甲状腺超声诊断医师根据2017年美国放射学会制定的ACR-TIRADS系统[15]对甲状腺结节特征进行回顾性统计记录,记录超声特征包括结节数目、最大径线、回声性质、结构性质、结节边缘、结节与被膜分界、结节形态、局灶性强回声、颈部异常淋巴结。
1.2.2 超声引导下细针穿刺细胞学检查 采用Philips IU22型彩色多普勒超声诊断仪(线阵探头 L12-5,频率5~12MHz)以及23G抽吸活检针。根据术前常规超声检查以及超声造影检查结果明确目标结节,平卧体位,头部后仰,常规消毒铺巾,局部麻醉,确认最佳进针角度和穿刺路径,在超声引导下进入目标结节,确保针尖位于病灶处,停止进针,拔出针芯,快速提插进行常规取材,将取出物涂抹在载玻片上,推片后用95%乙醇的固定,显微镜观察,根据2017年Bethesda甲状腺细胞学报告系统[8],由病理医师做出诊断。
1.2.3 BRAF V600E基因检测 127例患者均使用人类BRAF基因V600E突变检测试剂盒(厦门艾德生物医药科技股份有限公司)进行检测,将制备好的DNA样本进行实时PCR检测,根据5-羧基荧光素(5-Carboxyfluorescein,FAM)信号扩增曲线及阈值循环数(cycle threshold,Ct)值判读基因检测结果。
1.2.4 外科手术 根据2015年美国甲状腺协会成人甲状腺结节和分化型甲状腺癌管理指南进行手术,术式包括:①全/近全甲状腺切除术;②单侧甲状腺腺叶+峡部切除术;③单侧甲状腺腺叶+峡部+对侧腺叶大部切除或次全切除术。综合术前检查结果评估颈部淋巴结清扫范围。所有手术评估与实施由同一组医生完成。
1.2.5 组织病理学检查 127例标本术后均经固定、脱水、石蜡包埋、切片、HE染色,由病理医师做出诊断。
1.3 观察指标
患者一般资料包括性别、年龄、肿瘤位置等;肿瘤超声特征包括肿瘤大小、结节与被膜分界、颈部异常淋巴结等;BRAF V600E基因突变情况;FNAC分类情况;术后组织病理学特征包括肿瘤是否为微小癌、颈部淋巴结转移数量、周围血管神经侵犯等。
1.4 统计学分析
2 结果
2.1 患者一般资料与BRAF V600E基因突变的单因素分析
研究共纳入FNAC分类为BethesdaⅠ~Ⅴ类,术后组织学病理证实为PTC患者127例,其中男性患者27例(21.26%),女性患者100例(78.74%),年龄19~77(43.09±11.38)岁。BRAF V600E基因突变组患者82例(64.57%),无突变组患者45例(35.43%)。对两组患者的性别、年龄、结节位置、TSH、三碘甲状腺原氨酸(triiodothyronine,T3)以及游离四碘甲状腺原氨酸(free tetra iodothyronine, Free T4)与BRAF V600E基因突变进行单因素分析,单因素分析结果提示BRAF V600E基因突变与上述研究因素均无相关性(P均>0.05,表1)。

表1 PTC患者一般资料与BRAF V600E基因突变
2.2 研究期间FNAC分类为BethesdaⅠ~Ⅴ类患者的整体分布
2020年6月至2021年6月期间,我院FNAC检查患者共4 030例,其中分类为BethesdaⅠ~Ⅴ类1 749例(43.40%)。197例患者进行了手术治疗,147例(74.62%)患者术后组织学病理为恶性肿瘤,127例(86.39%)患者术后组织学病理为PTC,见表2。
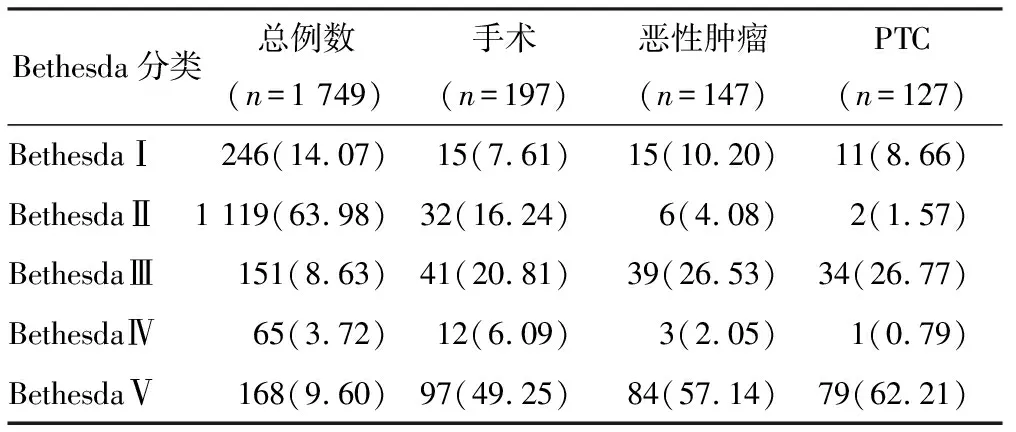
表2 FNAC分类为BethesdaⅠ~Ⅴ类患者整体分布
2.3 超声特征与BRAF V600E基因突变的单因素分析
研究对82例BRAF V600E基因突变的PTC超声特征(图1)和45例无突变的超声特征进行了回顾分析,总结了所记录的超声特征与BRAF V600E基因突变的相关性,其中结节与被膜分界、结节形态、颈部异常淋巴结情况、TIRADS分级与BRAF V600E基因突变存在相关性(P<0.05),结节最大径线、结节数目、回声性质、结构性质、结节边缘与BRAF V600E基因突变无相关性(P>0.05),见表3。
2.4 细胞学分类与BRAF V600E基因突变的单因素分析
研究纳入了术前FNAC分类为BethesdaⅠ~Ⅴ类(图2),即标本不满意或无法诊断(BethesdaⅠ类)、良性滤泡性腺瘤或慢性淋巴细胞性甲状腺炎(Bethesda Ⅱ类)、意义不明确的细胞非典型病或意义不明确的滤泡性病变(Bethesda Ⅲ类)、可疑滤泡性肿瘤(Bethesda Ⅳ类)、可疑甲状腺乳头状癌(Bethesda Ⅴ类),组织病理证实为PTC患者127例。BRAF V600E基因突变组BethesdaⅠ~Ⅴ类患者分别为11例(13.41%)、0例、30例(36.59%)、0例、41例(50.00%);BRAF V600E基因无突变组患者例数分别为0例、2例(4.44%)、4例(8.89%)、1例(2.22%)、38例(84.45%)。由于BethesdaⅠ~Ⅳ类样本量小,故将其做为一组进行统计分析,单因素分析结果提示细胞学分类与BRAF V600E基因突变有相关性(P<0.001),见表4。BRAF V600E基因检测与FNAC为同时进行,不予以纳入多因素分析进行风险预测。

→:示甲状腺结节 边界欠清、边缘成角

表3 PTC患者超声特征与BRAF V600E基因突变单因素分析结果[例

A:Bethesda Ⅰ类 标本不满意或无法诊断;B:Bethesda Ⅱ类 良性滤泡性腺瘤或慢性淋巴细胞性甲状腺炎;C:Bethesda Ⅲ类 意义不明确的细胞非典型病或意义不明确的滤泡性病变;D:Bethesda Ⅳ类 可疑滤泡性肿瘤;E:Bethesda Ⅴ类 可疑甲状腺乳头状癌

表4 PTC患者细胞学分类与BRAF V600E基因突变
2.5 组织病理学特征与BRAF V600E基因突变的单因素分析
研究所纳入的样本均为组织学病理证实的PTC患者(图3),对组织学病理特征与BRAF V600E基因突变的相关性进行分析,分析特征包含组织学病理类型、中央区淋巴结转移、中央区淋巴结受累个数、颈侧方淋巴结转移、颈侧方淋巴结受累个数、向外侵犯(被膜、血管以及神经侵犯)、T分期、N分期以及AJCC分期。单因素分析结果显示BRAF V600E基因突变与组织学病理类型、T分期相关(P<0.001),与中央区淋巴结转移、中央区淋巴结受累个数、颈侧方淋巴结转移、颈侧方淋巴结受累个数、向外侵犯、N分期以及AJCC分期无关,见表5。

图3 奥林巴斯BX53显微镜下BRAF V600E基因突变PTC

表5 PTC患者组织学病理特征与BRAF V600E基因突变单因素分析 [例
2.6 多因素Logistic回归分析
对单因素分析中分析得出的具有统计学意义的术前变量纳入Logistic多因素回归分析,结果显示被膜分界不清为BRAF V600E基因突变的危险因素(OR=34.117),而颈部异常淋巴结为BRAF V600E基因突变的保护因素(OR=0.071)。见表6。绘制回归模型的ROC曲线(图4),曲线下面积(area under curve,AUC)为0.921(95%CI:0.876~0.967),敏感度及特异度分别为82.9%和86.7%。
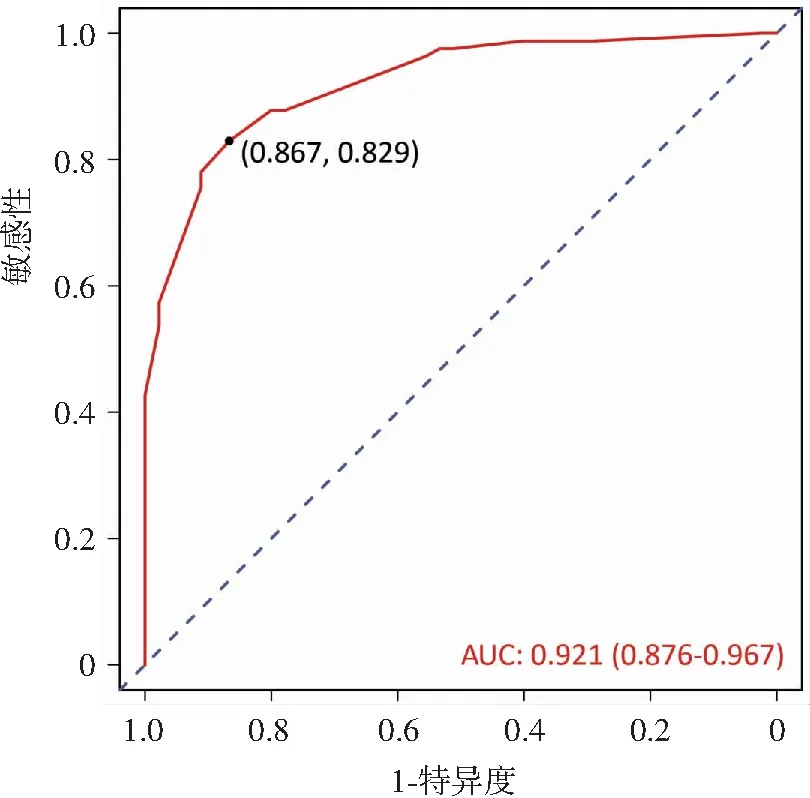
图4 FNAC分类BethesdaⅠ~ⅤPTC患者的临床影像学特征预测BRAF V600E基因突变的Logistic回归模型ROC曲线
3 讨论
本研究针对我院FNAC分类为BethesdaⅠ~Ⅴ类患者的临床数据进行回顾,分析了术后组织学病理证实为PTC患者的临床资料与BRAF V600E基因突变的相关性。一般资料得出结果与既往研究证实的女性为PTC好发人群,男女发病比例为1∶3,43%的病例发生在45~64岁,<55岁人群发病率高于≥55岁人群相吻合[4]。研究中PTC患者BRAF V600E基因突变发生率为64.57%,略低于中国PTC患者整体BRAF V600E基因突变发生率71.2%[16],这可能是研究未纳入BethesdaⅣ类PTC患者BRAF V600E基因数据导致。在对PTC患者的临床资料与BRAF V600E基因突变的相关性分析中,患者基础特征(包括性别、年龄、结节部位及甲功)与BRAF V600E基因突变无相关性。以术后病理为金标准,197例手术患者中147例(74.62%)被证实为恶性肿瘤,其中127例(86.39%)为PTC,与既往研究中PTC新发病例占比一致[5]。BethesdaⅠ~Ⅴ类结节中恶性肿瘤分布结果提示除BethesdaⅣ类结节外,余恶性概率均高于Bethesda分类报告系统给出的恶性风险[8],这表明此类结节恶性风险确被低估。但仅统计了手术病例,可能存在选择偏倚,使结果恶性比例高。
现有研究中,PTC患者超声特征对BRAF V600E基因突变的预测能力争议很大。本研究单因素分析结果显示结节与被膜分界、结节形态、超声提示颈部异常淋巴结及TIRADS分级是BRAF V600E基因突变的相关因素,多因素分析结果提示结节与被膜分界和超声提示颈部异常淋巴结是BRAF V600E基因突变的独立预测因素。有研究指出结节多灶性和纵横比是PTC患者BRAF V600E基因突变的风险因素,在本研究中未得到证实[17]。超声提示颈部异常淋巴结在既往研究中被作为BRAF V600E基因突变的预测风险因素[18],而本研究中超声提示颈部淋巴结异常是保护因素,与兰雨等[19]研究结论一致。这可能与临床实践中多对携带BRAF V600E基因突变的BethesdaⅠ~Ⅴ类患者进行手术干预,而无BRAF V600E基因突变时仅对症状明显、肿瘤较大或辅助检查高度可疑的患者进行手术干预,这就导致了BRAF V600E基因无突变组患者分期相对晚,颈部淋巴结异常患者比例高。本研究中结节与被膜分界不清是BRAF V600E基因突变的风险预测因素,与既往研究结论一致[20]。
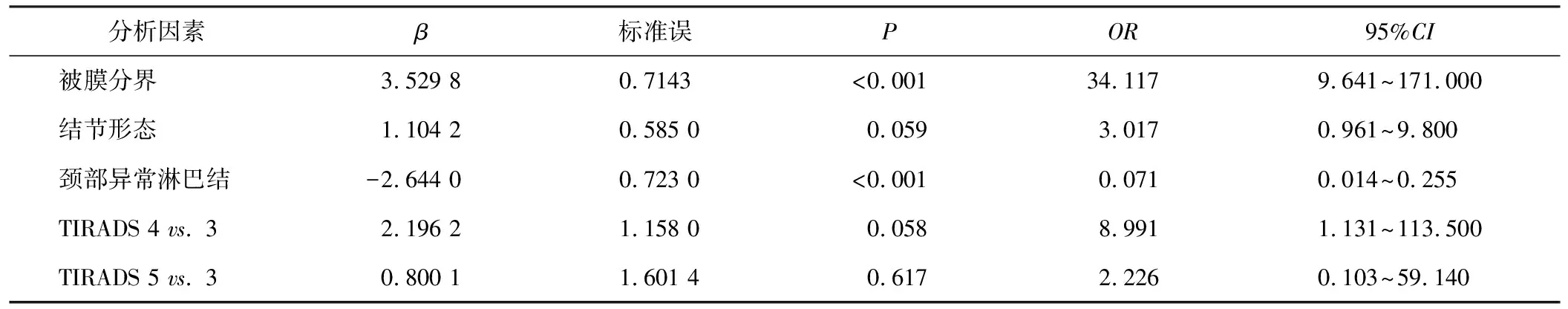
表6 多因素Logistic回归分析BRAF V600E基因突变的危险因素
单因素分析提示Bethesda分类、肿瘤T分期、是否为微小癌与BRAF V600E基因突变相关。但由于上述资料的获得发生在BRAF V600E基因检测之后,遂不予以纳入多因素分析进行风险预测。一项关于PTC患者BRAF V600E基因突变风险及预后因素的大型Meta分析确定了年龄、性别、多灶性、淋巴结转移、血管侵犯、甲状腺外侵和晚期肿瘤淋巴结转移是BRAF V600E基因突变的危险因素[21],本研究仅得出部分一致结论,后续需增加研究样本,纳入FNAC分类为Bethesda Ⅵ类的PTC患者临床数据进行分析,更全面的评估我国PTC人群BRAF V600E基因突变的相关风险因素。
综上,本研究认为BethesdaⅠ~Ⅴ类结节的恶性风险或被低估,FNAC联合BRAF V600E基因检测可提高PTC的诊断效能,减少假阴性发生。结节与被膜分界、彩超提示颈部异常淋巴结为此类患者BRAF V600E基因突变独立影响因素,可以用来预测BRAF V600E基因突变情况以提高此类结节的诊断准确率,对临床诊疗及预后评估有一定的指导意义。

