基于Notch1/NF-κB信号通路探究补阳还五汤对脑缺血再灌注损伤的拮抗作用及其机制*
李伟艺,刘红松,高山瑛,苏志强
汉中市人民医院中医康复科,陕西 汉中 723000
缺血性脑卒中是具有高致残率和致死率的临床常见疾病,是脑卒中相关死亡的主要原因[1]。虽然恢复脑组织血液供应是治疗急性缺血性脑卒中的主要目的,但这一过程同时加重了脑组织损伤,即脑缺血再灌注损伤[2]。脑缺血再灌注损伤的发生发展过程复杂,涉及炎症反应、氧化应激反应、细胞凋亡等,目前临床尚无有效治疗方法[3]。补阳还五汤是治疗缺血性脑卒中气虚血瘀证的经典中药方剂。研究表明,补阳还五汤单独或联合其他疗法对缺血性脑血管病及其后遗症均有疗效,能抑制气虚血瘀证患者内皮细胞凋亡,促进神经元再生[4-7]。虽然已有研究表明补阳还五汤对脑缺血疾病具有再灌注保护和治疗作用,但其作用机制仍需进一步探讨。Notch信号通路是一个进化高度保守的信号转导途径,在调节细胞增殖、分化和凋亡过程中起重要作用。缺血性脑卒中发生后,Notch通路的相关因子表达水平改变,激活核转录因子κB(nuclear factor-κB,NF-κB),加重炎症反应,影响疾病的发展进程[8-10]。本研究以Notch/NF-κB信号通路为切入点,分析补阳还五汤对脑缺血再灌注损伤的作用机制。
1 材料与方法
1.1 实验动物6~8周龄SPF级SD大鼠75只,雌雄各半,体质量180~220 g,购自北京维通利华实验动物技术有限公司,动物合格证号:SCXK(京)2016-0006。饲养条件:室温(22±1)℃,湿度(50±10)%,每天定时换气,保持12 h∶12 h光暗照明,食水不限。
1.2 药物、试剂与仪器补阳还五汤(黄芪120 g,当归6 g,赤芍4.5 g,桃仁3 g,红花3 g,川芎3 g,地龙3 g)由汉中市人民医院药剂科煎制浓缩成含生药2 g/mL药液;Jagged1(MCE公司,货号:HY-P1846A);TTC染色液、HE染色试剂盒(北京索莱宝科技有限公司);白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)ELISA试剂盒(武汉伊莱瑞特生物科技有限公司);Revert AidTM first Strand cDNA Synthesis Kit(美国Thermo Scientific);神经源性位点缺口同源蛋白1抗体(Notch1)、NF-κB p65、磷酸化激活核转录因子κB p65(phosphorylated nuclear factor-κB p65,p-NF-κB p65)、发状分裂相关增强子1(hairy division related enhancer,Hes1)、甘油醛-3-磷酸脱氢酶(glyceral-dehyde-3-phosphate dehydrogenase,GAPDH)兔单抗、羊抗兔二抗(美国CST公司);DYCZ-24KS型双板垂直电泳仪(北京六一仪器厂);7500型PCR仪(美国Applied Biosystems);IX53型显微镜(日本奥林巴斯);G:BOX型多功能凝胶成像系统(Syngene);Multiskan MK3型酶标仪(Thermo Fisher Scientific)。
1.3 方法
1.3.1 分组、造模与给药75只SD大鼠随机分为假手术组、模型组、补阳还五汤组、补阳还五汤+Jagged1组、Jagged1组,每组15只,适应性饲养3天后造模。参考文献[11]方法建立大鼠脑缺血再灌注损伤模型,缺血90 min后去除线栓恢复血流供应,即再灌注24 h。各给药组大鼠于术后清醒2 h后开始给药,补阳还五汤组大鼠灌胃补阳还五汤16 g/kg,早晚各1次,连续7天;补阳还五汤+Jagged1组大鼠灌胃补阳还五汤药液16 g/kg,早晚各1次,同时腹腔注射25 mg/kg Jagged1溶液,隔日1次,连续7天;Jagged1组大鼠腹腔注射25 mg/kg Jagged1溶液,隔日1次,连续7天;假手术组、模型组大鼠灌胃等量生理盐水。
1.3.2 神经功能评分采用Longa法进行神经功能评分,0分:无神经损伤症状;1分:对侧前爪不能完全伸展;2分:行走时向外侧转圈;3分:行走时向外侧倾倒;4分:不能自发行走,意识丧失;5分:死亡,评分为4~5分大鼠剔除实验。
1.3.3 大鼠脑梗死体积检测(TTC染色)实验结束后,大鼠腹腔注射10%水合氯醛麻醉,断头取脑,去除嗅球、小脑和低位脑干,-20℃冷冻20 min,沿冠状面将大脑切成2 mm厚的连续5份切片,置于0.2% TTC染色液中,37℃避光孵育30 min,置于4%多聚甲醛溶液中固定24 h后拍照,Image J软件计算大鼠脑梗死体积。
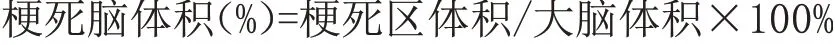
1.3.4 大鼠海马神经元损伤观察(HE染色)大鼠腹腔注射10%水合氯醛麻醉,断头取脑,脑组织用4%多聚甲醛固定,冠状切取含海马的视交叉前后3 mm脑组织,常规脱水、透明,石蜡包埋,切片(厚度为4 μm),脱蜡至水,行HE染色,观察大鼠海马神经元损伤情况。
1.3.5 海马组织IL-6、TNF-α、MDA含量和GSH-Px、SOD活性检测(ELISA法)大鼠麻醉后处死,分离海马组织,检测海马组织IL-6、TNF-α、MDA含量和GSH-Px、SOD活性。
1.3.6 B淋巴细胞瘤(B-cell lymphoma-2,Bcl-2)、Bax、半胱氨酸蛋白酶3(Caspase-3)mRNA水平检测(RT-qPCR)取各组大鼠海马组织,加入Trizol裂解液提取总RNA,使用RevertAidTM first Strand cDNA Synthesis Kit逆转录试剂盒合成cDNA,作为荧光定量模版。引物由日本Takara公司设计合成,引物序列见表1。反应体系:dNTPs 0.5 μL+5×Buffer 5 μL+Taq酶0.3 μL+MgCl2 1.5 μL+cDNA模板2 μL+上下游引物各1 μL,加去离子水至总体积25 μL。反应条件:95℃预变性5 min,95℃变性30 s,62℃退火30 s,72℃延伸30 s,共40个循环,最后72℃延伸10 min,4℃5 min终止反应,实验重复3次。采用2-△△CT法计算目的基因mRNA相对表达水平。

表1 引物序列
1.3.7 Notch1/NF-κB信号通路蛋白表达检测(Western blot法)取各组大鼠海马组织,研磨匀浆后提取组织蛋白,BCA蛋白定量试剂盒测定蛋白浓度,定量完毕后于蛋白中加入loading buffer,在EP管中混匀,置于沸水中煮沸5 min使蛋白变性。随后配置15%的分离胶和5%的浓缩胶进行SDS-PAGE电泳,上样后80 V电泳2 h,60 V转膜2 h,5%脱脂奶粉封闭2 h,将PVDF膜放入一抗稀释液中,一抗稀释比例为1∶2000,4℃过夜,第2天用TBST缓冲液清洗3次,每次10 min,然后加入羊抗兔二抗(1∶1000),37℃孵育2 h,TBST缓冲液清洗3次后滴加ECL发光液,反应1 min后置于凝胶成像系统显影。Western blot实验的内参蛋白为GAPDH,应用Image J软件分析各蛋白对应灰度值,计算蛋白相对表达量。
蛋白相对表达量=目的蛋白灰度值/内参蛋白灰度值
1.4 统计学方法应用SPSS 25.0软件分析数据,计量资料以±s表示,多样本比较采用单因素方差分析,两样本比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠神经功能损伤情况与假手术组比较,模型组大鼠出现严重神经功能损伤,神经功能评分升高(P<0.05),经补阳还五汤干预后,大鼠神经功能评分降低(P<0.05)。与补阳还五汤组比较,补阳还五汤+Jagged1组和Jagged1组大鼠神经功能评分升高(P<0.05),且Jagged1组大鼠神经功能评分高于补阳还五汤+Jagged1组。见图1。

图1 各组大鼠神经功能评分
2.2 大鼠脑梗死体积变化情况与假手术组比较,模型组大鼠脑梗死体积增加(P<0.05)。与模型组比较,经补阳还五汤干预后大鼠脑梗死体积减少(P<0.05)。与补阳还五汤组比较,补阳还五汤+Jagged1组和Jagged1组大鼠脑梗死体积增加,Jagged1组大鼠脑梗死情况更严重(P<0.05)。见图2。
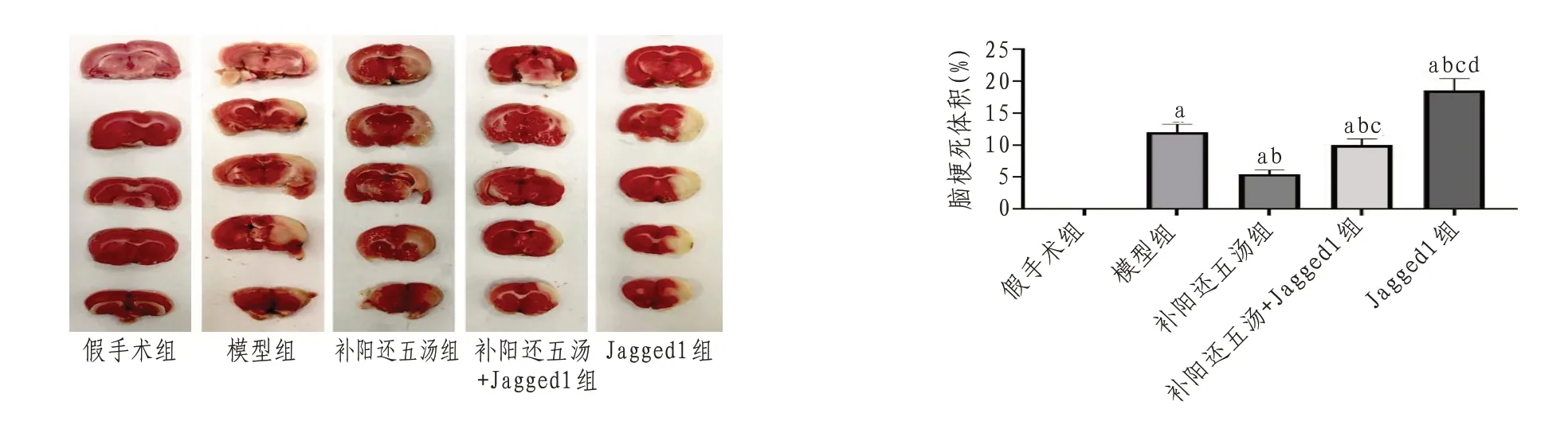
图2 各组大鼠脑梗死体积比较
2.3 大鼠海马神经元损伤情况HE染色结果显示,假手术组海马神经元细胞结构完整、排列紧密,细胞核清晰,染色均匀。模型组海马神经元结构被严重破坏,细胞核变形、固缩、破碎,染色加深,细胞排列松散且有空腔形成。补阳还五汤干预后海马神经元损伤情况改善,Jagged1干预使补阳还五汤对海马神经元的保护作用减弱,且Jagged1组海马神经元损伤较补阳还五汤+Jagged1组更严重。见图3。
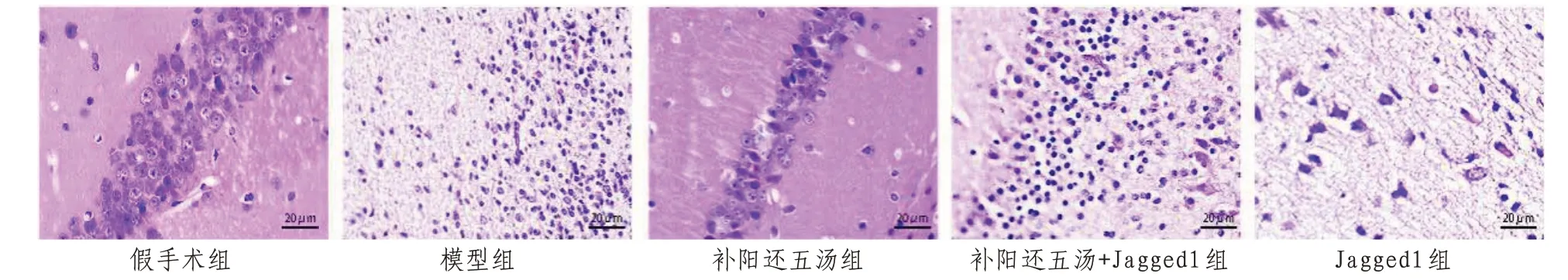
图3 各组大鼠海马神经元损伤情况(HE×400)
2.4 大鼠海马组织炎症和氧化应激情况与假手术组比较,模型组海马组织IL-6、TNF-α、MDA含量增加,GSH-Px、SOD活性降低(P<0.05)。与模型组比较,补阳还五汤组海马组织IL-6、TNF-α、MDA含量降低,GSH-Px、SOD活性增加(P<0.05)。与补阳还五汤组比较,补阳还五汤+Jagged1组和Jagged1组IL-6、TNF-α、MDA含量增加,GSH-Px、SOD活性降低(P<0.05),且Jagged1组IL-6、TNFα、MDA含量高于补阳还五汤+Jagged1组,GSH-Px、SOD活性低于补阳还五汤+Jagged1组。见表2。
表2 各组大鼠海马组织炎症因子和氧化应激水平比较(±s)
注:a表示与假手术组比较,P<0.05;b表示与模型组比较,P<0.05;c表示与补阳还五汤组比较,P<0.05;d表示与补阳还五汤+Jagged1组比较,P<0.05
组别假手术组模型组补阳还五汤组补阳还五汤+Jagged1组Jagged1组鼠数15 12 13 12 11 IL-6(ng/L)250.15±39.41 790.56±52.82a 349.21±33.64ab 687.25±40.92abc 867.65±46.37abcd TNF-α(ng/L)230.41±32.68 1600.95±47.13a 890.65±45.38ab 1307.26±48.72abc 1901.85±60.14abcd MDA(nmol/mg)11.22±1.34 19.32±1.26a 14.81±1.22ab 16.88±1.29abc 22.94±1.38abcd GSH-Px(U/mg)96.26±9.88 42.32±7.21a 70.68±8.02ab 55.29±6.94abc 33.84±6.12abcd SOD(U/mg)230.59±17.42 102.46±15.33a 195.62±16.84ab 157.34±19.72abc 90.59±13.95abcd
2.5 大鼠海马组织Bcl-2、Bax、Caspase-3的mRNA表达与假手术组比较,模型组海马组织Bax与Caspase-3的mRNA表 达 增 加,Bcl-2 mRNA表 达降低(P<0.05)。与模型组比较,补阳还五汤组Bax与Caspase-3的mRNA表达降低,Bcl-2 mRNA增加(P<0.05)。与补阳还五汤组比较,补阳还五汤+Jagged1组 和Jagged1组Bax、Caspase-3的mRNA表达增加,Bcl-2 mRNA表达降低(P<0.05),且Jagged1组Bax、Caspase-3的mRNA表达高于补阳还五汤+Jagged1组,Bcl-2 mRNA表达低于补阳还五汤+Jagged1组。见图4。
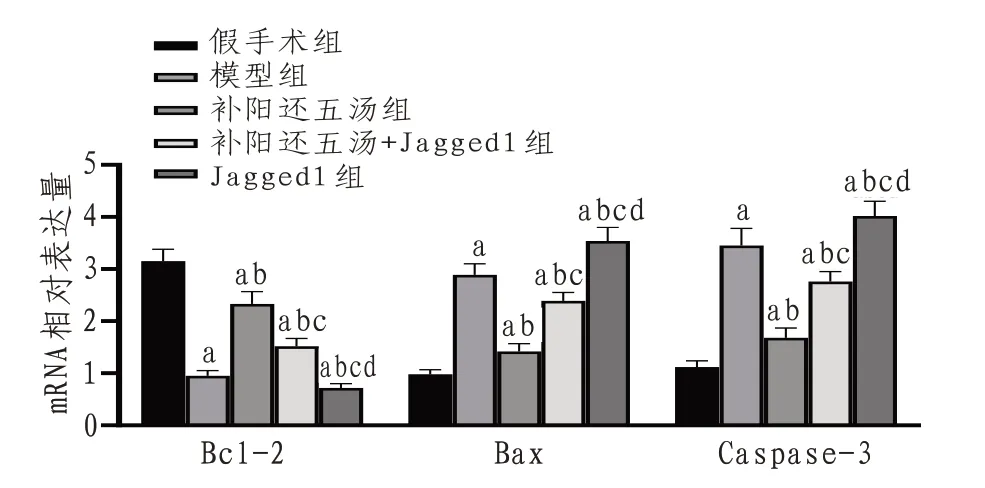
图4 各组大鼠海马组织Bcl-2、Bax、Caspase-3的mRNA表达
2.6 Notch1/NF-κB信号通路相关蛋白表达与假手术组比较,模型组海马组织Notch1、p-NF-κB p65及Hes-1蛋白表达水平均上调(P<0.05),NF-κB p65蛋白表达水平比较差异无统计学意义(P>0.05);补阳还五汤干预后Notch1、p-NF-κB p65及Hes1蛋白表达水平降低(P<0.05),NF-κB p65蛋白表达水平差异无统计学意义(P>0.05);在补阳还五汤基础上加入Jagged1干预,Notch1、p-NF-κB p65及Hes1蛋白表达增加,Jagged1组上述蛋白表达量高于补阳还五汤+Jagged1组(P<0.05),NF-κB p65蛋白表达水平差异无统计学意义(P>0.05)。见图5。
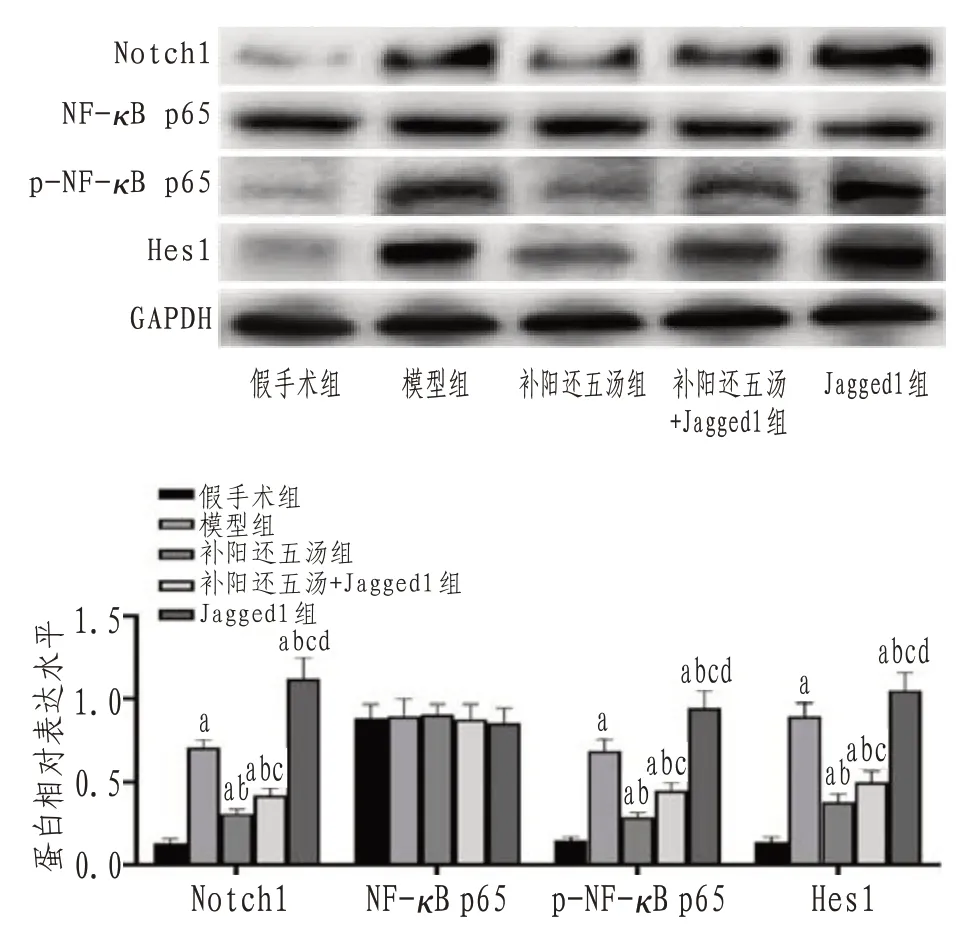
图5 各组大鼠Notch1/NF-κB信号通路蛋白表达
3 讨论
缺血性脑卒中是指由于脑供血动脉狭窄或闭塞引起脑供血不足所致的脑组织坏死的总称,其治疗方法以溶栓为主,但在治疗过程中可能继发新的病理改变,诱发缺血再灌注损伤[12-13]。脑缺血再灌注损伤过程中的炎症和氧化应激反应是引起脑卒中患者脑组织损伤、运动和认知神经功能异常的主要原因,可间接反应患者的脑损伤程度[14]。本研究采用线栓法制备大鼠脑缺血再灌注模型,结果显示,与假手术组比较,模型组大鼠出现明显神经功能损伤,脑梗死体积显著增加,神经元损伤明显,海马组织炎症因子IL-6和TNF-α含量增加,氧化应激因子MDA含量增加,GSH-Px、SOD活性降低,表明模型组大鼠脑组织发生炎症和氧化应激反应,脑损伤明显,提示造模成功。
补阳还五汤是治疗气虚血瘀证脑中风恢复期的经典方剂,方中重用黄芪大补脏腑经脉营卫之气,当归、赤芍、桃仁、红花、川芎共为臣药行气活血,地龙为佐药通经活络、舒畅血脉,诸药相互为用,共奏补气活血通络之功效[15]。本研究结果显示,补阳还五汤干预后大鼠神经功能损伤减轻,脑梗死体积缩小,海马神经元损伤减轻。大量研究表明,氧化应激和炎症反应作为脑缺血再灌注后的关键分子机制,其对缺血性脑疾病的发生发展过程具有重要作用,针对这些机制进行靶向治疗显示出较好的神经保护作用[16-17]。周佳[18]、贾壮壮等[19]研究表明,抑制氧化应激和炎症反应能够抑制神经细胞凋亡,有效减轻脑缺血再灌注大鼠神经功能缺损。本研究结果显示,补阳还五汤可降低脑缺血大鼠海马组织中IL-6、TNF-α、MDA含量,提高GSH-Px、SOD活性。Bcl-2和Bax是调控细胞凋亡的关键基因,Bax过表达可促进细胞凋亡,而Bcl-2可与Bax形成二聚体抑制Bax基因表达,从而抑制细胞凋亡,Bcl-2和Bax可共同激活促凋亡因子Caspase-3及其家族的其他因子,引起衰老和凋亡的发生[20]。在本研究中,经补阳还五汤干预后脑缺血大鼠海马组织Bax与Caspase-3的mRNA表达降低,Bcl-2 mRNA增加,表明补阳还五汤对脑缺血再灌注损伤具有抗炎、抗氧化应激和抗凋亡作用。
Notch信号通路在进化上有高度保守性,与细胞增殖、分化、凋亡及干细胞自我更新活动密切联系,是调控神经元凋亡的关键信号通路之一[21-22]。研究表明,脑缺血发生时γ-分泌酶被瞬时激活,使得海马中Notch1水平上调,而Notch1可使NF-κB中的p65亚基增加,进一步加重炎症细胞浸润,炎性因子的表达水平升高,加重脑缺血期的神经元损伤[23]。Hes1是Notch1的下游靶基因,其表达水平直接反映了Notch1表达情况[24]。本研究显示补阳还五汤降低了Notch1、p-NF-κB p65及Hes1蛋白表达水平,表明补阳还五汤对脑缺血再灌注损伤的保护作用可能与Notch/NF-κB信号通路有关。为了进一步验证补阳还五汤是否通过Notch/NF-κB信号通路发挥对脑缺血再灌注损伤的保护作用,本研究使用了Notch1抑制剂Jagged1,结果显示Jagged1的干预削弱了补阳还五汤减轻大鼠神经功能和海马神经元损伤、缩小脑梗死体积的作用,同时加重了氧化应激和炎性反应,促进细胞凋亡,Notch1、p-NF-κB p65及Hes1蛋白的表达水平增加,而这种现象在Jagged1组更为显著,说明在Jagged1干预下,Notch1表达被上调,加重脑缺血再灌注损伤,而补阳还五汤可以拮抗这种作用,发挥对脑缺血后脑组织和神经元细胞的保护作用。
综上所述,本研究初步证实了补阳还五汤可下调Notch1表达,抑制Notch1/NF-κB信号通路的激活,发挥对缺血再灌注脑组织的保护作用。但该调控过程中是否有其他相关蛋白的参与,仍需进一步研究。

